基于Rho/Rock通路当归红芪多糖对H9C2细胞放射性心肌损伤的影响
2019-07-01蒋虎刚冯明霞刘凯任春贞纪召娟赵信科李应东
蒋虎刚 冯明霞 刘凯 任春贞 纪召娟 赵信科 李应东


摘要:目的 基于Rho/Rock通路观察当归红芪多糖对H9C2细胞放射性损伤的影响,探讨其干预放射性心肌损伤作用机制。方法 将细胞随机分为空白组(不干预)、模型组(2 Gy X线照射并予生理盐水干预)、阳性对照组(2 Gy X线照射并予阳性药干预)和中药低、中、高剂量组(2 Gy X线照射并予当归红芪多糖干预),ELISA检测细胞超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)的表达,RT-PCR检测各组细胞一氧化氮合酶(iNOS)、内皮型一氧化氮合酶(eNOS)、Rhoa、Rock mRNA的表达,Western blot检测细胞诱导型iNOS、eNOS、Rhoa、Rock蛋白的表达,流式细胞术检测细胞凋亡。结果 与空白组比较,模型组细胞SOD、GSH、eNOS蛋白及eNOS mRNA表达下调,MDA、iNOS、RhoA、Rock蛋白及iNOS、RhoA、Rock mRNA表达上调,细胞发生凋亡;与模型组比较,药物干预组细胞SOD、GSH、eNOS蛋白及eNOS mRNA表达上调,MDA、iNOS、RhoA、Rock蛋白及iNOS、RhoA、Rock mRNA表达下调,细胞凋亡减少。结论 当归红芪多糖可通过抑制氧化应激、Rho/Rock通路活化、细胞凋亡等干预放射性心肌损伤。
关键词:当归红芪多糖;氧化应激反应;Rho/Rock通路;细胞凋亡
中图分类号:R285.5 文獻标识码:A 文章编号:1005-5304(2019)05-0054-05
DOI:10.3969/j.issn.1005-5304.2019.05.012 开放科学(资源服务)标识码(OSID):
Abstract: Objective To investigate the effects of polysaccharide from Angelicae Sinensis Radix and Hedysari Radix on H9C2 cells injured by radiation based on Rho/Rhck pathway; To discuss its mechanism ofinterfere with radiation-induced heart disease (RIHD). Methods The cells were randomly divided into blank group (no intervention), model group (2 Gy X-ray irradiation and physiological saline intervention), positive control group (2 Gy X-ray irradiation and positive medicine intervention), and TCM low-, medium- and high-dosage group (2 Gy X-ray irradiation and intervention with polysaccharide from Angelicae Sinensis Radix and Hedysari Radix). The expressions of SOD, MDA and GSH were detected by ELISA. The QT-PCR method was used to detect the expressions of iNOS, eNOS, RhoA and Rock mRNA, and the expressions of iNOS, eNOS, RhoA and Rock protein were detected by Western blot. The apoptosis of each group was detected by flow cytometry. Results Compared with the blank group, the expressions of SOD, GSH, eNOS protein and eNOS mRNA were down-regulated in the model group, and the expressions of MDA, iNOS, Rhoa, Rock protein and iNOS, RhoA, Rock mRNA were up-regulated, and cells were under apoptosis. Compared with the model group, the expressions of SOD, GSH, eNOS protein and eNOS mRNA were up-regulated, and the expressions of MDA, iNOS, RhoA, Rock protein and iNOS, RhoA and Rock mRNA were down-regulated, and apoptosis was alleviated in medicine intervention groups. Conclusion Polysaccharide from Angelicae Sinensis Radix and Hedysari Radix can interfere with RIHD by inhibiting oxidative stress, activation of Rho/Rock pathway, and apoptosis.
Keywords: polysaccharide from Angelicae Sinensis Radix and Hedysari Radix; oxidative stress; Rho/Rock pathway; apoptosis
胸腔恶性肿瘤放射治疗及心脏介入手术的广泛开展,不可避免造成放射性心肌损伤(radiation- induced heart disease,RIHD)[1]。射线剂量的增加是提高放疗效果的重要手段之一,RIHD限制放射剂量的提高使其疗效减低,但RIHD亦是慢性心力衰竭的重要病因之一[2]。研究发现,RIHD表现为心脏的迟发应激反应,其后期心脏组织最主要的病理改变是心肌纤维化[3-4],而纤维化是一种不可逆的病理改变。目前对RIHD发病机制、干预措施尚无统一的认识,但有研究结果表明,RIHD可能与Rho/Rock信号通路关系密切,同时Rho/Rock信号通路与细胞的炎症反应、氧化应激、凋亡等亦存在着紧密联系[5]。因此,基于Rho/Rock信号通路探讨RIHD的发病机制、防治策略具有客观基础。研究表明,当归红芪多糖成分有清除自由基、抗氧化、抗炎等作用[6-7],但其防治RIHD的机制、疗效尚未明确。因此,本研究以Rho/Rock信号通路为中心,采用ELISA、QT-PCR、Western blot、流式细胞术等手段探讨氧化应激、Rho/Rock通路活化、细胞凋亡之间的关系,进一步揭示RIHD发病机制及当归红芪多糖的干预作用,为防治RIHD及早期预防心力衰竭提供依据。
1 材料与方法
1.1 细胞
H9C2细胞由甘肃中医药大学中西医结合研究所提供,经刘凯副教授鉴定为正常H9C2细胞。
1.2 药物与试剂
当归红芪多糖为本课题组前期分离所得[6-7],批号2016-06-3;硫辛酸,批号20161012013F,上海士锋生物科技有限公司;法舒地尔,批号I10428-201601,南京莱富赛生物科技有限公司;兔抗诱导型一氧化氮合酶(iNOS)抗体、兔抗内皮型一氧化氮合酶(eNOS)抗体、兔抗RhoA抗体、兔抗Rock抗体,上海康朗生物科技有限公司;超氧化物歧化酶(SOD)、丙二醛(MDA)、谷胱甘肽(GSH)试剂盒,南京建成生物化学试剂有限公司;总RNA提取试剂盒、RT-PCR试剂盒,上海吉玛制药技术有限公司;Annexin Ⅴ-FITC试剂盒,德国Miltenyi Biotec公司。
1.3 仪器
超净工作台、Eppendorf移液枪、二氧化碳培养箱、酶标仪,Thermo公司;实时定量PCR仪、核酸蛋白浓度测定仪,BIO-RAD公司;高速低温离心机,Sigma公司;精密电子天平,OHAUS公司;流式细胞仪,Becton Dickinson公司。
1.4 造模
本課题组前期研究发现,2 Gy辐射剂量为建立RIHD细胞模型的最佳辐射剂量,同时参考相关文献辐射剂量[8-9],因此本研究采用2 Gy辐射剂量X线照射建立RIHD模型。
1.5 干预
将细胞随机分为空白组(不干预)、模型组(2 Gy X线照射并予生理盐水干预)、阳性对照组(2 Gy X线照射并予0.2 mmol/L硫辛酸或0.1 mmol/L法舒地尔溶液干预)和中药低、中、高剂量组(2 Gy X线照射并分别予当归红芪多糖0.1、0.2、0.4 g/L干预)。上述给药均为单次给药,给药体积均为0.2 mL,给药时间均为模型建立完成后,检测时间为给药后24 h。
1.6 指标检测
SOD、MDA、GSH检测时严格按ELISA试剂盒说明书进行,主要步骤包括:加样0.1 mL样本后37 ℃孵育1 h,洗涤3次后滴加酶标抗体0.1 mL,37 ℃孵育1 h,洗涤后加显色液0.1 mL,37 ℃孵育30 min,最后终止反应并检测。PCR检测时根据总RNA提取试剂盒说明书提取细胞中总mRNA,并根据表1要求配制反转录体系。反转录程序:25 ℃、5 min,42 ℃、60 min,70 ℃、10 min,4 ℃保存。扩增体系见表2。扩增程序反应设置:95 ℃、2 min,95 ℃、15 s,60 ℃ 1 min,40个循环。检测细胞mRNA的表达,引物序列见表3。Western blot检测时依次提取制备蛋白样品、配制凝胶、电泳、转膜、封闭、一抗孵育、二抗孵育、曝光,浓缩胶电泳(80 V),分离胶电泳(120 V),转膜(80 V、120 min),采用Bio-RAD检测条带,并用Bio-RAD Quantityone图像分析软件检测;流式细胞术检测细胞凋亡,按Annexin Ⅴ-FITC试剂盒说明书进行。
1.7 统计学方法
采用SPPS24.0统计软件进行分析。实验结果以±s表示,组间比较采用方差分析。P<0.05表示差异有统计学意义。
2 结果
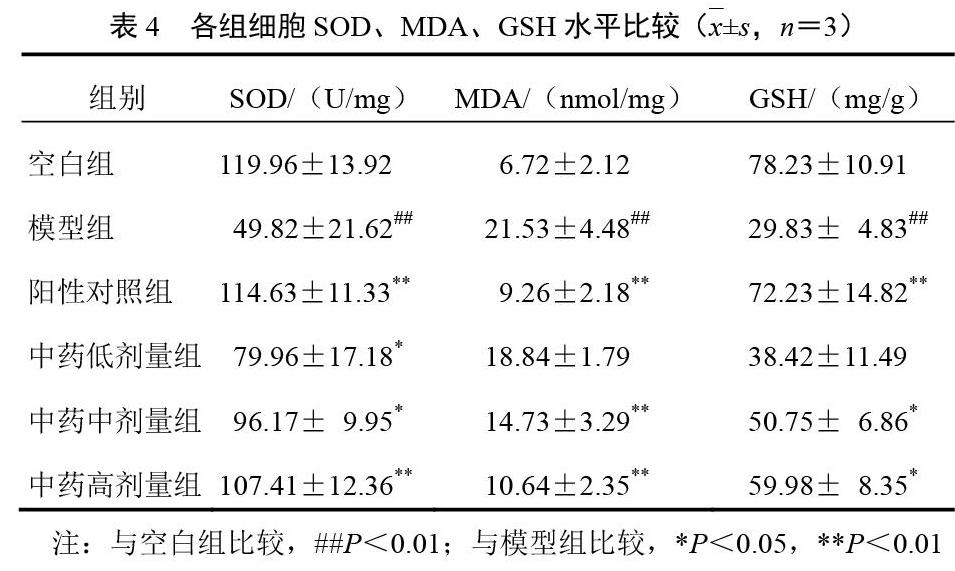
2.1 ELISA检测结果
与空白组比较,模型组细胞SOD、GSH表达明显下调(P<0.01),MDA表达明显上调(P<0.01);与模型组比较,阳性对照组细胞SOD、GSH表达明显上调(P<0.01),MDA表达明显下调(P<0.01);中药低剂量组SOD、GSH表达上调,MDA表达无改变;中药中剂量组细胞SOD、GSH表达明显上调(P<0.05),MDA表达明显下调(P<0.01);中药高剂量组细胞SOD、GSH表达明显上调(P<0.05,P<0.01),MDA表达明显下调(P<0.01)。结果见表4。
2.2 RT-PCR检测结果
与空白组比较,模型组细胞iNOS、RhoA、Rock mRNA表达明显上调(P<0.05),eNOS mRNA表达明显下调(P<0.05);与模型组比较,阳性对照组细胞iNOS、RhoA、Rock mRNA表达明显下调(P<0.01),eNOS mRNA表达明显上调(P<0.01);中药低剂量组细胞iNOS mRNA表达明显下调(P<0.05),eNOS、RhoA mRNA表达无改变(P>0.05);中药中剂量组细胞iNOS、RhoA、Rock mRNA表达明显下调(P<0.05,P<0.01),eNOS mRNA表达无改变(P>0.05);中药高剂量组细胞iNOS、RhoA、Rock mRNA表达明显下调(P<0.05,P<0.01),eNOS mRNA表达明显上调(P<0.05)。结果见表5。
2.3 Western blot检测结果
与空白组比较,模型组细胞iNOS、RhoA、Rock蛋白表达明显上调(P<0.05),eNOS蛋白表达明显下调(P<0.05);与模型组比较,阳性对照组细胞iNOS、RhoA、Rock蛋白表达明显下调(P<0.01),eNOS蛋白表达明显上调(P<0.05);中藥低剂量组细胞iNOS、Rock蛋白表达明显下调(P<0.05,P<0.01),eNOS、RhoA蛋白表达无改变(P>0.05);中药中剂量组细胞RhoA、Rock、iNOS蛋白表达明显下调(P<0.05,P<0.01),eNOS蛋白表达无改变(P>0.05);中药高剂量组细胞iNOS、RhoA、Rock蛋白表达明显下调(P<0.05,P<0.01),eNOS蛋白表达明显上调(P<0.05)。结果见表6、图1。
2.4 流式细胞仪检测结果
与空白组比较,模型组早、晚期凋亡细胞比例均明显增高(P<0.05,P<0.01),正常细胞比例明显降低(P<0.01);与模型组比较,阳性对照组晚期凋亡细胞比例明显降低(P<0.01),早期凋亡细胞比例明显降低(P<0.05),正常细胞比例明显升高(P<0.01);中药低剂量组早、晚期凋亡细胞比例无明显降低(P>0.05),正常细胞比例无明显升高(P>0.05);中药中剂量组晚期凋亡细胞比例明显降低(P<0.05),早期凋亡细胞比例无明显降低(P>0.05),正常细胞比例明显升高(P<0.05);中药高剂量组早、晚期凋亡细胞比例均明显降低(P<0.05,P<0.01),正常细胞比例明显升高(P<0.01)。见表7、图2。
3 讨论
3.1 放射性心肌损伤氧化应激反应与Rho/Rock通路活化
本研究发现模型组细胞SOD、GSH的表达显著升高而MDA的表达明显降低,同时Rho/Rock通路明显活化,表明RIHD时细胞发生明显的氧化应激与Rho/Rock通路活化,但关于RIHD时氧化应激与Rho/Rock通路活化的关系尚不明确。因此本研究采用硫辛酸干预RIHD氧化应激后比较Rho/Rock通路活化水平,发现抑制氧化应激后Rho/Rock通路活化明显受到抑制,表明氧化应激是Rho/Rock通路活化的上游信号。本研究还发现,当归红芪多糖干预氧化应激并抑制Rho/Rock通路活化时具有剂量依赖性,高剂量当归红芪多糖对氧化应激及Rho/Rock通路活化具有明显的抑制作用。通过比较当归红芪多糖各组SOD、MDA、GSH的水平发现,当归红芪多糖对SOD、MDA较GSH具有更为明显的调节作用。GSH是自身合成的一种非酶性抗氧化剂,可作为细胞内蛋白质合成、能量代谢等多种代谢活动的供氢体;在参与抗氧化反应时,其可通过自身巯基与氧自由基等结合及复活已被灭活的巯基酶而减少氧自由基对细胞膜中含巯基的蛋白的破坏;细胞凋亡早期,在巯基转移酶的调节下GSH维持半胱氨酸的还原状态而使其自身水平降低,可作为氧化应激导致细胞凋亡的早期信号[10-11]。因此,推测本研究中当归红芪多糖对GSH表达调节作用较弱的可能机制为当归红芪多糖能更为广泛的抑制氧化应激、减少氧自由基生成而减少GSH的消耗。
3.2 Rho/Rock通路活化与细胞凋亡
本研究发现模型组细胞早、晚期凋亡细胞比例明显升高,且正常细胞比例明显降低,表明细胞发生明显凋亡,而细胞凋亡与Rho/Rock通路活化的相关性尚不明确。因此,本研究通过法舒地尔抑制Rho/Rock通路活化后检测细胞的凋亡变化,发现抑制Rho/Rock通路活化后细胞凋亡明显减轻,表明细胞凋亡是Rho/Rock通路活化的下游信号。通过通过比较当归红芪多糖各组细胞凋亡水平发现,低剂量当归红芪多糖无调节细胞凋亡作用;中剂量当归红芪多糖可调节细胞晚期凋亡及正常细胞水平,而无调节早期凋亡作用;高剂量当归红芪多糖可调节细胞早、晚期凋亡及正常细胞水平,表明中、高剂量当归红芪多糖可明显调节细胞凋亡。研究表明,Caspase-3是一种潜在的Rock激动剂,可破坏Rock分子的自身折返并暴露其活化中心,而活化的Rock可激活Caspase-3,并使其自身裂解产生Rock,因此,Rock既是Caspase-3的激动剂又是其活化产物[12-13]。推测当归红芪多糖通过抑制Rho/Rock通路活化减少凋亡蛋白Caspase-3的表达而抑制细胞凋亡,同时Caspase-3表达的减低又可抑制Rho/Rock通路活化,从而形成良性循环,进一步干预RIHD时Rho/Rock通路活化与细胞凋亡,并干预RIHD。
综上所述,高剂量X线辐射可致细胞氧化应激后激活Rho/Rock通路并进一步诱导细胞凋亡,而当归红芪多糖可通过抑制氧化应激、Rho/Rock通路活化、细胞凋亡3条途径干预RIHD。本研究通过探讨RIHD的发病机制及当归红芪多糖干预RIHD的作用机制,为突破放疗瓶颈、防治RIHD及早期预防心力衰竭提供依据。
参考文献:
[1] MING X, FENG Y, YING C, et al. Radiation-induced heart disease in lung cancer radiotherapy:A dosimetric update[J]. Medicine, 2016,95(41):1-6.
[2] KISCSATARI L, SARKOZY M, KOVARI B, et al. High-dose radiation induced heart damage in a rat model[J]. In Vivo,2016,30(5):623-631.
[3] FINCH W, SHASMA K, LEE M S. Cardiovascular complications of radiatio exposure[J]. Reviews in Cardiovascular Medicine,2014, 15(3):232-244.
[4] SHARMA S, MOROS E G, BOERMA M, et al. A novel technique for image-guided local heart irradiation in the Rat[J]. Technology in Cancer Research & Treatment,2014,13(6):593-603.
[5] HENNINGER C, FRITZ G. Statins in anthracycline-induced cardiotoxicity:Rac and Rho, and the heart breakers[J]. Cell Death & Disease,2017,8(11):1032-1041.
[6] 李淑玲,刘凯,赵信科,等.当归红芪多糖对急性心肌缺血大鼠的保护作用[J].中国实验方剂学杂志,2016,22(17):92-96.
[7] 朱贝贝,畅艳娜,李应东,等.当归红芪多糖对辐射损伤心肌细胞线粒体凋亡通路的影响[J].北京中医药大学学报,2015,38(12):811-816.
[8] BRIDERHABAN A. Radiation dose to patients in coronary interventional procedures:a survey[J]. Radiat Prot Dosimetry, 2018,21(7):1-4.
[9] UNIYAL S C, CHA V, SHARAMA S D, et al. Pattient dosimetry during interventional cardiac procedures in a dedicated catheterization laboratory[J]. Radiat Prot Dosimetry,2017,175(2):201-208.
[10] CHEN T, WANG R, JIANG W, et al. Protective effect of Astragaloside Ⅳ against paraquat-induced lung injury in mice by suppressing Rho signaling[J]. Inflammation,2016,39(1):483-492.
[11] SARI-HASSOUN M, CLEMENT M J, HAMDI I, et al. Cucurbitacin Ⅰ elicits the formation of actin/phospho-myosin Ⅱ coaggregates by stimulation of the RhoA/ROCK pathway and inhibition of LIM-kinase[J]. Biochemical Pharmacology,2016,102:45-63.
[12] DOS A, SANTOS A, LOPEZ-GRANERO C, et al. Oxidative stress, caspase-3 activation and cleavage of ROCK-1 play an essential role in MeHg-induced cell death in primary astroglial cells[J]. Food and Chemical Toxicology,2018,113:328-336.
[13] JUNG M H, NIAKAPTY C, JUNG J. DNA vaccine encoding myristoylated membrane protein (MMP) of rock bream iridovirus (RBIV) induces protective immunity in rock bream (Oplegnathus fasciatus)[J]. Vaccine,2018,36(6):802-810.
(收稿日期:2018-10-10)
(修回日期:2018-10-25;編辑:华强)
