异氟烷和异丙酚对前列腺癌细胞HIF-1α通路的调控
2019-07-01林诗发
林诗发
(海口市第三人民医院麻醉科,海南 海口 570000)
恶性肿瘤是一种严重威胁人类健康的疾病,死亡率仅次于心脑血管疾病〔1〕。目前手术仍然是大多数实体瘤的主要治疗手段,但治疗效果不佳,复发率高。临床实践表明:与单独使用全身麻醉剂相比,配伍局部麻醉剂可改善各种癌症患者术后情况〔2〕。一个涉及225例前列腺切除术的研究表明:与单纯全身麻醉剂相比,配伍硬膜外麻醉剂复发率降低57%〔3〕。全身麻醉剂具有特异性细胞信号传导的作用,如吸入麻醉剂氙气可上调转录因子——缺氧诱导因子(HIF)-1α,这类药物对缺氧损伤的器官具有细胞保护作用〔4〕。相反,静脉麻醉剂——异丙酚已被证明具有相反的作用,可抑制HIF-1α蛋白合成〔5~7〕。HIF-1α是肿瘤生长过程中的关键调节器,已成为潜在的治疗靶标,可激活下游的基因,促进细胞增殖、血管生成和转移,癌细胞利用随后的表型反应,不仅可在恶劣的环境中促进自身存活,而且比周围的健康细胞更有竞争优势〔8~10〕。本研究使用成熟的前列腺癌PC3细胞系,通过观察麻醉剂诱导活化的HIF-1α对前列腺癌细胞生长、迁移和侵袭过程的影响,比较吸入麻醉剂异氟烷与静脉麻醉剂异丙酚单独和组合使用的区别。
1 材料和方法
1.1材料
1.1.1细胞系 人前列腺癌PC3细胞系购于American Type Culture Collection (ATCC,Manassas,VA,USA)。
1.1.2试剂 RPMI1640培养基、DMEM高糖培养基(美国HyClone实验室),胎牛血清(FBS,英国ThermoScientific公司)、二甲基亚砜(DMSO)脂肪乳(天津博迪化工有限公司),HIF-1α siRNA(英国Qiagen公司),其他试剂购于上海碧云天生物技术有限公司。
1.2方法
1.2.1细胞培养 将人前列腺癌PC3细胞系(源自晚期雄激素非依赖性骨转移的前列腺癌)接种到RPMI1640培养基(含10%热灭活的FBS、2 mmol/L L-谷氨酰胺、100 U/ml青霉素/链霉素)中,在37℃、5%CO2的培养箱培养。培养基每48 h更换一次。
异氟烷处理:将PC3细胞以1×106个/ml的密度接种于30 mm2培养皿上,24 h后细胞融合达到80%时使用。用含有血清的新鲜RPMI1640培养基替换原培养基,置于鼓风培养箱中培养,并使用校准流量计和蒸发器输送所需的异氟烷(0.5%~2.0%)组分(含21%O2和5%CO2的氮气),在37℃下用所需浓度的异氟烷处理细胞2 h。取出细胞,用全培养基代替无血清培养基,培养皿再次放回到37℃、含有5%CO2的标准培养箱中进一步分析;空白对照组细胞置于37℃、含有21%O2和5%CO2的氮气的培养箱中培养。在异氟烷处理后的0~24 h内不同时间点分析细胞。
异丙酚处理:异丙酚制剂分别溶于10%的脂肪乳、DMSO中。将PC3细胞以1×106个/ml的密度接种在30 mm2培养皿上。
在异丙酚形成脂质体时,异丙酚用PC3培养基稀释至0.4 mg/ml。实验前,异丙酚母液用PC3无血清培养基稀释至所需浓度(0.5~10.0 μg/ml)。脂肪乳对照组:20%的脂肪乳用细胞培养基稀释到使用时的最高浓度10 μg/ml;DMSO对照组:在培育细胞前,异丙酚用PC3无血清培养基稀释至临床常用浓度(1.0~4.0 μg/ml)。DMSO对照组与4.0 μg/ml异丙酚中DMSO的量(0.05%)相对应。将含有异丙酚的培养基培养细胞2 h。用磷酸盐缓冲液(PBS)洗涤细胞并再次使用PC3细胞培养基培养。
异氟烷和异丙酚配伍处理时,细胞先用含异丙酚(溶在脂肪乳或DMSO中,浓度为0~10 μg/ml)的培养基处理,然后用2.0%异氟烷处理2 h。随后,异丙酚培养基用PC3细胞培养基替换,培养24 h后收集细胞。
1.2.2氯化钴(CoCl2)介导的HIF-1α诱导培养 将CoCl2粉末溶解在dH2O中制备1 mmol/L CoCl2母液,母液用含异丙酚的无血清PC3细胞培养基(0~4 μg/ml的脂肪乳)进一步稀释至100 μmol/L。处理前,将PC3细胞以1×106/ml的密度接种在30 mm2培养皿上,用含异丙酚的CoCl2培养基替换完全培养基,培养6 h。处理后立即收取细胞进行免疫印迹试验。
1.2.3缺氧HIF-1α诱导培养 将细胞置于鼓风培养箱中,在37℃、含1%O2和5%CO2的氮气中培养18 h。立即收取细胞用于Western印迹试验。
1.2.4siRNA靶向沉默HIF-1α 根据siRNA设计原则,设计HIF-1α基因siRNA序列如下:正义链5′-GAAGAACUAUGAACAUAAATT-3′,反义链5′-UUUAUGUUCAUAGUUCUUCCT-3′;非siRNA靶向沉默的非特异性基因作为阴性对照,基因序列由上海吉玛制药技术有限公司合成,使用脂质体RNAi MAX(表达载体)进行转染。PC3细胞培养浓度为0.4×106个/ml,并用siRNA靶向沉默的人类HIF-1α基因或20 nmol/L的脂质体siRNA悬液缓冲剂处理。将处理后的细胞在5%CO2、37℃下培养6 h。PBS洗涤细胞,使用异氟烷、异丙酚、多西他赛(DTX)进行处理后加入无血清培养基培养。
1.2.5化疗剂处理PC3细胞 治疗前列腺癌的抗有丝分裂化疗剂——DTX与异氟烷和异丙酚联合应用处理PC3细胞。使用异氟烷、异氟烷和异丙酚联合处理PC3细胞24 h;异氟烷处理siRNA预处理的PC3细胞24 h。将含1 mmol/L DTX的PC3培养基母液稀释至10~100 μmol/L,替代原培养基培养上述细胞24 h。
1.2.6PI3K和MEK抑制剂处理PC3细胞 将PC3细胞(1×106个/ml)接种在30 mm2培养皿中,用磷脂酰肌醇3激酶(PI3K)选择性抑制剂LY294002或丝裂原活化蛋白(MAPK)/细胞外调节激酶(ERK)选择性抑制剂U0126处理,在5%CO2、37℃的孵育箱中培养16 h。将异氟烷、异丙酚溶于无菌DMSO中,制备浓度为10 mmol/L的母液,用无血清培养基稀释至50 μmol/L。麻醉剂处理后立即收取细胞用于免疫印迹试验。
1.2.7免疫印迹试验 用冰冷的PBS洗涤上述对照或处理的PC3细胞,并在细胞裂解缓冲液〔含20 mmol/L Tris-HCl(pH7.5),150 mmol/L NaCl,1 mmol/L Na2-EDTA,2 mmol/L EGTA,1%Triton,2.5 mmol/L Na4P2O7,1 mmol/L β-甘油磷酸盐,1 mmol/L Na3VO4,1 μg/ml亮抑酶肽,1 mmol/L苯基甲磺酰氟和1 mmol/L二硫苏糖醇〕中用刮刀裂解细胞。样品在4℃下13 000 r/min离心30 min,收集上清液。使用Bradford法测定总蛋白浓度,每个样品蛋白提取物的含量为40 μg。将蛋白提取物以1∶3的比例加入十二烷基硫酸钠(SDS)样品缓冲液中,95℃加热10 min,在凝胶(NuPAGE 4-12%Bis-Tris)上进行电泳,转移到聚偏二氟乙烯(PVDF)膜,将蛋白条带放入TBST溶液(含5%的脱脂奶粉)中,室温摇床振荡1 h,4℃密闭12 h。按照marker分子量指示剪出所需蛋白的条带,以0.1 ml/cm2的标准加入含有一抗(鼠抗HIF-1α、兔抗Bcl-2、兔抗HIF-1β、兔抗磷酸化Akt、小鼠抗磷酸-ERK)的封闭液,室温孵育3 h。用TBST溶液振荡漂洗5次,每次8 min。随后加入二抗〔辣根过氧化物酶(HRP)标记的鼠抗或兔抗〕常温孵育1 h。内参抗体为α-微管蛋白(Tubulin)。印迹用TBST洗涤3次,每次5 min,Tris缓冲盐溶液(TBS)洗涤1次,然后使用增强化学发光(ECL)试剂盒检测。采用SyngeneGeneSnap软件的图像处理器采集蛋白质条带,蛋白质表达水平与使用GeneTools测量的条带强度相对应。数据分析选取α-微管蛋白与对照组蛋白表达水平的比值。
1.2.8免疫细胞化学试验 将PC3细胞在4%多聚甲醛中固定10 min,PBS漂洗2次,每次5 min,用含0.1%Triton X-100的PBS(PBS-T)透化10 min,PBS洗涤2次,每次5 min。室温下使用10%正常山羊血清密闭培养1 h。在4℃下,将细胞与任意一种抗体〔兔抗HIF-1α、兔抗血管内皮生长因子(VEGF)、鼠抗Ki-67、鼠抗细胞色素C、小鼠细胞周期蛋白D抗体、小鼠细胞周期蛋白E抗体〕密闭培养12 h。PBS漂洗3次,将细胞与含驴抗兔IgG的PBS-T中孵育2 h。用PBS冲洗,在4′,6-二脒基-2-苯基吲哚(DAPI)的Vectorshield荧光培养基中盖片培养。对于双重标记,本研究使用以下抗体组合:HIF-1α/VEGF、HIF-1α/Ki-67、HIF-1α/细胞周期蛋白D和HIF-1α/细胞周期蛋白E。PC3细胞先与第一主抗体孵育过夜,随后依次为第一次级抗体、第二主抗体、第二次级抗体。使用AxioCam数码相机(安装在有Zeiss KS-300软件的Olympus BX60显微镜上)获得10张高倍视野(HPF)图。HIF-1α、HIF-1α/VEGF、HIF-1α/Ki-67和细胞色素C染色用于定性分析;对于Ki-67染色,随机选择8个有代表性的区域,使用ImageJ1.35软件测量Ki-67阳性细胞的平均像素强度。
1.2.9细胞活力测定 使用染料3-(4,5-二甲基-2-噻唑基)-2,5-二苯基-2H-四唑溴化物(MTT)评估细胞活力。在基本培养基加入Elele L-谷氨酰胺(MEM)稀释MTT至0.5 mg/ml。在5%CO2、37℃的孵育箱中培养2 h。吸去上清,加入1 ml DMSO溶解甲臜,振荡20 min。将样品转移到96孔板中,使用Mrx酶标仪 在595 nm波长处测定吸光度值,并计算抑制率。
1.2.10划痕实验 当细胞铺满24孔板后,用无菌枪头(20 μl)制造没有贴壁细胞的均匀划痕,PBS洗2遍以除去游离及破碎细胞,加入无血清DMEM,在倒置显微镜下摄片并标记此时摄片位置。继续培养24 h后,在相同的位置再次摄片。用ImageJ 1.35软件分析拍摄照片的划痕距离。伤口愈合定量为剩余无细胞区域平均百分比与初始伤口的面积之比〔11〕。
1.3统计分析 使用SPSS22.0软件进行单因素方差分析,然后用GraphPad Prism进行Student-Newman-Keuls后分析测试。
2 结 果
2.1临床常用浓度的异氟烷持续诱导HIF-1α表达和易位 为了区分异氟烷对HIF-1α蛋白水平的影响,将PC3细胞用0.5%~2.0%异氟烷处理2 h后,分别在0、2、4、8和24 h收取细胞,并使用免疫印迹和免疫细胞化学进行分析。结果表明:异氟烷可诱导HIF-1α蛋白水平显著增加并具有时间依赖性(表1)和剂量依赖性(表2);2.0%异氟烷可引发HIF-1α蛋白水平显著上调,处理后4~8 h基本持平,在处理24 h后出现最大值(表2)。此外,用1.5%异氟烷和2.0%异氟烷处理结果表明:异氟烷诱导的HIF-1α表达活化具有剂量依赖性(表2)。然而异氟烷处理后的HIF-1β蛋白质水平与处理时间(表1)和剂量(表2)基本无关。异氟烷处理24 h后,观察到HIF-1α从细胞质进入细胞核的明显易位(与空白对照相比),并作为转录调节因子启动下游基因表达,见图1。

表1 不同时间处理异氟烷对HIF-1α、HIF-1β表达活力的影响

表2 异氟烷相对浓度对HIF-1α、HIF-1β表达活力的影响
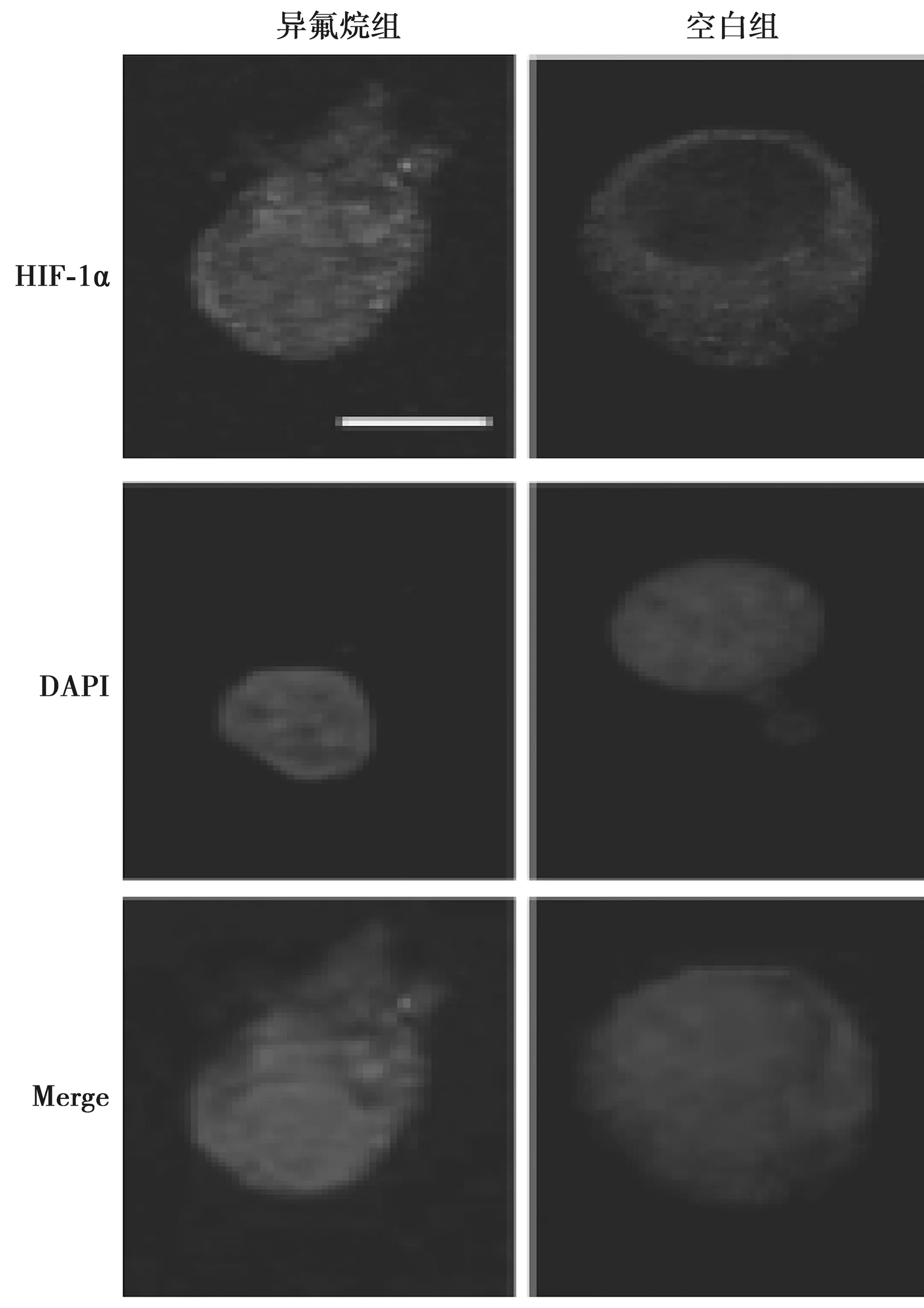
图1 异氟烷对HIF表达的影响(×200)
2.2异丙酚抑制由各种兴奋剂诱导的HIF-1α活化 以临床常用浓度的异丙酚(≤4 μg/ml)和HIF-1α诱导剂:缺氧、CoCl2或异氟烷进行共干预实验。处理次数取决于进行的实验。在共干预实验(异丙酚和缺氧或CoCl2)之后立即收取细胞;异丙酚单独处理后在不同的时间点收取细胞(0~24 h);异丙酚和异氟烷共处理后24 h立即收取细胞。为了排除异丙酚载体的影响,这些实验及初始对照使用DMSO和脂肪乳为对照组。与空白对照相比,缺氧可显著增加HIF-1α蛋白水平(表3);缺氧和异丙酚以剂量依赖性方式共处理可消除效应(表4)。CoCl2和异丙酚共处理细胞可观察到与缺氧和异丙酚共处理相似的结果。CoCl2诱导HIF-1α活化(表4),且异丙酚抵消该作用(表4)。最重要的是,异丙酚以剂量依赖的方式消除2%异氟烷诱导的HIF-1α表达,不管是用脂肪乳(表4)还是用DMSO(表3)。
2.3异丙酚和特异性HIF-1α抑制异氟烷诱导的VEGF上调和细胞增殖 将经siRNA预处理的PC3细胞用2%异氟烷单独处理2 h,再麻醉处理24 h后收取细胞;将未经siRNA预处理的PC3细胞分别用2%异氟烷及2%异氟烷与4 μg/ml异丙酚联合处理2 h,再麻醉处理24 h后收取细胞。三组细胞最后通过免疫细胞化学方法测定HIF-1α/VEGF和HIF-1α /Ki-67水平。4 μg/ml的异丙酚可有效阻断异氟烷诱导的HIF-1α、VEGF(图2A)和Ki-67(图2B)的相关表达,其表达有助于血管生成及标记活性细胞增殖。特异性HIF-1α PC3细胞也观察到类似的抑制效果,其选择性阻断异氟烷诱导的HIF-1α表达(图2A)。HIF-1α抑制可使VEGF(图2A)和Ki-67水平(图2B)均降低。

表3 缺氧和异氟烷处理对HIF-1α表达活性的影响

表4 CoCl2和异氟烷处理对HIF-1α表达活性的影响

图2 异氟烷单独使用、异氟烷与异丙酚联用及siRNA经异氟烷处理的PC3细胞对HIF-1α/VEGF和HIF-1α/Ki-67表达的影响(×200)
2.4异氟烷促进细胞周期进程和细胞增殖,而异丙酚和特异性HIF-1α抑制周期进程和细胞增殖 异氟烷处理后的PC3细胞中细胞周期蛋白D和细胞周期蛋白E的表达增加;与用异氟烷处理相比,用异丙酚或特异性HIF-1α处理抵消了这些作用。细胞活力从异氟烷处理的1.4倍(相对于空白)降低至异氟烷与异丙酚联合处理的1.10倍。见图3。

图3 异氟烷单独使用、异氟烷与异丙酚联用及siRNA经异氟烷处理的PC3细胞对HIF-1α、细胞周期蛋白D和细胞周期蛋白E表达的影响(×200)
2.5异丙酚和特异性HIF-1α可逆转异氟烷诱导PC3细胞对化疗剂DTX的抑制作用 首先将未处理的PC3细胞暴露于异氟烷和异丙酚二者联合组及异氟烷组,将经siRNA预处理的PC3细胞暴露于异氟烷组,随后将上述三组细胞及未经处理的PC3细胞用DTX处理24 h后立即用于免疫细胞分析和免疫印迹。与单独使用DTX处理后活跃分裂细胞为(26%±2%)相比,异氟烷组的PC3细胞中抑制有丝分裂效果较差,其活跃分裂细胞为(60%±5%);联合组活跃分裂细胞为(18%±1%);经siRNA预处理的异氟烷组活跃分裂细胞为(28%±2%)。MTT结果显示:空白组与DMSO组细胞活力分别为(1.05±0.08)、(1.01±0.05)。与单独使用DTX 处理的PC3细胞的细胞活力为(0.13±0.01)相比,异氟烷组具有更高的增殖速率为(0.47±0.05);其余两组变化不大,联合组细胞活力为(0.18±0.03),经siRNA预处理的异氟烷组细胞活力为(0.14±0.03)。细胞色素C浓度结果显示:除DTX对照组外,异氟烷组细胞色素C浓度较低。Bcl-2蛋白结果显示:异氟烷组Bcl-2蛋白过度表达;其余3组均抑制Bcl-2蛋白表达,其中空白组为1.06±0.04,DTX对照组为0.47±0.06,联合组为0.35±0.02,经siRNA预处理的异氟烷组表达程度最低,为0.27±0.03。见图4。

图4 异氟烷单独使用、异氟烷与异丙酚联用及siRNA经异氟烷处理的PC3细胞经过DTX处理,对Ki-67、细胞色素C和Bcl-2蛋白表达影响(×200)
2.6磷酸化Akt而非ERK在异氟烷或异丙酚诱导的HIF-1α表达改变中发挥重要作用 图5可见,将PC3细胞用LY294002或U0126过夜处理,再分别用异氟烷、异氟烷和异丙酚联合处理2 h。24 h后,收取细胞用于免疫印迹和HIF-1α、p-Akt和p-ERK研究。研究表明:磷酸化激酶Akt,在异氟烷诱导的HIF-1α过表达中起主导作用;与异氟烷单独处理相比,LY294002异氟烷联合组及异氟烷联用异丙酚组显著减少HIF-1α过表达;相比之下,与单独使用异氟烷组相比,U0126联合异氟烷组未影响HIF-1α表达。
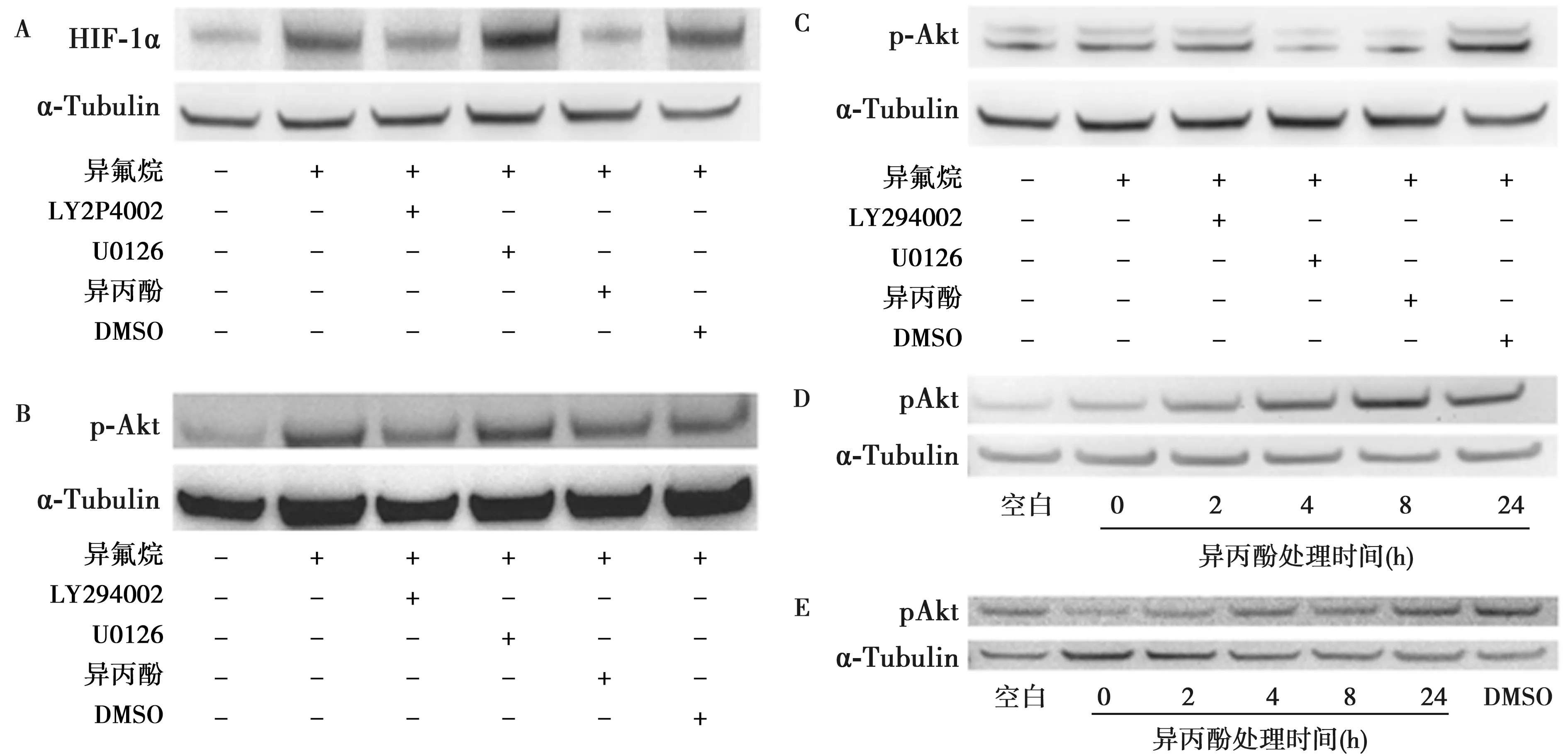
图5 异氟烷、异丙酚对HIF-1α、p-Akt和p-ERK表达的影响
异氟烷组与空白对照相比显示更高含量的p-Akt;LY294002异氟烷联合组及异氟烷联用异丙酚组显著减少p-Akt表达。单独使用异氟烷有增加p-ERK的趋势;异氟烷和异丙酚联合组及异氟烷和U0126联合组显著降低p-ERK表达。为了区分异氟烷和异丙酚处理对p-Akt的作用,将PC3细胞用单独2%异氟烷或4 μg/ml 异丙酚分别处理2 h。随后的0,2,4,8和24 h收取蛋白样品。结果表明:异氟烷诱导p-Akt具有时间依赖性;异丙酚处理后0、2 h,p-Akt显著降低,然后恢复到正常水平,这可能是因为存在正反馈机制。从这些发现可以推测异丙酚通过拮抗Akt磷酸化阻止异氟烷诱导的HIF-1α过表达,这种抑制也可能由于ERK磷酸化减少而减少。
2.7异丙酚和HIF-1α特异性siRNA可逆转异氟烷增强的PC3细胞迁移和侵袭 划痕实数据显示:与对照组制造划痕24 h后相比,异氟烷组显著加速了空隙闭合,异丙酚或特异性HIF-1α可抑制这些效应(图6)。

图6 异氟烷、异丙酚、特异性HIF-1α对细胞空隙闭合的影响(×200)
3 讨 论
本研究结果显示,吸入型麻醉剂异氟烷对人工培养的前列腺癌PC3细胞以不依赖氧的方式激活HIF-1α表达,增强了癌细胞增殖、迁移及耐药性。而单独使用静脉麻醉剂异丙酚对PC3细胞HIF-1α表达没有影响,且能够抑制化学因素或异氟烷诱导的HIF-1α过表达。
HIF-1α与癌症激活和疾病发展密切相关〔12〕。已经在多种人类癌症中发现其水平升高与肿瘤生长、血管形成、转移和愈后相关〔13〕。由于转录因子直接调控数百个基因表达,HIFs调节血管生成、代谢重新编程、增殖、转移和侵入等肿瘤发生的关键步骤,因此该治疗靶标备受关注。
本研究表明:HIF-1α从细胞质转移到细胞核发挥其作为转录因子的作用,其下游基因的表达也随之上升,包括VEGF和Ki-67,异氟烷处理后这两种蛋白显著增加。异氟烷为广泛使用的挥发性麻醉剂,对HIF-1α的激活使肿瘤细胞增长和转移。因此,全身麻醉剂异氟烷可能增加前列腺癌复发的风险。
肿瘤细胞的快速和不可控性生长导致血液供应不足,肿瘤内严重缺氧,使HIF-1α水平上调。HIF-1α可以激活参与蛋白合成的PI3K/Akt/mTOR和MAPK/ERK途径。通过激活胰岛素、胰岛素样生长因子、表皮生长因子和白细胞介素-2等生长因子和细胞因子,增加HIF-1α蛋白的合成速率。为了确定异氟烷可通过PI3K/Akt/mTOR和MAPK/ERK途径诱导HIF-1α上调,我们使用PI3K抑制剂LY294002或者MAPK/ERK1/2抑制剂U0126处理PC3细胞,再经过异氟烷处理,发现 PI3K抑制剂抑制了HIF-1α上调,而MEK 1/2抑制剂没有显著效果。还发现使用LY294002处理可消除异氟烷处理后的p-Akt水平升高。因此,多细胞效应包括HIF-1α、Akt和异氟烷提供的级联反应最终会促进癌细胞存活和生长,并使抗癌耐药性增加。
HIFs与化学抗性相关。HIF-1α调节多药耐药蛋白家族ABCB1和ABCG2两种基因转录,其对各种细胞毒性药物如紫杉烷、多柔比星和长春碱具有耐药性〔14〕。笔者发现,异氟烷处理的PC3细胞对DTX的响应显著降低是由于细胞增殖率升高、活跃细胞的比例增加、细胞损伤标记细胞色素C及抗凋亡蛋白Bcl-2的过表达减少所导致。当引入HIF-1α特异性siRNA时,该抗性减弱,表明这种效应是通过异氟烷对HIF-1α上调造成的。
异丙酚由于药代动力学性质良好广泛应用于临床实践。据报道,异丙酚通过抑制肌动蛋白应激纤维的形成和HeLa人宫颈癌细胞病灶的黏附来减弱人类癌细胞的侵袭能力,同时抑制骨肉瘤鼠模型中的肺癌细胞转移,并增强小鼠和人类毒性T细胞的活性〔15,16〕。
本研究数据表明,异丙酚抑制异氟烷、CoCl2、缺氧引起的HIF-1α上调;抑制异氟烷处理引起的VEGF和Ki-67升高;抑制异氟烷诱导产生的对PTX的抗药性。这些发现进一步表明异丙酚具有抑制癌细胞增殖、生长的性质。异丙酚和异氟烷联合治疗减少Akt的磷酸化并抑制HIF-1α上调,可能是异丙酚通过抑制PI3K途径和HIF-1α的生成而产生抗肿瘤作用;此外,异氟烷也可诱导p-Akt过表达,说明异氟烷可以通过引起p-AKT过表达进一步引起肿瘤恶化,但这需要进一步研究。
总之,在前列腺癌细胞中异氟烷通过PI3K/AKT/mTOR途径上调HIF-1α,引起标记物和血管生成;同时,癌细胞活性和抗药性增加。异丙酚联合异氟烷通过拮抗Akt磷酸化可抑制上述效应。未来的工作应该研究常见组合麻醉剂在多种肿瘤模型中的作用。
