酪酸梭菌对急性坏死性胰腺炎并发腹腔内高压大鼠肠道屏障功能及菌群的影响
2019-07-01江舒曼赵寒冰贾林李伟冬黄耀星严清青邓祺何梓健杜洪
江舒曼 赵寒冰 贾林 李伟冬 黄耀星 严清青 邓祺 何梓健 杜洪
1广州市第一人民医院(华南理工大学附属第二医院)消化内科,广州 510180;2广州市第一人民医院(华南理工大学附属第二医院)病理科,广州 510180
重症急性胰腺炎(SAP)患者中有50%容易发生腹腔内高压(intra-abdominal pressure,IAH)[1],国际腹腔间隔室综合征协会(WSACS)定义IAH为持续或反复的病理性腹腔内压≥12 mmHg(1 mmHg=0.133 kPa)[2]。SAP并发IAH使患者肠道细菌易位及腹腔内感染的机会增加[3]。多年来国内外运用连续血液净化、p38/p53 MAPK抑制剂或者早期肠内营养等方法保护肠屏障功能并运用两种或多种抗生素对抗肠内致病菌的大量繁殖,但对SAP继发肠源性感染的预防及控制效果仍不理想。如何运用益生菌治疗各种肠道疾病已成为国内外研究的热点[4]。研究指出,酪酸梭菌及其代谢产物丁酸盐通过减少炎症因子的释放调节肠道微生态并维持肠屏障功能的稳定[5]。本研究构建急性坏死性胰腺炎(ANP)并发IAH大鼠模型,观察酪酸梭菌及丁酸盐干预对其炎症因子、肠屏障功能、肠道病理学改变及肠道菌群的影响。
材料与方法
一、实验动物、分组及建模方法
80只Sprague-Dawley(SD)SPF级雌性大鼠,体重(224±13)g,由南方医科大学动物中心提供,许可证号SCXK(粤)2016-0041。按数字表法随机分为正常对照组(A组)、ANP并发IAH组(B组)、ANP并发IAH加酪酸梭菌干预组(C组)及ANP并发IAH加丁酸钠干预组(D组),C、D组于造模前10 d分别给予酪酸梭菌1×109CFU/d、丁酸钠100 mg·kg-1·d-1灌胃,A、B组灌入等容积生理盐水。预处理后B、C、D组均采用经胰胆管注射4.5%牛黄胆酸钠溶液1 mg/kg体重的方法制备ANP模型[6],A组仅翻动胰腺、胃肠等器官后关腹。制模后24 h采用左下腹直接穿刺并连接压力换能器测定大鼠腹腔内压[7],腹腔内压≥12 mmHg确定为IAH。每组随机抽取10只成功建模的大鼠腹腔动脉血,并取回肠末段组织10 cm。
二、血液指标检测
血标本经3 000 r/min离心10 min。全自动生物化学分析仪(奥林巴斯AU5400,日本)检测血淀粉酶;免疫酶联吸附法(ELISA)检测TNF-α、二胺氧化酶(diamine oxidase,DAO)和D-乳酸水平;采用显色基质鲎试剂测定血浆细菌脂多糖(lipopolysaccharide, LPS)水平。严格按照说明书操作。
三、回肠组织病理学检查及菌群测定
取4%多聚甲醛固定的回肠末段组织,经脱水、透明、透蜡、包埋、切片后行苏木精-伊红(HE)染色,由两位病理科医师盲法在光镜下观察组织的病理变化,并根据小肠病理Chiu′s标准[8]进行评分。
根据各细菌的16sDNA基因序列设计特异性PCR引物。采用实时定量PCR方法检测回肠黏膜酪酸梭菌、乳酸杆菌、普拉梭菌、双歧杆菌、肠球菌、大肠杆菌的细菌数量,以拷贝数的对数值/0.1 g肠黏膜湿重表示。
四、统计学处理
结 果
一、各组大鼠腹腔内压力比较
A、B、C、D组大鼠的腹腔内压力分别为(5.94±0.28)、(14.62±2.68)、(14.92±3.12)、(15.13±2.98)mmHg,B、C、D组均>12 mmHg,均显著高于A组,差异有统计学意义(P值均<0.05),但B、C、D组间的差异无统计学意义。
二、各组大鼠血指标水平的比较
B、C、D组大鼠血淀粉酶及TNF-a水平均显著高于A组,差异有统计学意义,B、C、D组间的差异无统计学意义;B、C、D组大鼠血DAO、D-乳酸、LPS水平也均显著高于A组, 而C、D组的DAO、D-乳酸、LPS水平均显著低于B组,差异有统计学意义,但C、D组间DAO、LPS水平的差异无统计学意义(表1)。
三、各组大鼠回肠病理评分及菌群比较
A组大鼠肠黏膜绒毛完整,固有层无淤血;B组大鼠肠黏膜结构不完整,上皮绒毛水肿及局部脱落,固有层有炎症性细胞浸润,毛细血管扩张淤血;C、D组大鼠肠黏膜病理改变介于A、B两者之间(图1)。A、B、C、D组大鼠回肠病理评分分别为(1.20±0.75)、(4.21±0.83)、(2.36±0.38)、(2.03±0.84)分,B、C、D组显著高于A组,B组又显著高于C、D组,差异均有统计学意义(P值均<0.05),而C、D组间的差异无统计学意义。
B组回肠末段黏膜有益菌(酪酸梭菌、双歧杆菌、乳酸杆菌、普拉梭菌)数量较A组显著减少,而致病菌(肠球菌、大肠埃希菌)显著增多;C、D组有益菌数量均显著高于B组,而致病菌数量均显著低于B组;D组酪酸梭菌及肠球菌含量均显著低于C组。上述差异均有统计学意义(P值均<0.05,表2)。
讨 论
SAP并发IAH或腹腔间隔室综合征时由于肠道组织的缺血再灌注、炎症因子释放、菌群失调、肠细胞营养缺失等[9]可引发肠黏膜屏障功能障碍甚至肠功能衰竭,导致黏膜通透性增高和肠内大量致病菌和内毒素易位,形成脓毒血症,同时又可促进炎症因子释放,两者相互影响,易出现多器官衰竭,增加患者的死亡率。近年来益生菌对各种肠道疾病的治疗作用受到极大关注,Bongaerts和Severijnen[10]提出应该在胰腺炎发病初期应用大量有代谢活性的益生菌,才能起到调节肠道菌群紊乱,减少后期继发感染,从而改善AP疾病病程。
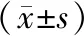
表1 各组大鼠血指标的变化
注:与A组比较,aP<0.05;与B组比较,bP<0.05
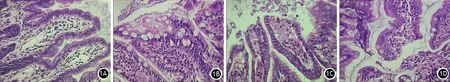
图1 正常对照组(1A)、ANP并发IAH组(1B)、ANP并发IAH加酪酸梭菌干预组(1C)及ANP并发IAH加丁酸钠干预组(1D)大鼠回肠末段黏膜病理变化(HE ×100)
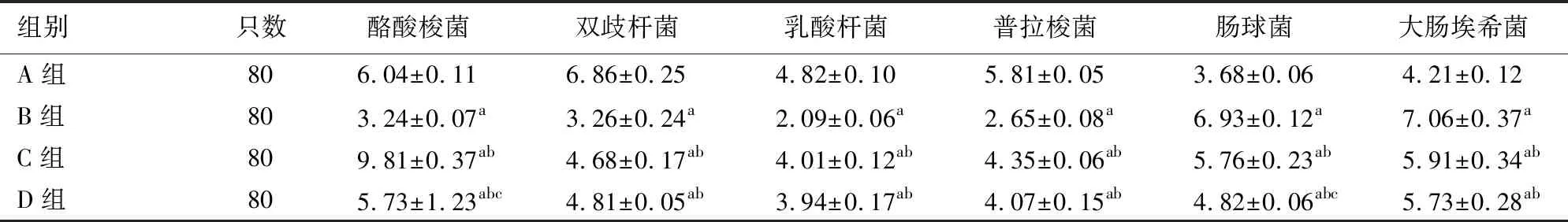
组别只数酪酸梭菌双歧杆菌乳酸杆菌普拉梭菌肠球菌大肠埃希菌A组806.04±0.116.86±0.254.82±0.105.81±0.053.68±0.064.21±0.12B组803.24±0.07a3.26±0.24a2.09±0.06a2.65±0.08a6.93±0.12a7.06±0.37aC组809.81±0.37ab4.68±0.17ab4.01±0.12ab4.35±0.06ab5.76±0.23ab5.91±0.34abD组805.73±1.23abc4.81±0.05ab3.94±0.17ab4.07±0.15ab4.82±0.06abc5.73±0.28ab
注:与A组比较,aP<0.05;与B组比较,bP<0.05;与C组比较,cP<0.05
酪酸梭菌是肠道内的厌氧菌,它与其代谢产物丁酸盐可以调节肠道免疫及微生态,抑制炎症通路的激活,从而减少炎症因子的释放,维持肠屏障的稳定[11-12]。本研究结果显示,酪酸梭菌或丁酸盐干预后大鼠血LPS、DAO及D-乳酸水平及回肠黏膜病理评分均较未干预大鼠显著降低,说明酪酸梭菌及丁酸盐可以在一定程度上维护肠黏膜屏障,降低肠黏膜及血管内皮的通透性。
肠道细菌在人体里主要存在远端小肠和结肠内,深层紧贴黏膜的由有益菌组成的共生菌形成细菌生物膜可防止致病菌与肠道上皮接触,对维护肠道正常的生物屏障起重要作用。SAP并发IAH时肠道缺血再灌注损伤、麻痹性肠梗阻、肠壁水肿等导致肠内致病菌大量繁殖。本研究结果显示,酪酸梭菌、双歧杆菌、乳酸杆菌、普拉梭菌等益生菌在未干预组的数量明显低于正常对照组,而大肠杆菌、肠球菌等致病菌的数量明显高于正常对照组,提示在SAP并发IAH时确实存在严重肠道菌群失调。酪酸梭菌或丁酸盐干预后4种有益菌数量均显著高于未干预组,两种致病菌数量均显著低于未干预组,提示酪酸梭菌及丁酸盐可以促进益生菌生长,抑制致病菌的繁殖。
总之,酪酸梭菌及其代谢产物丁酸盐既能维护ANP并发IAH大鼠的肠屏障功能作用,又能调节其肠道菌群失衡,两者相互促进、相互补充,这一结果为益生菌治疗SAP并发IAH提供了实验依据。
利益冲突所有作者均声明不存在利益冲突
