JAK2-STAT3信号通路在急性坏死性胰腺炎大鼠胰腺损伤与全身炎症反应中的作用
2019-07-01沈银峰巴元明金文银张霞陈乾田军军朱勇陶然
沈银峰 巴元明 金文银 张霞 陈乾 田军军 朱勇 陶然
1湖北中医药大学,湖北省中医院外四科,武汉 430072;2湖北中医药大学,湖北省中医院肾内科,武汉 430072
重症急性胰腺炎(SAP)是一种常见的临床急腹症,病程进展快,病因复杂,预后不良,病死率高达10%~30%[1]。SAP时多种致病因素导致胰腺腺泡损伤,释放多种被激活的胰酶及炎症细胞因子,引起胰腺组织的炎症性坏死[2]。此外,细胞因子和炎症递质通过血循环扩展至全身,引起全身炎症反应综合征,进一步导致多器官功能衰竭[3]。Janus激酶(JAK)-信号转导及转录激活因子(STAT)信号转导途径是大多数细胞存在的最主要的基本途径,其中JAK2-STAT3途径最为重要[4]。本研究通过抑制JAK2-STAT3信号途径,探讨SAP状态下胰腺损伤与全身炎症反应的关系。
材料与方法
一、动物与试剂
雄性健康Wistar大鼠(体重210~250 g)购自湖北省实验动物研究中心,实验前在22℃、12 h昼夜循环,标准化饮食和自由饮水条件下适应性饲养1周。牛磺胆酸钠购自Sigma公司;JAK2抑制剂Ruxolitinib和STAT3抑制剂Stattic购自美国Selleck Chemicals;TNF-α和IL-4 ELISA试剂盒购自美国R&D Systems;RT-qPCR试剂盒购自美国Thermo Fisher Scientific;cDNA合成试剂盒购自美国Bio-Rad Laboratories;引物和探针购自中国大连Takara Bio;JAK2、STAT3一抗和二抗购自南京KeyGen生物科技有限公司。
二、动物模型建立及分组
造模前大鼠禁食12 h,不禁水,采用逆行胆胰管注射5%牛磺胆酸钠(1.0 ml/kg体重,0.1 ml/min)法制备急性坏死性胰腺炎(acute necrotic pancreatitis, ANP)模型[5],术后大鼠自由饮水。按数字表法将大鼠随机分为ANP组、ANP+Ruxolitinib组(ANP+R组)、ANP+Stattic组(ANP+S组)、ANP+Ruxolitinib+Stattic组(ANP+R+S组)以及健康对照组(SO组),每组48只。SO组大鼠逆行胆胰管注射等容积生理盐水。Ruxolitinib术前2 h灌胃(180 mg/kg体重),Stattic术前2 h腹腔注射(3.75 mg/kg体重),其他组大鼠给予等容积生理盐水灌胃或腹腔注射。
造模后3、6、12、18 h分批处死大鼠,腹主动脉取血,离心分离血清,于-70℃冰箱冻存。取胰腺组织,用PBS液冲洗干净,快速液氮冷冻后于-70℃冰箱冻存。
三、血清淀粉酶(AMY)、TNF-α和IL-4含量检测
AMY活性由自动生物化学检测仪测定,TNF-α和IL-4水平采用酶联免疫吸附试验(ELISA)法检测,按说明书操作。
四、胰腺组织JAK2、STAT3 mRNA表达检测
取冻存的胰腺组织,研磨成粉状后采用Trizol提取组织总RNA,先逆转录成cDNA,再行RT-qPCR测定JAK2、STAT3 mRNA表达水平。JAK2引物上游序列5′-TTTGAAGACAGGGACCCTACACAG-3′,下游序列3′-TCATAGCGGCACATCTCCACA-5′;STAT3上游序列5′-CACCCATAGTGAGCCCTTGGA-3′,下游序列3′-TGAGTGCAGTGACCAGGACAGA-5′;GAPDH上游序列5′-CAAGGTCATCCATGACAACTTTG-3′,下游序列3′-GTCCACCACCCTGTTGCTGTAG-5′。PCR反应条件:95℃ 3 min,95℃ 15 s、60℃ 30 s、72℃ 30 s,40个循环。以公式2-△△Ct计算JAK2、STAT3 mRNA相对表达量。
五、胰腺组织磷酸化JAK2 (p-JAK2)和磷酸化STAT3(p-STAT3)蛋白测定
将胰腺组织匀浆加入细胞裂解液裂解30 min,蛋白定量后取10 μg行常规蛋白质印迹法检测p-JAK2、p-STAT3蛋白表达,以GAPDH为内参。使用Gel-Pro Analyzer 4.0软件测定每个条带的灰度值,以目的条带与内参条带的灰度值比代表蛋白质相对表达量。
六、统计学处理
结 果
一、各组血清AMY、TNF-α和IL-4水平变化
血清AMY、TNF-α和 IL-4水平分别在6、12、12 h时达峰值。ANP组、ANP+R组、ANP+S组、ANP+R+S组各时点AMY、TNF-α、IL-4水平均显著高于SO组,ANP+R组、ANP+S组和ANP+R+S组又均显著低于ANP组,ANP+R+S组显著低于ANP+R组和ANP+S组,ANP+R组显著低于ANP+S组,差异均有统计学意义(P值均<0.05,表1)。
二、各组胰腺组织JAK2、STAT3 mRNA及p-JAK2、p-STAT3蛋白表达的变化
各组大鼠胰腺组织JAK2 mRNA和p-JAK2蛋白、STAT3 mRNA和p-STAT3蛋白表达水平均12 h达到峰值(图1)。ANP组、ANP+R组、ANP+S组和ANP+R+S组各时点JAK2 mRNA和p-JAK2蛋白、STAT3 mRNA和p-STAT3蛋白表达均显著高于SO组,差异均有统计学意义(表2)。
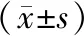
表1 各组血清AMY、TNF-α和IL-4水平比较
注:与SO组比较,aP<0.05;与ANP组比较,bP<0.05;与ANP+R组比较,cP<0.05;与ANP+S组比较,dP<0.05
ANP+R组、ANP+R+S组JAK2 mRNA和p-JAK2蛋白表达均显著低于ANP组及ANP+S组,但ANP+S组与ANP组差异无统计学意义。
ANP+R组、ANP+S组、ANP+R+S组STAT3 mRNA和p-STAT3 蛋白表达均显著低于ANP组,ANP+ S组、ANP+R+S组均显著低于ANP+ R组,ANP+ R+S组又显著低于ANP+S组,差异均有统计学意义(表2)
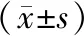
表2 各组胰腺组织JAK2 mRNA 、p-JAK2蛋白、STAT3 mRNA、p-STAT3蛋白表达变化
注:与SO组比较,aP<0.05;与ANP组比较,bP<0.05;与ANP+R组比较,cP<0.05;与APN+S组比较,dP<0.05
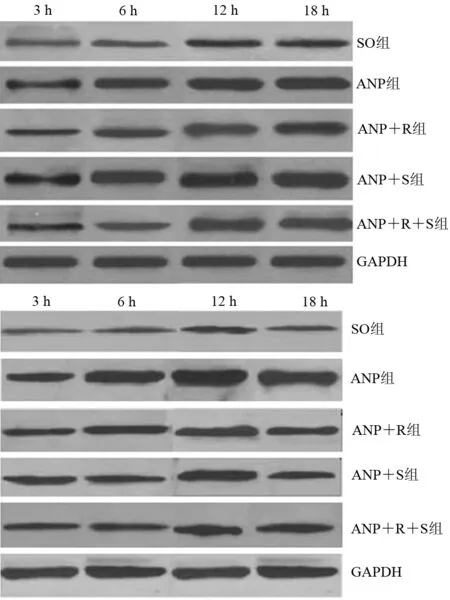
图1 各组胰腺组织p-JAK2(上)、p-STAT3(下)蛋白表达
讨 论
SAP发病之初胰腺腺泡内的各种酶、血管舒缓素和缓激肽等均被激活,胰腺组织自身消化,发生出血、坏死,释放花生四烯酸、氧自由基、补体、促炎症因子和抗凝物质等,导致全身炎症反应,引起炎症爆发,进而发生全身多器官功能不全,这是SAP患者早期死亡高峰的主要原因[6]。SAP时胰腺组织细胞受损,胰腺组织中储留的单核巨噬细胞首先被激活,合成和释放多种细胞因子如TNF-α、IL-6等[7],进而激活粒细胞、毛细血管内皮细胞,继而启动炎症反应,过度炎症反应时则启动抗炎反应,产生IL-4、IL-10等抑炎因子[7-8],因此SAP发生、发展过程中有多种抗炎和促炎细胞因子的参与。TNF-α和IL-4分别是体内重要的促炎和抗炎细胞因子[9]。TNF-α是SAP病程演进过程中较早出现、生物学效应最为广泛的细胞因子,与SAP全身并发症的关系较为直接且肯定[10]。IL-4主要由Th-2细胞产生,具有潜在的抗炎功能,可抑制TNF-α等促炎细胞因子的合成与释放,对SAP所致的多器官损伤具有改善作用[11]。本研究结果显示,ANP大鼠外周血TNF-α和IL-4明显升高,变化最为迅速。
靶细胞中存在的蛋白酪氨酸激酶(PTK)介导细胞因子与其受体结合后的信号蛋白分子级联反应。细胞因子与受体结合后发生酪氨酸磷酸化,激活JAK,进而使STAT蛋白磷酸化,激活 STAT, 再诱导目的基因表达。JAK2-STAT3是JAK-STAT信号转导途径家族中最重要的途径,参与许多细胞因子包括TNF-α和IL-6的免疫应答[12-13]。研究表明,激活的JAK2-STAT3信号通路在急性胰腺炎中起关键作用[14]。Ruxolitinib是一种酪氨酸激酶抑制剂,广泛应用于抑制JAK1、2,并被FDA批准用于临床[15]。Stattic是一种有效的活化STAT3的抑制剂,应用于STAT3活化的细胞系或动物模型[16]。Ju等[17]报道,通过抑制JAK2-STAT3、MAPKs和转化生长因子-β1在胰腺腺泡细胞的表达,可抑制NADPH氧化酶,有效地预防和治疗胰腺炎。 Zhu等[18]发现JAK2-STAT3通路在SAP诱导的急性肾损伤的分子机制中起重要作用,抑制JAK2-STAT3通路可降低血浆中TNF-α和IL-6的水平。本研究结果显示,ANP大鼠血清AMY和炎症细胞因子明显升高,胰腺组织JAK2、STAT3 mRNA和p-JAK2、p-STAT3蛋白表达上调,应用JAK2抑制剂和STAT3抑制剂可明显下调这些基因和蛋白的表达,且联合应用JAK2抑制剂和STAT3抑制剂的效果最显著,表明SAP发生和发展过程中胰腺组织JAK2-STAT3信号通路活化可能是导致全身炎症反应的关键环节。
利益冲突所有作者均声明不存在利益冲突
