卵巢癌患者血清miR-210、miR-126与临床病理特征及预后关系探讨
2019-06-29周晓水王武亮
王 冰 徐 臻 赵 虎 周晓水 王武亮
郑州大学第二附属医院(450000)
卵巢癌是女性生殖器官中常见的一类恶性肿瘤,具有较高的发病及死亡率,严重危害女性健康[1]。女性卵巢内分泌功能较为复杂致早期卵巢癌患者一般无典型症状,缺乏有效的诊断方法。因此寻找早期诊断卵巢癌的标志物对临床治疗具有重要意义[2]。近年研究表明,微小RNAs(miRNAs)可通过降解靶基因或抑制其翻译而调控基因的表达进而参与多种恶性肿瘤的发生及进展[3]。miR-210在乳腺癌组织中呈高表达并参与肿瘤增殖及侵袭过程,同时与乳腺癌的转移复发密切相关[4]。miR-126在乳腺癌组织中低表达并可通过上调靶基因表达进而促进乳腺癌细胞的增殖及迁移[5]。关于miR-210与miR-126在卵巢癌中的表达研究少见报道,因此本研究检测卵巢癌患者血清miR-210、miR-126的表达,并分析与临床病理特征和预后的关系,为早期发现卵巢癌病情并有效改善患者预后提供参考。
1 资料与方法
1.1 一般资料
收集2014年1月—2015年2月本院诊治的卵巢癌患者为观察组。纳入标准:①卵巢癌患者均经手术病理证实;②未进行化疗、放疗及激素治疗者;③临床资料完整者。排除标准:①自身免疫性疾病者;②发生远处转移者;③严重肾脏损伤者;④合并其他恶性肿瘤者。收集观察组临床病理资料,包括肿瘤大小、淋巴结转移、FIGO分期、分化程度、病理类型、CA125水平。按照国际妇产科联盟(FIGO)的分期标准[6]分期。根据相关标准评估组织分化程度[7],CA125水平正常值参考文献[8] 。另选取同期本院健康体检女性志愿者为对照组。
1.2 方法
抽取两组妇女空腹清晨静脉血3 mL,离心取上清置于-80 ℃冰箱待测。采用qRT-PCR法检测血清miR-210、miR-126相对表达量。提取总RNA,将2 μgRNA反转录为cDNA(Takara公司),按照SYBR Green RCR master mix试剂(北京恩硕科技有限公司)说明配反应体系并加样。qRT-PCR反应体系共为20 μl,其中SYBR Premix Ex Taq Ⅱ(2×)10 μl,cDNA 2.0 μl,上下游引物各0.8 μl,ROX Reference Dye Ⅱ(50×)0.4 μl,ddH2O 6.0 μl。每个样品设置3个生物学重复,miR-210与miR-126均以U6为内参基因,引物均由生工生物工程(上海)股份有限公司合成,引物设计见表1。完成后将其放入荧光定量PCR仪上进行反应,程序设定为:95 ℃ 30 s,95 ℃ 15 s,60 ℃ 15 s,72 ℃ 15 s,共40个循环,72 ℃终延伸10 min。反应结束后收集数据,并对数据Ct值分析,采用2-ΔΔCt算法计算miR-210与miR-126的相对表达量。
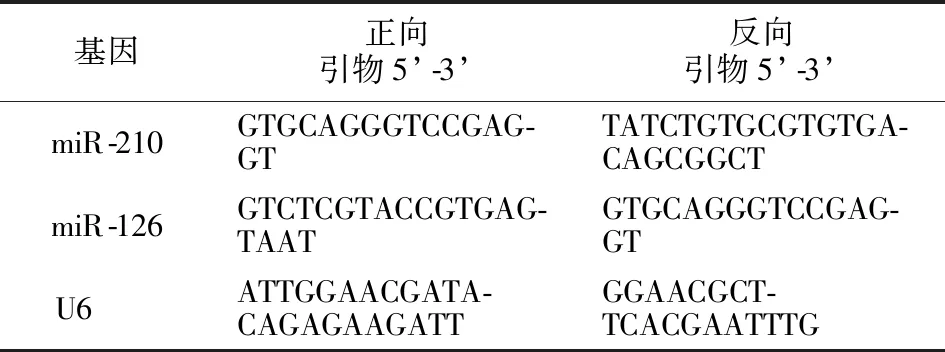
表1 qRT-PCR引物序列
1.3 随访
通过电话或复诊的方式对所有患者进行3年随访,统计无生存进展期(PFS),即患者开始治疗到肿瘤进展或死亡这段时间;总体生存时间(OS),即从随机化开始至因任何原因引起死亡的时间。
1.4 统计学方法

2 结果
2.1 两组对象一般临床情况
观察组102例,临床分期为Ⅰ期17 例、Ⅱ期27例、Ⅲ期 38例、Ⅳ期 20例;分化程度为高分化 14例、中分化 35例、低分化 53例;CA125≥200 U/ml 39例,<200 U/ml 63例;年龄(59.4±9.2)岁(45~73岁)。对照组102例,年龄(57.6±9.7)岁(43~72岁)。两组年龄比较无差异(P>0.05)。
2.2 两组血清miR表达水平比较
两组血清miR-210、miR-126表达水平存在差异,观察组miR-210表达水平(2.2±0.2)高于对照组(0.9±0.2),miR-126表达水平(0.6±0.1)低于对照组(1.1±0.1)(t=41.379、34.109,P=0.000)。
2.3 观察组血清miR表达与临床病理特征关系
根据miR-210高表达组淋巴结转移、FIGO分期、分化程度、组织类型及CA125水平与低表达组存在差异(P<0.05);miR-126高表达组淋巴结转移、FIGO分期、分化程度及CA125水平与低表达组存在差异(P<0.05)。见表2。

表2 血清miR表达与卵巢癌临床病理特征关系[例(%)]
2.4 血清miR表达诊断卵巢癌的效能
ROC分析结果显示,诊断卵巢癌miR-210的敏感度为96.6%、特异度为51.2%、截断值为1.4;miR-126的敏感度为67.8%、特异度为95.4%、截断值为1.3。见图1、表3。

图1 血清miR-210、miR-126表达的ROC分析

表3 血清miR表达水平诊断卵巢癌的价值
2.5 血清miR表达与卵巢癌患者预后
Kaplan-Meier法分析卵巢癌患者血清中miR-210、miR-126表达与患者PFS、OS的关系,结果显示miR-210低表达组PFS、OS(66.6%、71.3%)均高于高表达组(45.4%、37.7%),miR-126高表达组PFS、OS(60.2%、66.3%)均高于低表达组(39.1%、45.5%)(均P<0.05)。见图2、图3。
2.6 影响卵巢癌发生的相关因素分析
将影响卵巢癌发生的相关因素进行logistic回归分析, miR-210与miR-126均为影响卵巢癌发生的独立危险因素。见表4。

左图:PFS曲线 右图:OS曲线图2 卵巢癌患者miR-210表达与PFS、OS的关系
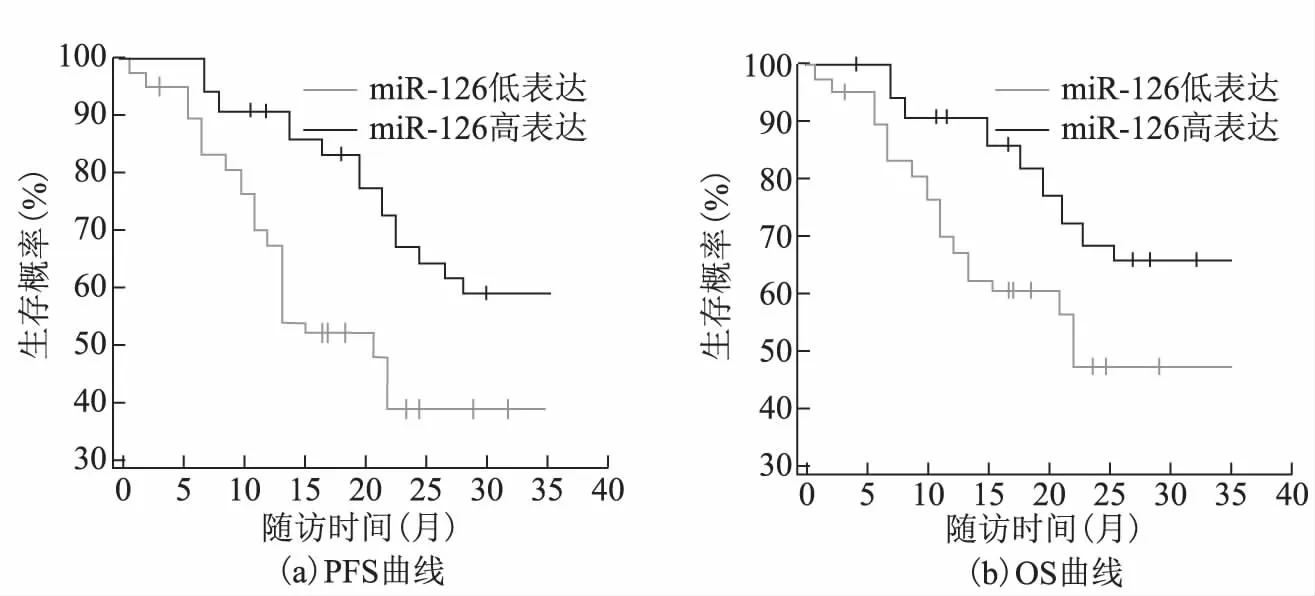
左图:PFS曲线 右图:OS曲线图3 卵巢癌患者miR-126表达与PFS、OS的关系

影响因素βSEWald χ2POR95%CImiR2101.050 0.4286.015 0.012 2.857 2.023~4.034miR1260.980 0.3139.803 0.011 2.664 2.010~3.532
3 讨论
卵巢癌发病过程及机制极其复杂[9]。早期卵巢癌患者症状不典型且术前鉴别卵巢癌的组织类型及良恶性比较困难,因而寻找可鉴别标志物十分重要。有研究表明,miRNAs可作为癌基因或抑癌基因在癌症发生及进展中发挥重要作用[10]。探究miRNAs在卵巢癌发生过程中的功能作用对临床早期诊断具有重要意义。
3.1 miR-210
研究发现,miR-210在肾癌组织中高度表达并参与肾癌的发生及发展,在胃癌发生过程中可能起到癌基因的作用[11]。miR-210作为缺氧特异性miRNA可通过调控靶基因表达进而参与胃癌发生过程并可能成为胃癌诊断的标志物[12]。乳腺癌细胞的增殖产生缺氧,而缺氧条件可激活miR-210相关蛋白并促进血管内皮毛细血管结构的形成及迁移,从而造成乳腺癌细胞增殖及侵袭[13]。相关研究发现,转染后的乳腺癌MCF-7细胞中miR-210表达显著降低且细胞增殖及侵袭能力明显减弱[14]。miR-210是否在卵巢癌中发挥同样的功能需要进一步研究。本研究结果,观察组血清中miR-210表达水平显著高于对照组,说明miR-210在卵巢癌患者机体中呈高表达。而miR-210高表达组与低表达组在分化程度、淋巴结转移、CA125水平及FIGO分期均存在差异,且miR-210与卵巢癌组织类型密切相关,说明随着疾病严重程度的加重,miR-210表达可能促进卵巢癌患者的病情进展。miR-210的截断值为1.43,说明检测患者血清miR-210的相对表达量>1.43当时极可能已发生卵巢癌,提示miR-210可能成为临床诊断卵巢癌的重要标志物。卵巢癌患者PFS、OS分析显示,miR-210低表达组PFS、OS均高于高表达组,说明卵巢癌患者机体内miR-210高表达时其预后较差。
3.2 miR-126
研究表明miR-126可在造血系统、消化系统及生殖系统中发挥重要作用[15]。在多种肿瘤细胞中发挥抑癌基因的作用,研究发现miR-126与乳腺癌转移密切相关,miR-126低表达时原发癌灶发生转移及复发的中位时间缩短[16]。miR-126表达与血管内皮黏附因子-1表达呈负相关,miR-126低表达时可增高血管内皮黏附因子-1表达水平而促使白细胞粘附于血管内皮细胞并参与新生血管的生成,导致肿瘤细胞的转移[17]。相关研究表明miR-126可通过调控靶基因的表达抑制胃癌肿瘤的生长及转移[18]。miR-126在卵巢癌发生过程中是否发挥抑癌基因的作用。本研究观察组血清中miR-126表达显著低于对照组,说明miR-126在卵巢癌患者中的表达水平明显降低,可能是miR-126低表达促使血管内皮黏附因子-1表达水平升高并参与新生血管的形成而利于卵巢癌细胞增殖及迁移。miR-126为高表达组淋巴结转移、FIGO分期、分化程度及CA125水平与低表达组存在差异,说明miR-126低表达可加快卵巢癌患者病情进展。ROC分析显示,miR-126具有较高的敏感性及特异性,推测其可能作为临床诊断卵巢癌的一个预测因子。miR-126高表达组PFS、OS均高于低表达组,说明miR-126高表达的卵巢癌患者预后较好。miR-210与miR-126均为影响卵巢癌发生的独立危险因素,均参与卵巢癌发生及进展并在不同组织中的表达不同,二者均与患者预后密切相关。
综上所述,卵巢癌患者血清miR-210表达上调,miR-126表达下调,二者均与卵巢癌发生、发展及预后密切相关,临床检测血清miR-210、miR-126表达水平有助于监控卵巢癌患者病情进展并有效预后。本研究存在不足之处,仅初步证实miR-210、miR-126可能在卵巢癌的发生发展中发挥作用,关于二者在卵巢癌中的具体作用机制还有待进一步研究。
