头针电刺激对急性脑梗死大鼠神经胶质细胞及凋亡基因相关蛋白的影响*
2019-06-28王永盛王苹莉程一升赵元琛
王永盛 王苹莉 程一升 赵元琛
(浙江省温州市中西医结合医院,浙江 温州 325000)
脑梗死是由脑血管阻塞引起的严重脑缺血缺氧性组织坏死疾病[1]。各种疾病和不良生活习惯可能导致脑梗死,如高血压、糖尿病、吸烟、肥胖、血脂异常等,被证实与本病的高死亡率和致残率呈正相关[2]。目前,对脑梗死的治疗主要是溶栓和血栓清除,但治疗效果不太理想[3]。因此,寻找有效的策略,以提高其脑梗死的治疗效果成为研究的热点。头针电刺激是一种非药物治疗,可能对神经功能的恢复有促进作用[4]。一项荟萃分析表明头针电刺激对脑梗死治疗有积极作用,有助于脑梗死患者的综合康复[5]。神经元细胞的加速凋亡是脑梗死的一个重要因素,其可能是由凋亡相关因素的调节引起的,如Caspase家族和B细胞淋巴瘤2(Bcl-2)家族[6]。 动物研究表明,头针电刺激可以通过抑制缺血脑的凋亡,对脑组织发挥保护作用[7]。虽然头针电刺激对脑损伤具有抗凋亡和神经保护作用,但其抗凋亡作用机制尚不清楚。因此,本研究旨在观察头针电刺激对急性脑梗死大鼠脑组织中Bax、Bcl-2和和Caspase-3表达的影响及神经胶质细胞的凋亡情况,为头针电刺激治疗脑梗死提供潜在的治疗策略。现报告如下。
1 材料与方法
1.1 实验动物 成年健康雄性SD(Sprague Dawley)大鼠45只,体质量220~260 g,由黑龙江中医药大学动物实验中心提供,许可证号:SYXK(黑)2016-0009。
1.2 仪器与试剂 1)主要仪器:激光多普勒血流检测仪(PE-5001,Sweden)购自上海永州实验设备有限公司;光学生物学显微镜购自日本Nikon公司;台式冷冻离心机Sorvall STR ATOS购自德国Heraeus公司;激光多普勒血流检测仪(PE-5001,Sweden)购自上海永州实验设备有限公司;凝胶成像仪购自美国UVP公司;BIO-RAD垂直电泳仪购自美国BIO-RAD公司;病理切片机、包埋机、脱水机购自德国Leica公司。2)主要试剂:三苯基四氮唑(TTC)购自美国Biosharp公司;水合氯醛购自上海上药新亚药业有限公司;蛋白抽提试剂盒购自武汉博士德生物工程有限公司;鼠抗Bax、Bcl-2和Caspase-3单克隆抗体购自美国 Cell Signaling Technology公司;鼠抗GADPH单克隆抗体和辣根过氧化物酶HRP标记山羊抗鼠IgG二抗购自北京中杉金桥生物技术有限公司 ;TUNEL细胞凋亡检测试剂盒购自碧云天生物技术公司。
1.3 分组与造模 实验前将大鼠置于SPF级环境中适应性喂养1周后进行实验,动物相关处置均符合《中华人民共和国实验动物管理条例》要求。用随机数字表法将SD大鼠均分为3组:假手术组、模型组和头针电刺激组,假手术组15只,其余根据造模后再分,每组15只。每组用5只大鼠进行神经运动功能评分和TTC染色、5只进行血脑屏障通透性检测、5只进行mRNA水平检测。大鼠脑缺血再灌注损伤模型制备:采用线栓法制备动物大脑中动脉栓塞模型。大鼠禁食12 h后用10%水合氯醛(35 mg/kg)腹腔麻醉后,将大鼠仰卧于手术台上,沿颈正中线行手术切口,充分暴露左侧血管,分离颈总动脉、颈内动脉和颈外动脉,用激光多普勒血流检测仪检测左侧大脑血流变化,待血流趋于平稳时,结扎颈外动脉远端后,在颈外动脉上切开一个小切口,将一条尼龙线(直径0.25 mm,尖端涂抹硅胶)插入颈内动脉约20 mm,并结扎,阻塞大脑血流。用生理盐水清洗切口后逐层缝合。术后给予20万U青霉素肌肉注射,连续使用3 d。假手术组只切开皮肤和分离血管,不进行阻塞血流。剔除5只造模不成功大鼠。
1.4 干预方法 头针电刺激组在造模成功后24 h根据《大鼠穴位图谱》进行电针治疗,大鼠仰卧于针刺台上,用28号毫针刺激百会穴和大椎穴,进针2 mm后快速捻转1 min后,接频率1 Hz的脉冲电疗仪,刺激时长每日1次,每次30 min,持续14 d。假手术组和模型组每天固定于针刺台上30 min,不进行头针电刺激,疗程同头针电刺激组。
1.5 标本采集与检测 1)神经功能评分。根据Bederson′s 评分标准进行评分[8],采用双盲法,于造模后14 d后评价。2)TTC染色。做完功能评分的大鼠进行处死,取完整脑组织,行冠状位切片,厚度2 mm,置于2%的TTC染液中孵育30 min,用磷酸盐缓冲液终止染色。用Image Pro Plus 6.0软件计算梗死体积。3)Western Blotting法检测Bax、Bcl-2和Caspase-3蛋白的表达。实验结束后,处死大鼠,取适量右侧脑组织,用预冷磷酸盐缓冲液洗涤2次,按1∶9加入蛋白抽提试剂,用超声进行破碎,裂解15 min后离心后取上清,进行蛋白含量测定后调整蛋白浓度至一样,加入1/5体积的5×Buffer进行变性,-80℃保存。进行电泳、孵育一抗、孵育二抗,用凝胶成像系统采集图像并进行分析。4)TUNEL法检测细胞凋亡。脑组织进行常规石蜡脱水、包埋、切片(2.0 μm),二甲苯脱蜡(2 次)、无水乙醇脱水 (2次)、95%和75%乙醇各洗一次,按TUNEL法检测细胞凋亡说明书进行细胞凋亡检测。使用荧光显微镜检测凋亡细胞(绿色荧光染色),计数阳性细胞率。
2 结 果
2.1 各组大鼠脑梗死体积的比较 见表1,图1。假手术组未见梗死灶,其余各组均出现不同程度梗死;与模型组相比,头针电刺激组梗死体积明显减小(P<0.05)。
表1 各组大鼠脑梗死体积的比较(%,±s)

表1 各组大鼠脑梗死体积的比较(%,±s)
与模型组比较,*P<0.05。下同
组 别 n 大鼠脑梗死体积假手术组 5模型组 5 0 25.13±5.06头针电刺激组 5 13.85±3.64*
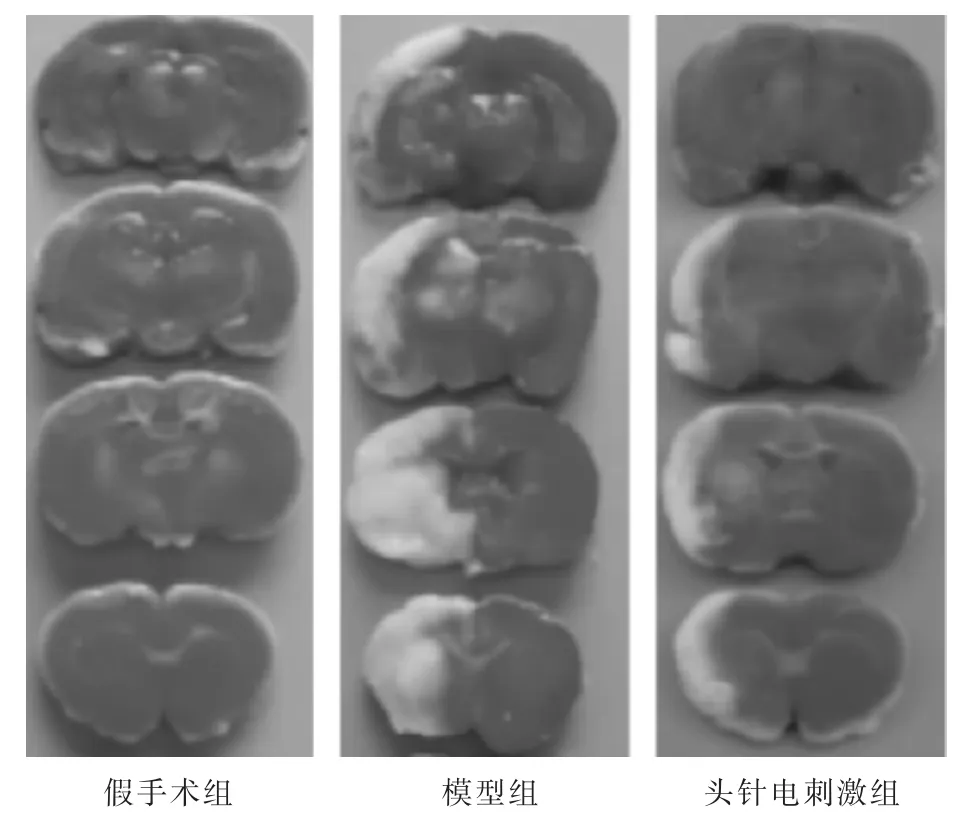
图1 各种大鼠脑梗死体积(TTC染色)
2.2 各组大鼠神经功能Bederson′s评分比较 见表2。假手术组大鼠表现正常;模型组出现不同程度的瘫痪侧前肢回收屈曲腹下、病灶对侧偏瘫、爬行时向右划圈和瘫痪后肢向后外展;给予头针电刺激后,大鼠神经功能 Bederson′s评分降低(P<0.05)。
表2 各组大鼠神经功能Bederson′s评分比较(分,±s)
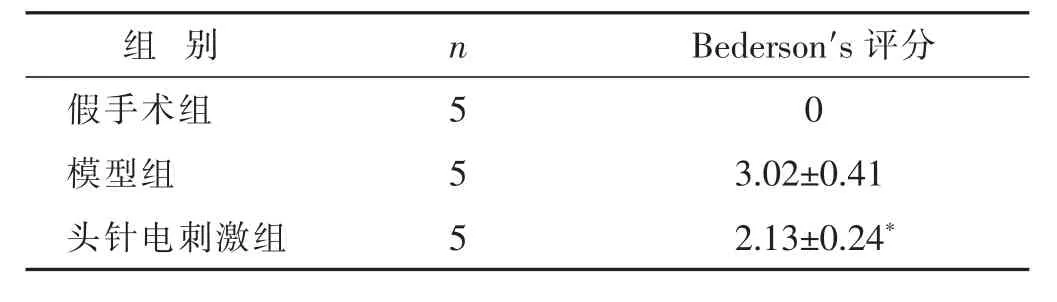
表2 各组大鼠神经功能Bederson′s评分比较(分,±s)
组 别 n Bederson′s评分假手术组 5模型组 5 0 3.02±0.41头针电刺激组 5 2.13±0.24*
2.3 各组大鼠脑组织中Bax、Bcl-2和Caspase-3蛋白水平比较 见表3,图2。与假手术组相比,模型组和头针电刺激组大鼠脑组织中Bax和Caspase-3蛋白表达量均增加,Bcl-2蛋白表达量均降低(P<0.05);与模型组相比,头针电刺激组大鼠脑组织中Bax和Caspase-3蛋白表达量降低,Bcl-2蛋白表达量增加(P<0.05)。
表3 各组大鼠脑组织中Bax、Bcl-2和Caspase-3蛋白水平比较(±s)
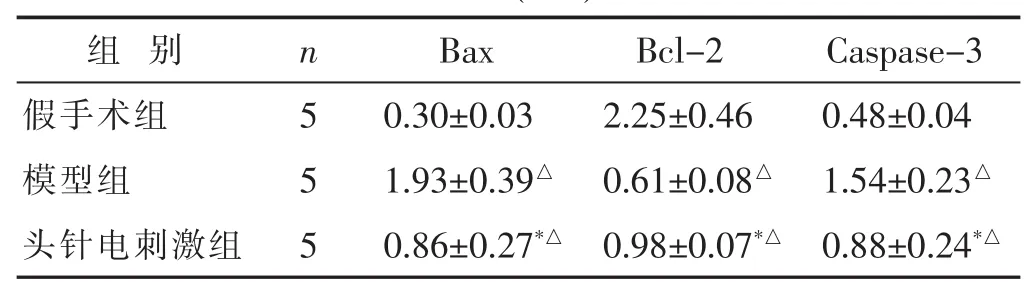
表3 各组大鼠脑组织中Bax、Bcl-2和Caspase-3蛋白水平比较(±s)
与假手术组比较,△P<0.05。下同
组 别 Bcl-2 Caspase-3假手术组 2.25±0.46 0.48±0.04 n Bax 5 0.30±0.03模型组 0.61±0.08△ 1.54±0.23△5 1.93±0.39△头针电刺激组 5 0.86±0.27*△ 0.98±0.07*△ 0.88±0.24*△

图2 各组大鼠脑组织中Bax、Bcl-2和Caspase-3蛋白水平的比较
2.4 各组大鼠脑组织中细胞凋亡率的比较 见表4,图3。与假手术组相比,模型组和头针电刺激组细胞凋亡率明显增加(P<0.05);与模型组相比,头针电刺激组细胞凋亡率降低(P<0.05)。
表4 各组大鼠脑组织中细胞凋亡率比较(%,±s)
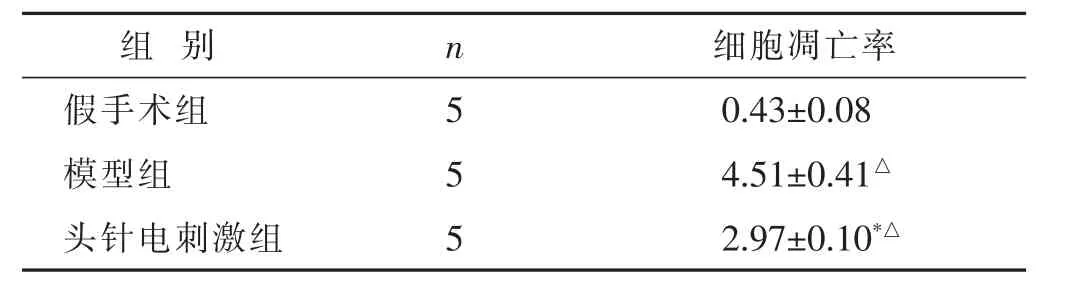
表4 各组大鼠脑组织中细胞凋亡率比较(%,±s)
?

图3 TUNEL染色结果(200倍)
3 讨 论
头针电刺激已被广泛用于治疗中风患者,能提高智力和记忆力,并刺激意识,改善患者认知功能[9]。一项对随机对照试验的系统综述表明,头针电刺激对脑血管性认知障碍患者的认知功能有积极作用[10]。同时,也有研究证实,头针电刺激可以抑制细胞凋亡[11]。本研究结果表明,头针电刺激能改善急性脑梗死大鼠神经功能,同时抑制神经胶质细胞的凋亡。本研究支持了头针电刺激通过调控凋亡相关基因的表达来保护神经功能的观点。
本研究的模型组神经胶质细胞凋亡增加,提示细胞凋亡与缺血后的神经元损伤有关。同时,用头针电刺激干预后,神经胶质细胞凋亡数量明显减少,说明头针电刺激具有抗凋亡作用。然而,这种抗凋亡作用的机制尚不清楚。已知Bcl-2家族参与细胞凋亡调控,它由多种参与细胞凋亡调控的因子组成,如促凋亡因子Bax和Bak,以及Bcl-2和Bcl-xL等凋亡抑制因子,抗凋亡和促凋亡因子具有协同作用[12-13]。最近的研究表明,Bcl-2家族的调控受损进一步加重了缺血神经元的损伤,Bax和Bcl-2在脑组织中的平衡被打破[14]。电针能促进Bcl-2表达,同时抑制Bax的表达,使Bcl-2与Bax的比值增加,从而控制细胞凋亡,保护神经元不受损伤[15]。我们的结果与上述研究相一致。同时,Caspase家族在细胞凋亡过程中也发挥了重要作用,Caspase-3是公认的促进细胞凋亡的指标,其被激活,表示细胞进入不可逆阶段[16]。本研究也证实了这一观点。当然还有其他的因子也参与了细胞凋亡的发生,如STAT3,STAT3被磷酸化激活,从而抑制细胞凋亡,对其激活的抑制是肿瘤的潜在治疗目标,如肝癌[17]。同时,STAT3激活可以促进Bcl家族中凋亡抑制因子的表达,有助于增强细胞的存活,其结果在鳞状细胞癌中也得到证实[18]。 多种细胞因子(IL-6、TNF-α 等)也参与了细胞凋亡的调节,这些细胞因子在炎症的发生发展过程中发挥了重要作用。脑梗死后都会出现不同程度的炎症,这也证明这些细胞因子表达增加,使MAPK信号通路被激活,调控Bcl-2家族成员的表达,最终诱导了细胞凋亡[19]。由于本研究的限制,我们并没有检测STAT3、细胞因子、MAPK等的水平,只进行了凋亡相关蛋白的检测。因此,我们推断,头针电刺激能激活Bcl-2,抑制Bax的表达,这可能是其发挥神经保护作用的潜在原因。同时,我们也必须注意一个问题,本研究使用的成年雄性大鼠,而老年人更容易发生脑梗死,而衰老的特征是大量的神经和生理改变。因此,头针电刺激的实验结果可能因年龄和/或性别而异,进一步的实验和临床试验应该考虑到这一点。
综上所述,头针电刺激能改善急性脑梗死大鼠的神经功能,其机制可能与下调Bax和Caspase-3蛋白表达,上调Bcl-2蛋白表达,抑制神经胶质细胞凋亡有关。这些发现为头针电刺激在急性脑梗死治疗中的应用提供了理论依据,但头针电刺激对脑梗死患者神经保护作用的相关分子机制尚须进一步探索。
