慢性阻塞性肺疾病患者通气效率的影响因素分析
2019-06-27赵珊乜庆荣王浩彦韩雪峰杜凤云刘春蕊
赵珊 乜庆荣 王浩彦 韩雪峰 杜凤云 刘春蕊
1北京市房山区良乡医院呼吸与危重症医学科 102401;2首都医科大学附属北京友谊医院呼吸科100050
COPD 是一种常见的,可以预防和治疗的疾病,以持续的呼吸道症状和气流受限为主要特征[1]。世界范围的流行病学调查研究显示,COPD的全球发病率约11.7%,并且患病率和病死率逐年增高,是目前世界范围内的第3 大死亡原因[2-3],已成为严重的公共卫生问题和沉重的社会经济负担。COPD 患者由于存在持续的气流受限、肺功能下降而导致心肺运动功能异常。但是研究表明COPD 患者运动时心肺功能下降的速度要快于肺功能受损程度的进展速度[4-5],推测原因可能与肺过度充气造成吸气肺活量和有效通气量减小、肺内气体交换异常有关[6]。
心肺运动试验 (cardiopulmonary exercise testing,CPET)将患者从静息到运动状态、再到最大极限状态及恢复期全过程中的呼吸、气体交换、心电、血压、血氧饱和度等进行规范化、连续动态监测和数据分析,能够对患者整体功能状态进行客观定量的评估[7-8],是测定评估运动时心肺运动功能最可靠的方法。目前已有一些研究分析了相关因素如性别差异、年龄、体质量指数 (body mass index,BMI)等对COPD 心肺运动参数的影响[9-11],但目前研究结论尚不统一。因此,本研究的目的是分析COPD 患者通气效率的影响因素。
1 对象与方法
1.1 研究对象 根据入选标准和排除标准选择2016年1月至2016年12月在北京市房山区良乡医院呼吸与危重症医学科就诊的稳定期COPD 患者67例。入选标准: (1)确诊的COPD 患者,COPD 诊断依据GOLD 指南[1],有呼吸困难,慢性咳嗽或咳痰症状以及COPD 风险因素暴露史的患者,吸入支气管舒张剂后FEV1/FVC<70%,持续存在气流受限。 (2)稳定期COPD 患者,经规范治疗后临床稳定≥6周,即在过去的6周内没有因为病情变化改变药物治疗方案及药物剂量。(3)年龄40~80岁。 (4)静息状态吸入空气情况下经皮血氧饱和度 (percutaneous oxygen saturation,SPO2)>88%。排除标准:(1)患有其他肺部疾病如支气管扩张症 (COPD 合并支气管扩张者除外)、间质性肺病、支气管哮喘、囊性纤维化、感染性肺部疾病、胸廓畸形或肺切除术等病史;(2)严重心血管疾病如急性左心衰、恶性心律失常、未控制的高血压、近1个月内有急性冠脉综合征病史;(3)其他系统重大疾病史如恶性肿瘤、严重肝肾功能不全、活动期自身免疫性疾病、影响活动的下肢骨关节疾病、脑血管疾病后遗留肢体活动障碍、认知障碍和精神异常。本研究经北京房山区良乡医院临床医学伦理委员会批准,所有受试者入组前均告知其所参与的研究项目内容及所涉及的风险与收益,并签署 《知情同意书》。
1.2 研究方法
1.2.1 一般资料 采集及准备所有入选者记录性别,年龄,测量身高、体质量,计算BMI[BMI=体质量 (kg)/身高的平方 (m2)],测量血压、脉搏、静息状态吸入空气时SPO2。确认患者于肺功能检查前72 h内未使用H1受体拮抗剂,未口服、肌注和静脉用肾上腺皮质激素类药物;肺功能检查前24 h 未使用吸入型长效抗胆碱能药物(long-acting muscarinic antagonist,LAMA)、吸入型长效β2受体激动剂/激素 (long-actingβ2 receptor agonist/inhaled corticosteroids,LABA/ICS)复方制剂;肺功能检查前4 h未使用吸入型短效抗胆碱能药物 (short-acting muscarinic antagonist,SAMA)及吸入型短效β2受体激动剂 (shortactingβ2receptor agonist/inhaled corticosteroids,SABA)。
1.2.2 静态肺功能测定 采用德国JAEGER 公司的Master Screen肺功能仪进行常规肺通气功能测定,患者取端坐位,以鼻夹夹鼻,用唇紧密包绕咬口器,确保口鼻无漏气。测定的参数包括FVC、第1秒用力呼气容积 (forced expiratory volume in one second,FEV1)、FEV1占预计值的百分比(FEV1predicted,FEV1%pred)、FEV1/FVC。质量控制:进行肺功能检查前,根据室温、室压、湿度等对温度、环境大气压、水蒸气饱和度和气体状态进行常规校正。操作时按照肺功能指南要求进行测定,使呼气容积/时间曲线平滑,达到容量平台,要求至少获得3 次可接受的测试,且2 次最佳FVC与FEV1之间的差值≤150 ml[12]。根据结果进行气流受限严重程度分级,GOLD1 级:FEV1%pred≥80%,GOLD 2级:50%≤FEV1%pred<80%,GOLD 3 级:30%≤FEV1%pred<50%,GOLD 4级FEV1%pred<30%[1]。
1.2.3 CPET 采用德国JAEGER 公司的Master Screen CPET 测试仪进行测定,选用功率自行车的方式进行,采用1 min斜坡式递增功率自行车方案,运动试验开始休息2 min,起始3 min为无负荷踏车运动,3 min后递增运动开始,采用症状自限性运动方案,运动至受试者最大耐受量。检查当日餐后约2 h进行,整个运动过程车速保持在50~70 r/min。实时测定并监测心电图和SPO2,每隔2~3 min测定一次血压,以保证运动安全。运动结束后由系统分析,根据公式EqCO2=VE/VCO2分别计算得出静息状态下二氧化碳通气当量 (carbon dioxide equivalent ventilation in rest,EqCO2rest)、无氧阈时二氧化碳通气当量 (carbon dioxide equivalent ventilation in anaerobic threshold,EqCO2at)、最大运动状态下二氧化碳通气当量 (carbon dioxide equivalent ventilation in maximum movement,EqCO2max)。判断受试者是否达到最大运动量的主要根据:(1)症状自限,即经最大努力也不能维持功率自行车在50 r/min以上; (2)达到次极量心率,即最大预计心率(220-年龄)的80%以上。出现以下情况需终止试验:(1)运动中血压下降低于运动前20 mm Hg(1 mm Hg=0.133 k Pa),或收缩压>220 mm Hg;(2)血氧饱和度<85%或出现严重低氧血症的症状; (3)心电图出现ST 段斜行向下压低>2 mv持续2 min以上或ST 段抬高>2 mv;(4)出现心肌缺血所致的胸痛;(5)严重心律失常,如二度或三度房室传导阻滞,持续室性心动过速,频发室性早搏,快速房颤等; (6)中枢神经系统症状如眩晕、视觉障碍、共济失调、意识障碍等。
1.3 统计学分析 采用SPSS 19.0统计软件进行统计处理。首先进行数据正态性分析检验,正态性分布的数据采用±s表示。两组间参数比较采用独立样本t检验,多组间参数比较采用方差分析,相关性分析采用Pearson相关分析,筛选影响因素采用多元线性回归分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 入选稳定期COPD 患者67 例,其中男54例,女13例,年龄 (65±8)岁,身高(166±8)cm,体质量 (68±12)kg,BMI(24.7±4.6)kg/m2,FEV1%pred (48±16)%,FEV1/FVC (51±11)%。按照气流受限严重程度进行GOLD 分级,其中GOLD 1级2 例,约占总人数3%,GOLD 2级23例,约占总人数34%,GOLD 3级34 例,约占总人数51%,GOLD 4 级8 例,约占总人数12%。
2.2 稳定期COPD 患者EqCO2参数影响因素分别将参数EqCO2rest、EqCO2at、EqCO2max设为因变量Y1、Y2、Y3,性别、年龄、身高、体质量、BMI依次为自变量X1、X2、X3、X4、X5行多元线性回归分析,进一步明确上述因素对EqCO2的影响作用。采用逐步加入自变量的方法,经F 检验,总的回归方程均有意义,结果显示:(1)EqCO2rest影响因素回归方程:Y1=47.357-0.505×X5。BMI 的标准化系数的绝对值为-0.378;(2)EqCO2at影响因素回归方程:Y2=46.894-0.202×X4,体质量的标准化系数为-0.408。(3)EqCO2max影响因素回归方程:Y3=43.394-0.527×X5,BMI 的标准化系数为-0.394。
2.3 COPD 患者BMI与EqCO2相关性分析COPD 患 者 BMI 与 EqCO2rest、EqCO2at 及EqCO2max 均呈显著负相关 (r= -0.430、-0.403、-0.394,P值均<0.001)。见图1~3。
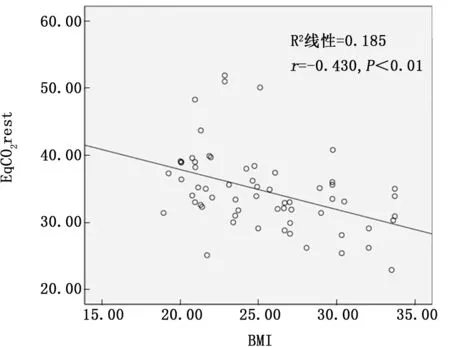
图1 BMI与EqCO2 rest的相关性
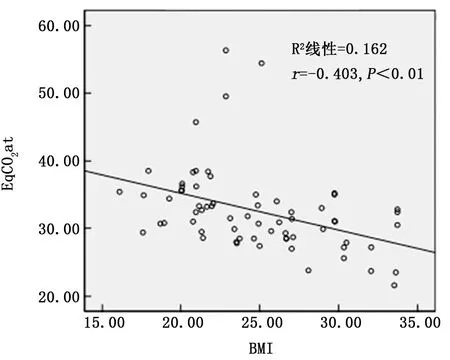
图2 BMI与EqCO2 at的相关性
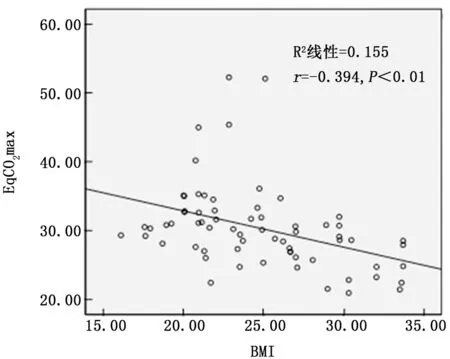
图3 BMI与EqCO2 max的相关性
2.4 不同BMI组COPD 患者EqCO2比较 根据中国肥胖问题工作组推荐的中国成年人BMI分类标准将稳定期COPD 患者进行分组,BMI<18.5 kg/m2为体质量过低组 (5例);18.5 kg/m2≤BMI≤23.9 kg/m2为体质量正常组 (28 例);24.0 kg/m2≤BMI≤27.9 kg/m2为超重组 (17例);BMI≥28 kg/m2为肥胖组 (17例)[13]。结果提示:4 组 COPD 患者 EqCO2rest 比较,F=4.662,P=0.005,在检验水平为0.05水平下,认为4组COPD 患者间的EqCO2rest值有差别,其中肥胖组EqCO2rest(31.2±4.5)低于体质量正常组 (37.6±6.7),差异有统计学意义 (P=0.001);4 组 COPD 患 者 EqCO2at 比 较,F=4.246,P=0.009,认为4 组 COPD 患者间的EqCO2at值有差别,肥胖组EqCO2at (28.9±4.2)低于体质量正常组 (35.1±6.5),差异有统计学 意 义 (P=0.001);4 组 COPD 患 者EqCO2max比较,F=5.061,P=0.003,认为4组COPD 患者间的EqCO2max值有差别,其中肥胖组EqCO2max (26.1±3.7)低于体质量正常组(32.8±6.5)及超重组 (30.9±6.4),差异均有统计学意义 (P分别为<0.001、0.016)。见图4~6。
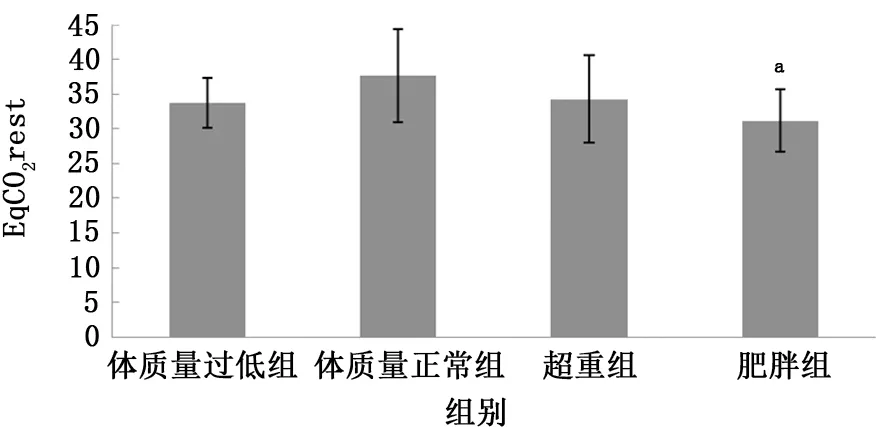
图4 4组COPD患者EqCO2 rest值比较

图5 4组COPD患者EqCO2 at值比较
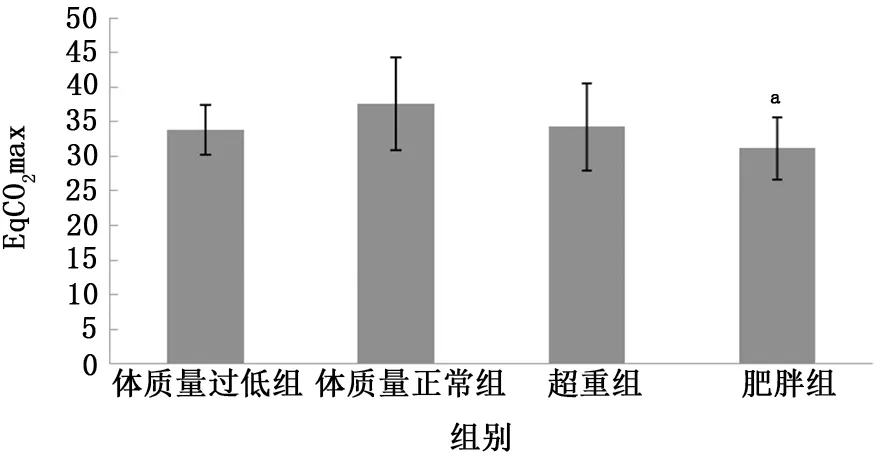
图6 4组COPD患者EqCO2 max值比较
2.5 不同BMI组COPD 患者运动过程中不同时间点EqCO2分析 不同BMI组COPD 患者在静息状态下、无氧阈及最大运动状态下的EqCO2,即EqCO2rest、EqCO2at、EqCO2max 均 呈 下 降 趋势,但体质量过低组最大运动时EqCO2与静息状态下及无氧阈时相比,差异均有统计学意义 (P=0.045、0.044),体质量正常组及肥胖组最大运动时EqCO2与静息状态下相比,差异具有统计意义 (P=0.007、0.001),超重组差异无统计学意义 (P>0.05)(表1)。
表1 4组COPD 患者运动过程中不同时间点EqCO 2 分析 (±s)
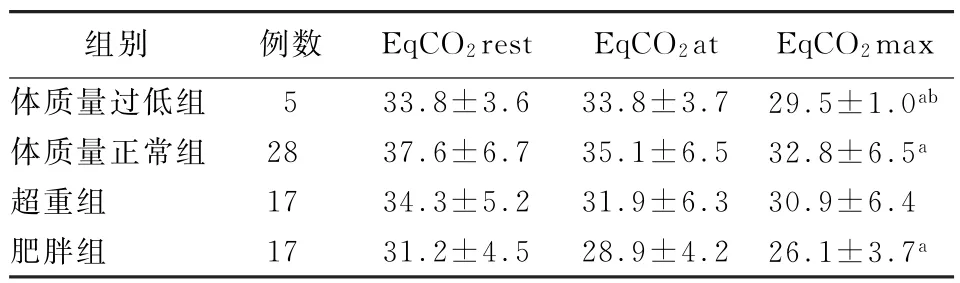
表1 4组COPD 患者运动过程中不同时间点EqCO 2 分析 (±s)
注:EqCO2 rest为静息状态下二氧化碳通气当量;EqCO2 at为无氧阈时二氧化碳通气当量;EqCO2 max为最大运动状态下二氧化碳通气当量;与EqCO2 rest比较,a P <0.05;与EqCO2 at比较,b P <0.05
组别 例数 EqCO2 rest EqCO2 at EqCO2 max体质量过低组 5 33.8±3.6 33.8±3.7 29.5±1.0ab体质量正常组 28 37.6±6.7 35.1±6.5 32.8±6.5a超重组 17 34.3±5.2 31.9±6.3 30.9±6.4肥胖组 17 31.2±4.5 28.9±4.2 26.1±3.7a
3 讨论
已有研究发现COPD 患者主观的劳力性呼吸困难症状与静态肺功能指标并不完全匹配,尤其对于轻度、中度患者,临床症状不明显,静息状态下肺功能下降也不明显,但患者的心肺储备功能已经出现了明显下降,这可能是由于静态肺功能仅反映了患者的通气能力,并未能评估COPD 可能合并的心脏、骨骼肌等肺外脏器受损,以及营养状态、心理因素失衡等的影响[14-16]。CPET 是目前唯一能够精确定量运动耐力的手段,虽然在COPD 的诊断方面尚不如常规肺功能更有价值,但是它在判断COPD 的严重程度、预测生存时间、鉴别呼吸困难的原因、诊断合并肺血管病变、评估治疗效果、指导肺康复训练等方面有着重要的用途[17]。
EqCO2是CPET 中一项非常重要的参数,它是通过VE/VCO2计算得出的,指每排出1L 的CO2与所需要的通气量之间的关系,数学上这种关系可以用比值或斜率来表示,又称通气效率,在临床上具有很重要的意义,EqCO2的上升意味着通气效率的下降。目前研究发现在运动高峰时,COPD 患者EqCO2较正常人明显增高,原因可能与生理死腔气量/潮气量的增加有关,提示COPD患者存在通气效率的明显降低[18]。本研究入组COPD 患者的BMI为 (24.7±4.6)kg/m2,此时回归方程提示BMI可能为影响静息状态及最大运动时通气效率的指标,并且BMI与EqCO2rest、EqCO2at及EqCO2max均呈显著负相关,也就是说随着BMI升高,静息状态、无氧阈及最大运动时EqCO2均呈下降趋势,通气效率增高。BMI综合了受试者的身高和体质量两项指标,可以更好地反映成人体质量与身高关系,判断胖瘦程度,能够粗略反映人体的营养状况,同时由于比较容易获得,是目前用于判断人体营养不良与肥胖的重要生理指标。目前研究认为在健康成年人中,BMI是影响深吸气量的独立因素[19]。而对于COPD 患者,目前研究大多关注的是营养不良,认为低BMI会造成COPD 患者病死率增加,对COPD 进行营养干预,对改善COPD 患者生活质量、气促状况和预后可能有一定的作用[9,20-21],但是肥胖对于COPD 患者的影响目前尚有争议。一项关于黑龙江地区COPD 流行病学调查资料显示,合并心血管疾病的COPD 患者患肥胖病的风险增加[22],并且肥胖会造成脂肪堆积从而限制肺的呼吸运动,引起呼气储备减少、功能残气量接近残气量等变化,出现气流受限以及动态性肺过度充气,最终引起呼吸困难以及活动受限[23]。但也有研究认为COPD 患者超重或肥胖可能对病死率具有一定的保护作用,COPD 患者体质量每增加1 kg/m2,病死率降低大约5%[24],与正常体质量COPD 患者相比,低体质量患者病死率高,而超重及肥胖组的病死率却较低[25]。这种明显的 “肥胖悖论”的病理生理基础目前还不明确。
本研究同时发现体质量过低组、体质量正常组、超重组及肥胖组COPD 患者比较,肥胖组EqCO2rest(31.2±4.5)低于体质量正常组(37.6±、6.7),肥胖组EqCO2at (28.9±4.2)低于体质量正常组 (35.1±6.5),而肥胖组EqCO2max (26.1±3.7)低于体质量正常组(32.8±6.5)及超重组 (30.9±6.4),差异有统计学意义。一项入组了54例COPD 患者的研究发现虽然肺功能GOLD 3级组VO2max和最大运动负荷功率均明显低于GOLD 2级组,但两组患者的EqCO2水平差异无显著统计学意义,这一现象说明COPD 患者通气效率的下降可能不是单纯由气流受限所致[26]。分析肥胖组COPD 患者EqCO2降低的原因可能为:运动中肥胖患者生理死腔的减少更为明显,所以通气效率发生了改善;异常的动态过度充气力学机制限制了EqCO2的升高;肥胖本身导致了FEV1下降,致使这类受试者被归类为有严重的COPD,但是事实上他们的疾病和肺功能并没有被评估的那么严重[27],也就是说静态肺功能过高地判断了肥胖患者COPD 的严重程度。
国内外一些研究认为低体质量指数是评估COPD 预后的一个独立危险因素,不但影响患者的活动耐力及生活质量,还增加患者的住院率、病死率。薛兵等[28]研究了38 例COPD 患者,发现<21 kg/m2的低体质量组住院时间为 (41±11)d,死亡4例,出院至复发时间 (53±13)d,均高于正常体质量组或超重组。但是本研究未发现体质量过低组COPD 患者EqCO2与体质量正常组存在差异。这与近期Maekura等[29]的研究结果是一致的,该研究发现使用BMI、峰摄氧量作为评估COPD患者7年生存率的指标,风险比分别为0.895和0.999,与晚期患者的病死率无显著相关性。但是本研究低体质量组COPD 患者数量较少,只有5例,占7.5%,需注意是否是样本量过少造成的偏差,应扩大样本量做进一步验证。
袁玮等[26]通过对54 例COPD 患者行 CPET,结果发现 COPD 患者的 EqCO2rest、EqCO2at、EqCO2max呈进行性下降。这一情况与健康人不同,健康人运动过程中EqCO2会随运动功率的增加呈双曲线样减少[30]。原因可能与COPD 患者呼吸肌肌力下降,呼吸中枢调节异常,导致吸气肌力降低、吸气驱动效应下降,造成VE下降有关,故出现运动中EqCO2的持续下降。而本研究发现虽然不同BMI组COPD 患者在静息状态下、无氧阈及最大运动状态下EqCO2呈下降趋势,其中体质量过低组最大运动时EqCO2与静息状态下及无氧阈时EqCO2相比均有明显降低,体质量正常组及肥胖组最大运动时EqCO2与静息状态下EqCO2相比有明显降低,但未发现无氧阈与静息状态下EqCO2差异有统计学意义。分析可能的原因为运动在无氧阈之下,血中乳酸无明显增高,但当运动超过无氧阈后,机体的乳酸明显增加,缓和碱中和反应产生的CO2会加重呼吸负担,使运动受限[31],同时COPD 患者由于存在肺动态过度充气,潮气量不能增加,从而造成最大运动时EqCO2的明显下降,通气效率升高。不同BMI对于EqCO2的影响,还需进一步研究证实。
但需要注意的是,由于BMI并不能准确判别肥胖是由于脂肪过多还是肌肉过多引起的,也不能准确判断患者骨骼肌消耗的情况,因为有些患者临床可以没有明显的体质量减轻,仅表现为肌肉的萎缩,在今后的研究中可采纳去脂体质量等相关指标进行进一步探讨。另外由于本研究纳入的COPD患者中GOLD1 级患者较少2 例,仅约占总人数3%,因此仅能反映GOLD2~4级患者的心肺运动参数的情况。
本研究通过对67例稳定期COPD 患者CPET参数的分析,认为BMI与通气效率呈明显负相关,肥胖的COPD 患者可能存在更高的通气效率,最大运动时通气效率明显增加。
利益冲突所有作者均声明不存在利益冲突
