抗菌肽LL37对脂多糖诱导的大鼠肺泡巨噬细胞炎性损伤的保护作用
2019-06-27施昀李王平韩璐瑶高永恒王虎金发光
施昀 李王平 韩璐瑶 高永恒 王虎 金发光
空军军医大学第二附属医院呼吸与危重症医学科,西安710038
近年来,由于抗生素的不恰当使用或者滥用已经导致了多种耐药菌的产生[1],其中致病菌对β-内酰胺类药物所产生的耐药性已成为世界性问题[2-3]。抗生素在杀伤细菌的过程中可使脂多糖(lipopolysaccharide,LPS)等致炎因子大量释放入血,进一步加重对机体免疫系统的破坏。因此,探索一种新的抗菌策略成为目前亟待解决的问题[1]。抗菌肽为一类由生物免疫系统诱导产生的带正电荷及具备疏水性和双亲性的小分子活性多肽,具有广谱的抗微生物活性[4-5],是天然免疫系统的重要组成部分。本实验采用LPS诱导大鼠肺泡巨噬细胞 (NR8383)构建体外炎症模型,观察细胞活性及凋亡情况,并检测肿瘤坏死因子-α (tumor necrosis factor-α,TNF-α)和IL-6 等炎症因子及核因子κB (nuclear factor-kappa B,NF-κB)蛋白的表达,进而评价LL37对巨噬细胞的保护效应,探讨其抗炎作用的具体分子机制以期从细胞水平理解LL37在炎症疾病中的应用价值,为临床合理应用提供实验依据。
1 材料与方法
1.1 主要材料 NR8383细胞购自齐氏生物科技有限公司;DMEM 培养基和胎牛血清购自美国HyClone公司;LPS购自美国Sigma公司;CCK8细胞检测试剂盒购自东仁化学科技有限公司;细胞凋亡检测试剂盒购自碧波生物科技有限公司;TNF-α、IL-6 ELISA检测试剂盒购自中国Neobioscience公司;P-NF-κB p65 抗体购自美国Abcam公司;LL37和 LL37中和抗体购自美国Hycult Biotech公司;流式细胞仪为BD Accuri C6(美国)。
1.2 实验方法
1.2.1 细胞培养与分组干预 NR8383细胞培养于含10% FBS 的 DMEM 培养基中,37 ℃、5%CO2恒温培养箱孵育。将细胞随机分为4 组:对照组给予正常培养液培养12 h,LPS 组给予含1 mg/L LPS的培养液培养12 h,LL37组给予含10 mg/L LL37 的培养液培养12 h,实验组在1 mg/L LPS刺激的基础上,同时加入10 mg/L LL37培养12 h,干预组在实验组基础上加入10 mg/L的LL37中和抗体。
1.2.2 CCK8测定巨噬细胞活性 取对数生长期NR8383细胞以每孔2×105接种于96孔板中,培养箱中孵育24 h。次日,弃上清,按 “1.2.1”进行分组及给药处理,每组设置3个复孔,同时设置空白孔,每孔培养液为100μl。37℃孵育12 h后,加入CCK8 10μl,37 ℃继续孵育4 h后在450 nm处测量吸光度值 (A450 nm)。细胞活力 (%)=(给药组A450 nm-空白A450 nm)/ (细胞对照组A450 nm-空白A450 nm)×100%。
1.2.3 流式细胞仪测定细胞凋亡 NR8383细胞以1×106接种于6 孔板,培养箱中孵育过夜后,按 “1.2.1”进行分组及给药处理细胞12 h。将细胞悬液收集到离心管中,1 000 r/min离心3 min,弃上清,加入预冷的PBS 重悬,用300 目滤网过滤后再次离心,弃上清,加入1×Annexin V binding buffer 调整细胞量,加入 Annexin V FITC、PI Solution 各 5 μl 混 匀,37 ℃ 避 光15 min,流式细胞仪检测。
1.2.4 细胞上清液中炎性因子TNF-α和IL-6检测 收集各组细胞后以1 000 r/min离心10 min,取细胞上清液。然后按照按试剂盒要求进行实验步骤,酶标仪检测样品450 nm 波长吸光度,绘制标准曲线,根据样品吸光度值,从标准曲线查得上清液中TNF-α和IL-6水平,每组实验重复3次。
1.2.5 细胞中蛋白检测 采用Western blotting法进行检测。提取各组细胞蛋白质,BCA 法检测蛋白质浓度并调整蛋白浓度,然后取相同总量的蛋白,上样到10%的SDS-PAGE 中,电泳,转膜。待转膜完毕后,加入5%脱脂牛奶封闭1 h后加入一抗,4 ℃摇床孵育过夜,TBST 室温下摇床洗膜3次后加入二抗,室温孵育30 min,TBST 清洗3次,化学发光,显影,定影。采用Image J软件分析电泳条带灰度值,以目的蛋白与β-actin灰度比值表示目的蛋白的相对表达量,实验重复3次。
1.2.6 统计学分析 采用Graphpad Prism7统计软件,计量资料用±s表示。各组数据间比较用One-way ANOVA 法, 两两比较采用least significant difference(LSD)法。P<0.05为差异有统计学意义。
2 结果
2.1 抗菌肽LL37对LPS致NR8383细胞活性的影响 用1 mg/L LPS处理NR8383细胞12 h,可见LPS组细胞活力下降,细胞数量减少;单独给予10 mg/L LL37处理细胞,未见对细胞活性有明显影响;在给予LPS 刺激同时用LL37 干预,LL37可明显减弱LPS对细胞的毒性作用;同时,LL37中和抗体可部分抑制LL37的作用。见图1。
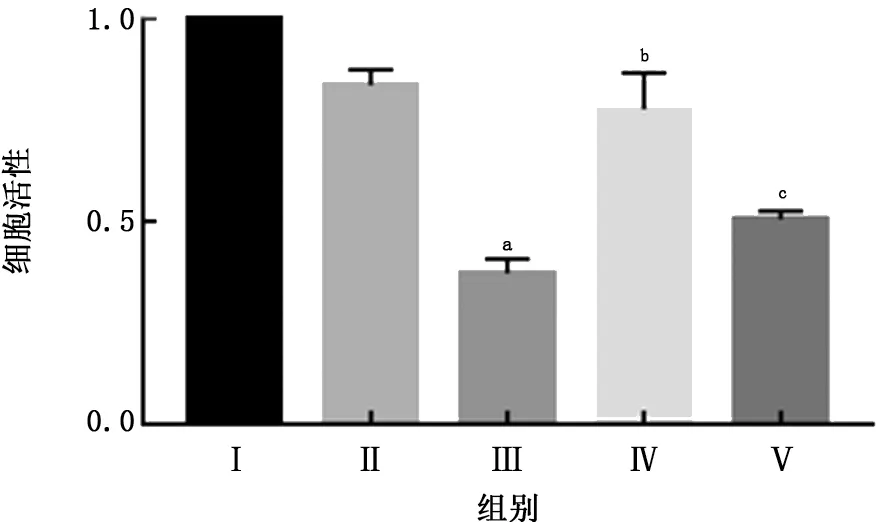
图1 抗菌肽LL37对LPS致NR8383细胞活性的影响
2.2 抗菌肽LL37对LPS致NR8383细胞凋亡的影响 用LPS (1 mg/L)处理NR8383细胞12 h,发现LPS组细胞凋亡率增加,实验组凋亡率减少,LL37中和抗体可抑制LL37 的保护作用,提示LL37能减轻LPS导致的细胞凋亡。见图2。
2.3 抗菌肽LL37对LPS致NR8383细胞TNF-α和IL-6分泌水平的影响 与对照组相较,LPS组TNF-α和IL-6分泌水平明显增加,差异有统计学意义 (P<0.05);实验组在 LL37 作用下,TNF-α和IL-6分泌水平均较LPS组有所下降,差异均有统计学意义 (P值均<0.05);干预组TNF-α和IL-6 分泌水平均较实验组组有所上升(P<0.05)。见表1。
2.4 抗菌肽 LL37 对 LPS 致 NR8383 细胞中P-NF-κB p65蛋白表达的影响LPS组细胞中P-NF-κB p65蛋白表达量高于对照组 (P<0.05);实验组细胞中P-NF-κB p65蛋白表达量低于LPS 组 (P<0.05);实验干预组细胞中P-NF-κB p65蛋白表达高于实验组 (P<0.05),提示LL37可降低LPS导致的细胞内P-NF-κB p65蛋白的增高,并且这种作用可被其中和抗体所抑制。见图3。
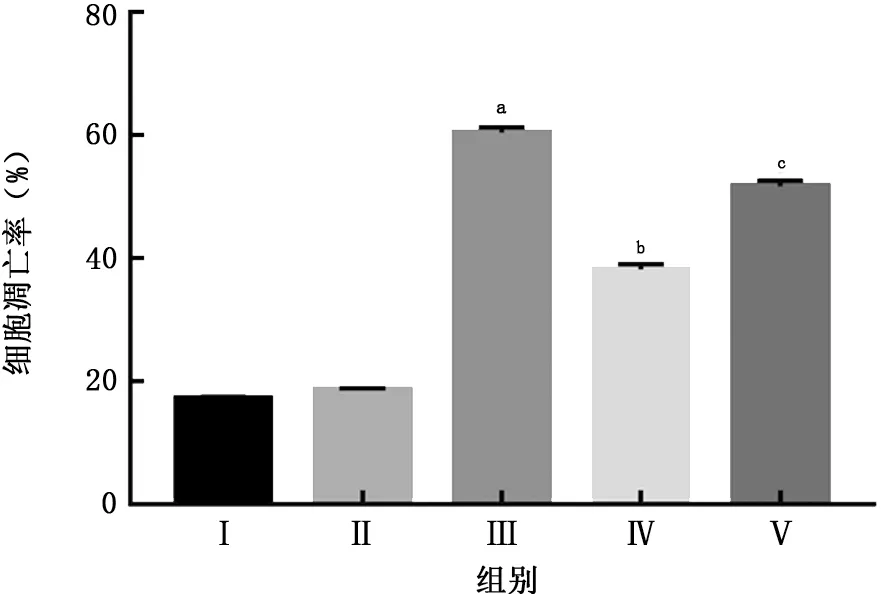
图2 抗菌肽LL37对LPS致NR8383细胞凋亡的影响
表1 抗菌肽LL37对LPS致NR8383细胞TNF-α和IL-6分泌水平的影响 (ng/L,±s)
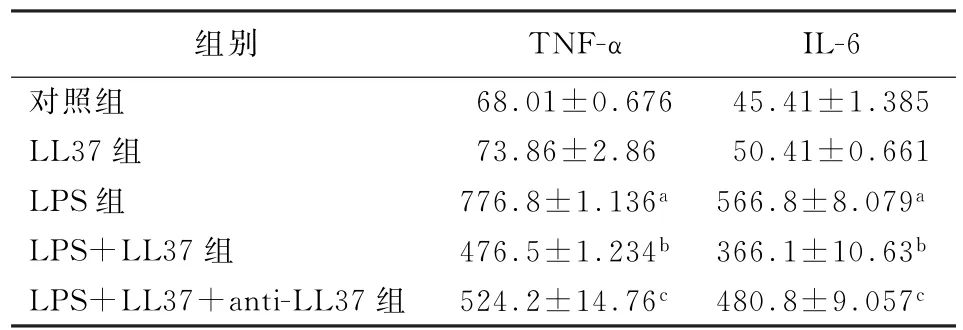
表1 抗菌肽LL37对LPS致NR8383细胞TNF-α和IL-6分泌水平的影响 (ng/L,±s)
注:TNF-α为肿瘤坏死因子α;LPS为脂多糖;与对照组比较,a P <0.05;与 LPS 组比较,b P <0.05;与 LPS+LL37 组比较,c P <0.05
组别 TNF-α IL-6对照组 68.01±0.676 45.41±1.385 LL37组 73.86±2.86 50.41±0.661 LPS组 776.8±1.136a 566.8±8.079a LPS+LL37组 476.5±1.234b 366.1±10.63b LPS+LL37+anti-LL37组 524.2±14.76c 480.8±9.057c
3 讨论
巨噬细胞活化导致炎症级联反应的开始和炎性介质的释放,是宿主防御致病微生物的关键过程,NR8383为大鼠源肺泡巨噬细胞,是研究炎症反应的常用细胞模型。LPS 作为革兰阴性细菌壁的主要成分,是一类主要的炎症因子,可作用于多种宿主细胞如巨噬细胞、中性粒细胞和内皮细胞[6],LPS与免疫细胞表面最主要的受体之一的CD14结合并通过LPS结合蛋白LBP形成LPS-LBP-CD14三联复合物,作用于Toll样受体4,从而启动跨膜信号转导,发挥致炎效应[7]。CAP-18/LL37 是目前发现的人类唯一的Cathelicidins 家族成员,hCAP18含有140个氨基酸残基,是中性粒细胞特殊颗粒 (亦称二级颗粒)中的主要蛋白质[8],CA P18以前体蛋白形式合成后,以非活性成分储存于颗粒中,受到刺激后,裂解产生它的C-端活性肽,即为LL37[9],多项研究表明其具有抗菌、抗病毒、抗真菌等多种生物学活性,是机体免疫防御的重要组成部分[10-12],本实验采用LPS诱导大鼠噬细胞NR8383建立炎症细胞模型,同时以抗菌肽LL37进行干预,进一步研究并揭示LL37发挥抗炎作用的分子机制。
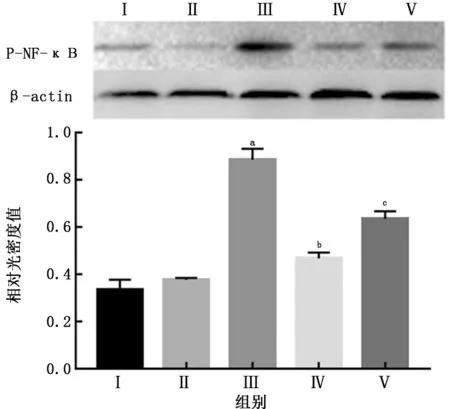
图3 抗菌肽LL37对LPS致NR8383细胞中P-NF-κB p65蛋白表达的影响
革兰阴性菌细胞壁中的LPS可诱导该细胞表达多种炎性因子,其中TNF-α可趋化并激活中性粒细胞,IL-6可诱导T 细胞和B 细胞的分化,放大炎症反应,从而导致组织细胞损伤[13]。Nagaoka等[14]研究表明,抗菌肽 LL-37 可抑制 LPS 与CD14结合,从而抑制LPS诱导巨噬细胞表达,产生TNF-α。已有研究表明,中和TNF-α可降低肺局部与全身的炎症反应强度[15],在急性肺损伤时抑制炎症反应能减轻肺组织细胞的凋亡[16]。本实验结果亦显示,LPS刺激后,可导致NR8383细胞活性降低,凋亡增加,并且诱导细胞TNF-α 和IL-6的分泌显著增多,LL37干预后可保护LPS对细胞的损伤作用,并明显抑制TNF-α和IL-6分泌的升高趋势,而且在给予LL37 抗体后可以中和LL37的保护作用。由此可见,LL37 可减少LPS诱导的炎性因子TNF-α和IL-6的产生,具有明显的抗炎保护作用。
研究表明,LPS与巨噬细胞膜上Toll样受体4的识别结合,可触发下游信号街头蛋白My D88的募集,后者又引起一系列信号级联反应,激活IκB激酶 (inhibitory kappa B kinase,IKK)或促分裂原活化蛋白激酶 (mitogen-activated protein kinase,MAPK)[15]。IKK 使IκB 发生磷酸化并释放P50/P65,MAPK 会磷酸化下游蛋白激酶和转录因子。活化的转录因子P50/P65进入到核内与靶基因启动子或增强子区特异序列结合,发挥转录调节功能,产生如TNF-α和IL-6等促炎因子[16]。本实验中,我们发现LL37可抑制LPS导致的细胞内活化的NF-κB蛋白的表达,提示LL37对细胞的保护作用可能是通过抑制NF-κB 信号通路,进而抑制巨噬细胞分泌、活化TNF-α与IL-6发挥抗炎作用。
综上所述,抗菌肽LL37可以有效抑制LPS诱导的NR8383细胞炎症,明显抑制巨噬细胞促炎症因子的分泌,发挥良好的抗炎作用。其抗炎机制可能与通过中和LPS,抑制巨噬细胞炎症通路中PNF-κB p65 蛋白的表达,以减少 TNF-α、IL-6 等相关促炎症因子分泌有关。
利益冲突所有作者均声明不存在利益冲突
