对氯苯丙氨酸在动物失眠模型中的应用概述
2019-06-27郭海波
郭海波,王 慧
(贵州中医药大学,贵阳 550002)
中枢神经机制的研究离不开动物模型,睡眠-觉醒的研究更是如此。失眠模型的建立和复制,能否成功尤为关键。利用药物建立失眠动物模型,因效果确切、操作方便受到诸多学者的青睐,而对氯苯丙氨酸是建立失眠动物模型中最常用的药物之一。对氯苯丙氨酸,又称芬克洛宁,英文名称:4-Chloro-DL-phenylalanine, Fenclonine,简称PCPA,CAS编号:7424-00-2,其它化学或英文名称还有:para-chlorophenylalanine, Fencloninum, DL-4-chlorophenylalanine, 2-amino-3-(4-chlorophenyl)propanoic acid, P-chlorophenylalanine 等。它是5-羟色胺(5-hydroxytryptamine, 5-HT)生物合成中的起始酶和限速酶—色氨酸羟化酶(tryptophan hydroxylase, TPH)的选择性和不可逆抑制剂[1]。色氨酸经色氨酸羟化酶生成5-羟色氨酸(5-hydroxytryptamine, 5-HTA),5-HTA脱羧生成5-HT。PCPA通过抑制色氨酸羟基化而阻断5-HT的合成,可显著降低脑内和外周血中的5-HT浓度,达到排空5-HT的目的,在睡眠-觉醒、镇痛和行为学等多种中枢机制研究中具有广泛应用。
PCPA分子式C9H10ClNO2(见图1),分子量199.634 g/mol,密度1.336 g/cm3,熔点238℃~240℃,沸点339.5℃;在25℃的水中可溶性为961 mg/L[2],属于微溶物质。在平均体重7.5 kg的猴子实验中观察到的血浆半衰期约为10.5 h[3]。大量口服可导致急性中毒,皮肤接触可能会出现过敏反应。
最早在1953年,就已经有文献观察了PCPA对金黄色葡萄球菌中掺入苯丙氨酸的抑制作用,并以此来研究细菌对氨基酸的同化影响。在1966年PCPA被明确为“一种新的、脑血清素(5-HT)的特定消耗剂”[4],发现它可以“抑制睡眠”[5],并能改变5-HT转运蛋白mRNA水平和基因产物的表达[6]。有文献[7]还报道了PCPA的首次人体试验:“在6名正常的监狱囚犯志愿者中,每天给予PCPA 3000 mg,可使血清中5-HT下降至治疗前水平的60%~70%,尿中5-羟吲哚乙酸(5-hydroxyindoleacetic acid,5-HIAA)排泄至10%~50%”,并从药理学角度对PCPA进行了诠释。还有学者利用PCPA研究了脑内5-HT合成、储存和释放之间的关系[8]。之后越来越多的学者利用PCPA抑制TPH的作用对睡眠和呼吸[9]、昼夜节律[10]、认知和情感[11]、学习[12]、行为[13]、记忆、食欲[14]、饮酒和生殖[15]、性行为[16]和杀戮[17]等多种中枢神经机制进行了广泛研究。PCPA还曾被作为5-HT拮抗剂而被用于实验性治疗类癌综合征导致的腹泻、腹痛和潮红等[18],但骨髓抑制[19]、过敏反应和精神障碍[20]阻碍了它在临床中的使用。此后,它被更多的用于和5-HT相关的病理或生理机制研究中。
在我国,PCPA的应用较为局限,大多用于动物失眠模型的建立,其中应用最多的是大鼠失眠模型的复制,并被认为是经典的动物失眠模型[21]。有研究显示,在一次性腹腔注射PCPA后,24 h内大鼠活动和摄食开始减少,之后是持续1~2 d的失眠阶段,大鼠昼夜节律消失,白天活动增加,这是5-HT水平降低的结果[22]。还有研究显示在给予PCPA后,5-HT能神经元末梢中的TPH活性降低至对照组的10%,使用免疫组化方法甚至检测不到5-HT[23]。
1 PCPA悬浮液的配制及使用
1.1 PCPA悬浮液的配制
PCPA悬浮液的制备在不同的文献中有所区别,但限于PCPA在水中溶解度不高,直接溶于生理盐水中使用容易堵塞注射器针头,阻碍造模进展。有部分学者加用增溶剂、表面活化剂,如阿拉伯胶、甲基纤维素、聚山梨酯80等来促溶;还有学者利用PCPA在弱碱性环境中溶解度更高的特点,在PCPA悬浮液中加入少量氢氧化钠(NaOH)以促进溶解。本文统计了在不同文献中使用PCPA的各种方法(见表1)。
但遗憾的是各文献未给出使用促溶剂或表面活化剂的具体剂量以及与PCPA的详细比例。依据本课题组制作失眠模型的经验,以聚山梨酯80为例,认为1.0 g PCPA加入聚山梨酯80溶液10~20 μL较为合适。有学者[25]对比了单次腹腔注射相同剂量(450 mg/kg)使用1.0%阿拉伯树胶促溶的PCPA和使用0.1%聚山梨酯80促溶的PCPA在实验中的作用,结果显示,5-HT水平下降的幅度二者类似。但含有阿拉伯树胶的PCPA治疗组中,观察到猫的情绪防御反应增加;含有聚山梨酯80治疗组中去甲肾上腺素(norepinephrine, NE)水平显著降低,而含有阿拉伯树胶PCPA治疗组中的NE水平没有任何变化。认为聚山梨酯80对生化和行为过程都能发挥作用,在研究大脑机制中使用脱水山梨糖醇是不可取的[25],因为聚山梨酯80是由山梨糖醇及其脱水物单油酸酯与环氧乙烷共聚所得。但本课题组未查到更多的文献支持聚山梨酯80在大脑机制研究中具有影响作用,而用来促溶的量又极少。但犬类对聚山梨酯80十分敏感,可产生明显的组胺反应,如果选择犬作为实验动物,可能不适合用聚山梨酯80来对PCPA促溶。
1.2 PCPA在动物中的应用及使用方法
已有文献报道PCPA对多种实验性哺乳动物,

表1 文献中使用的PCPA溶解方法Table 1 PCPA dissolution methods reported in the literature
注:生理盐水pH值5.5~6.5,弱碱性生理盐水pH值7.4。
Note. Normal saline pH 5.5~6.5, weak alkaline saline pH 7.4.
如:小鼠[5]、大鼠[30]、猫[31]、绵羊[32]、猪[11]、豚鼠[33]和猴子[3,34]等脑内的5-HT可产生有效和选择性抑制。直到现在,这些实验动物在睡眠-觉醒机制研究中仍是不可或缺的。其它实验动物还有果蝇[35]、蜗牛[36]等。需要明确的是,应用PCPA,不完全是建立失眠动物模型,它还可以在动物体内产生一系列代谢失衡,如模拟人类苯丙酮尿症[37],但这种模型与人体病理并不完全相同,应用较少。
1.2.1 给药浓度
在不同实验中,根据实验设计的不同以及实验动物的差别选择的PCPA浓度也不同,但总体来说,浓度范围较为宽泛,例如:选择猫作为实验动物口服PCPA浓度从75 mg/kg到800 mg/kg不等[38];选择大鼠作为实验动物腹腔注射PCAP的浓度从50 mg/kg到500 mg/kg不等[24,39-40];选择猪作为实验动物PCPA的腹腔注射浓度从50~100 mg/kg不等[11,41]。而大鼠脑内(脑室或中缝核)给药从2.5 μg /μL、10 μg/μL到0.6 mg/μL不等[42-44]。连续给予小剂量和单次给予大剂量有没有差别呢?在行为学研究中以大鼠作为实验动物连续3 d口服较小剂量(200 mg/kg或400 mg/kg)与单次口服更高剂量(1600 mg/kg或3200 mg/kg)显示出相当的效果[45],但文章未探讨不同剂量PCPA的血药浓度和代谢情况,笔者在Pubmed和中国知网上查阅了大量文献,未看到有国内外文献研究PCPA在实验中的剂量和血药浓度之间的变化关系,大多文献通过检测脑内5-HT、TPH、5-HTA、5-HIAA的浓度和尿中的色氨酸、5-HIAA的排泄来观察和确定PCPA的效果。
1.2.2 给药方法
实验设计的不同决定了给药途径也不同,有口服[40,46]、皮下注射[27]、腹腔注射[47]、侧脑室或中缝核微量注射[43-44]等。其中腹腔注射和口服给药是文献中使用最多的方法。有研究显示口服和腹腔注射PCPA对大鼠脑内5-HT和 5-HIAA含量的影响没有显著差异[48]。
1.2.3 给药时间
给药时间从一次性给药到连续性给药5~7 d不等,最长的达到了37 d[49]。有研究显示腹腔注射PCPA后,大鼠脑内5-HT含量逐渐降低,在第3天效果达到最大化,至少在一周内保持较低水平[14]。如 PCPA 400 mg/(kg·2 mL),腹腔注射3 d后,与治疗前对比大鼠中脑的5-HT浓度降低了74%[50]。根据相关研究[51]以及在实验中所积累的数据,以成年大鼠为例,每日1次腹腔注射PCPA 300~350 mg/kg,给药3 d,可出现白天活动增加、昼夜节律消失、毛发无光泽、脱毛增加、攻击性增加相互撕咬等,这预示着失眠模型的建模成功,与以往的文献研究基本一致[52]。其他动物给药方法可参考相关文献或依据实验设计来决定给药量。
2 与造模无关的不良反应以及造模失败的处理
PCPA在人类中用于类癌综合征时统计到的副作用有头晕、头痛、骨髓抑制等[20],接触皮肤可能会出现过敏反应(见表2)。在实验动物中,以大鼠为例,使用PCPA后,出现昼夜节律消失、攻击性增加等表现(见表2),这些症状大多学者认为是失眠造模成功所致。有学者认为5-HT的单独消耗在未成熟的大鼠中引起的损伤很少或没有损伤[24]。但也有研究显示:PCPA可使断奶大鼠的前后晶状体发生特征性改变,而其中大约有35%发展成白内障,但以同样剂量处理的猴子中却未发现任何眼部毒性,显示只对大鼠具有特异性[53]。还有研究显示PCPA可诱导雄性大鼠的性冲动[16]。使用PCPA后的大鼠表现,与失眠模型联系较少的除了性兴奋和晶状体改变,尚未看到有文献记录与失眠模型有关的其他不良反应,也未看到有实验使用PCPA造模失败的记录。另外,造模成功与否与剂量和浓度密切相关,如果浓度过低、剂量过小,可能会使5-HT的消耗缓慢,从而延迟失眠的出现。
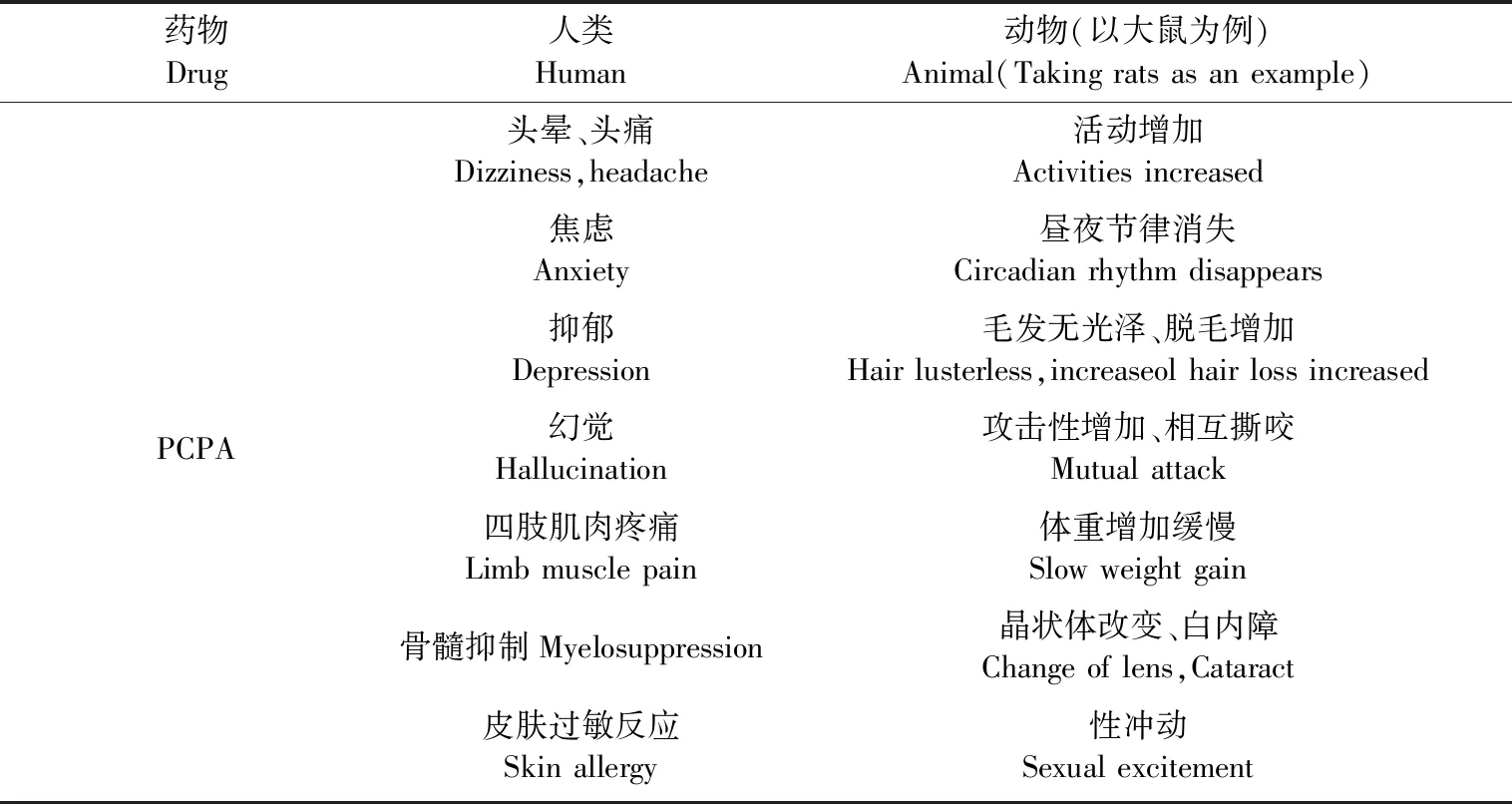
表2 使用PCPA后出现的症状和病理状态Table 2 Symptoms and pathology after using PCPA
3 结语
PCPA作为TPH抑制剂,最早在1966年就有文献从临床药理学的角度对PCPA进行了评价[6],并用志愿者进行了人体实验,到70年代开始试用于类癌综合征的治疗[54]。但因其副作用的影响阻碍了其临床使用,文献中报道的临床案例也较少,到90年代已经看不到PCPA在人体上使用的报道。与此相反的是,PCPA在动物实验中使用的文献越来越多的被报道,特别是在失眠模型的建立以及与5-HT相关的中枢神经机制研究中。
PCPA可阻碍5-HT的合成,而5-HT作为单胺类神经递质,在慢波睡眠(SWS)的诱导和维持中具有重要作用[55]。利用PCPA制作失眠动物模型,可进一步探索SWS形成的机制、5-HT在睡眠稳态中的作用,以及与此相关的多种中枢神经机制。但有研究发现,PCPA不仅影响5-HT合成,还可使中缝背核和尾状壳核NA和多巴胺(dopamine, DA)水平下降,但对纹状体的NA含量无影响[50]。还有研究显示:PCPA使前后下丘脑、中脑和杏仁核中的5-HT和5-HIAA的水平下降、杏仁核和后下丘脑的DA水平增加、下丘脑前部和中脑也有增加的倾向[56],显示PCPA导致失眠的机制可能不仅仅是阻断5-HT合成这一条途径。利用PCPA建立失眠动物模型,因其在水中溶解度较低在注射时极易出现针头堵塞,这容易阻碍造模工作的进展,因此,改良制备方法和寻找更合适的TPH或5-HT抑制剂作为替代药物具有积极意义。对乙炔基苯丙氨酸(p-ethynylphenylalanine, PEPA)是一种比PCPA更有效、特异性更强的TPH抑制剂[57],研究显示PEPA体外抑制TPH活性达40%~65%,而PCPA在体外抑制TPH活性为30%~50%[58]。这些证据表明,与经典使用的TPH抑制剂PCPA相比,化合物PEPA在体外是更有效的TPH抑制剂。而在注射PEPA后,在5-HT神经元投射区域,海马、纹状体和额叶皮质中细胞外5-HT水平分别在90、40和30 min迅速下降[59]。与PCPA对照相比,仅为PCPA浓度的十分之一,就降低了5-HT和5-HIAA水平的85%,抑制TPH活性高达97%,显示PEPA能够有力、迅速和不可逆地降低5-HT水平。这些结果表明PEPA与PCPA相比是一种更为有效的药理工具,有望取代PCPA在动物失眠模型中得到更广泛的使用。
