文拉法辛对慢性束缚应激大鼠焦虑和抑郁样行为的影响
2019-06-27赵洪庆何文龙张思静韩远山王宇红
赵洪庆,雷 昌,杨 娴,何文龙,张思静,韩远山,2,王宇红,2*
(1.湖南中医药大学,中药粉体与创新药物省部共建国家重点实验室培育基地,长沙 410208;2.湖南中医药大学,科技创新中心,长沙 410208)
焦虑症和抑郁症是当今社会最常见的两种神经精神疾病,两者具有高度关联性且多同时发生,为患者造成了很大的经济负担[1]。据WHO流行病学调查显示,两者共病比例可高达70%,且近80%的抑郁症患者伴有明显的焦虑症状,焦虑症状不仅能导致抑郁症治疗产生阻抗,也是增加其致残率和致死率的重要原因[2]。因此,寻找两种疾病的共性,并在此基础上开展防治研究具有重要意义。大量文献研究表明,慢性束缚应激能诱导啮齿类动物的抑郁和焦虑样行为,但对束缚时长及造模总时长有不同的报道[3-4],本课题组前期通过对大鼠束缚时间(3 h、6 h)和慢性束缚应激总时长(7 d、14 d、21 d)筛选研究发现,21 d慢性束缚应激6 h能使大鼠表现出稳定的抑郁和焦虑样行为,是研究抑郁与焦虑共患病的良好动物模型[5]。文拉法辛是一种新型抗抑郁药,主要通过抑制5-HT和NE的再摄取来改善抑郁患者的临床症状,临床研究发现,文拉法辛治疗抑郁症伴发焦虑障碍患者效果要明显优于氟西汀等常规抗抑郁药[6]。然而,目前对文拉法辛的基础研究都是从抗抑郁作用着手,并未明确其对动物焦虑样行为的影响。基于此,本实验以慢性束缚应激大鼠为研究对象,观察文拉法辛对大鼠焦虑和抑郁样行为的影响,并从脑内单胺递质和HPA轴等角度探讨其可能的作用机制。
1 材料和方法
1.1 实验动物
36只SPF级健康雄性SD大鼠,体质量180~200 g,购于湖南斯莱克景达实验动物有限公司[SCXK(湘)2013-0004],饲养于湖南中医药大学第一附属医院SPF级动物房[SYXK(湘)2015-0003],实验经动物伦理委员会批准,伦理编号:20180717。大鼠购入后适应性喂养3 d,整个实验期间均在室温(24±1)℃、相对湿度(50±5)%环境下,并按实验动物使用的3R原则给予人道关怀。
1.2 主要试剂与仪器
盐酸文拉法辛片(规格:每片75 mg,批号:L20778)购于成都康弘药业公司;5-羟色胺(5-hydroxy tryptamine, 5-HT)、去甲肾上腺素(norepinephrine, NE)、多巴胺(dopamine, DA)对照品购于中国食品药品检定研究院;促肾上腺皮质激素释放激素(corticotropin releasing hormone, CRH)、促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)、皮质酮(corticosterone, CORT)试剂盒购于上海晶天生物公司;苏木精、伊红购于上海江莱生物公司;大鼠固定架购于北京冀诺泰科技公司;高架十字迷宫购于长沙肯基科技公司;斯金纳箱购于西班牙Panlab公司;RM223切片机、倒置光学显微镜购于德国Leica公司;高效液相色谱仪购于美国Agilent公司;电化学检测器购于荷兰Antec公司;酶标仪购于美国Thermo Scientific公司。
1.3 实验方法
1.3.1 动物分组与造模
根据体质量值将36只SD大鼠随机分成正常对照组、慢性束缚应激模型组和文法拉辛组,每组12只。对照组大鼠正常饲养,模型组和文拉法辛组大鼠均给予21 d的慢性束缚应激,具体方法为:将大鼠放入特制的长22 cm,直径8 cm的固定架中,固定架前端有通气孔使动物保持正常呼吸,尾端有三个孔径的圆形门,可根据动物身长自由切换,每天固定时间为9:00~15:00,共6 h。
1.3.2 动物给药
于造模期间灌胃给药,文拉法辛临床人用剂量为75 mg/d,根据体表面积比率换算,大鼠的临床等效剂量为6.75 mg/kg,灌胃体积为10 mL/kg,每天1次,对照组和模型组大鼠则给予等体积蒸馏水。末次给药完成后,动物进行行为学测试,测试完成后取血液和海马组织保存。
1.3.3 行为学检测
(一)焦虑行为检测:① 高架十字迷宫实验:将大鼠放入标准的高架十字迷宫正中央区域,头朝闭臂,使动物自由探索5 min,记录大鼠分别进入封闭臂次数(closed-arm entries, CE)和开放臂次数(open-arm entries, OE),以及在封闭臂停留时间(closed-arm times, CT)和开放臂停留时间(open-arm times, OT),由此计算出:(1)总穿臂次数(total entries, TE):OE+CE;(2)进入开放臂次数的比例(OE%):OE/(OE+CE)×100%;(3)开放臂停留时间比例(OT%):OT/(OT+CT)×100%。② 场景恐惧测试:于测试前1 d进行训练,大鼠在斯金纳箱适应2 min后,给予30 s的噪音(5 kHz,75 dB),在噪音结束最后2 s同时给予电击(50 V),继续停留30 s。24 h后进行测试,大鼠进入斯金纳箱2 min后给予60 s的噪音,记录60 s内大鼠的僵住时间(Freezing)百分比。
(二)抑郁行为检测:① 旷场实验:将大鼠放入长宽高分别为80、80、40 cm的黑色敞箱中,敞箱底部均匀划分为25个小格,测试时将大鼠置于敞箱正中央小方格中,每次均从同一方向放入,大鼠自由活动1 min后,记录4 min内大鼠的水平运动次数和垂直站立次数。② 强迫游泳实验:将大鼠放入高50 cm、直径20 cm、水深约35 cm的圆柱形塑胶玻璃筒中,水温保持在(24±1)℃,待大鼠自由游泳适应1 min后,记录5 min内大鼠游泳不动时间。
1.3.4 组织病理形态观察
取固定于4%多聚甲醛溶液中的海马组织,常规石蜡包埋后切片,经脱蜡、水化后进行苏木精-伊红染色(HE染色)后再进行脱水、透明和封片,装盒待用。显微镜下观察、拍取图片,分析各组大鼠海马组织的病理损伤情况。
1.3.5 HPLC-ECD检测
采用高效液相色谱-电化学(HPLC-ECD)法检测大鼠海马单胺递质含量,取海马组织称重,按1:10比例加入0.01 mol/L高氯酸溶液,冰上匀浆,4℃、13 000 r/min条件下离心15 min后取上清液,0.22 μm滤膜过滤后待测。色谱条件为:色谱柱:Quattro 3 C18柱;流动相:磷酸二氢钠/柠檬酸混合液—甲醇(87∶13);流速:0.2 mL /min;柱温:35℃;进样量:20 μL。标准曲线的制备方法为:精密称取适量对照品溶于0.01 mol/L高氯酸溶液中,配成1 mg/mL储备液,依次稀释成200、100、50、25、12.5、6.25 ng/mL,根据各峰面积计算标准曲线,见表1。
1.3.6 ELISA实验
采用酶联免疫吸附(ELISA)法检测血浆CRH、ACTH、CORT含量,整个过程按照ELISA试剂盒说明书进行。依次将血浆、标准品、HRP标记的检测抗体加入到试剂盒中,37℃温育30 min,洗涤液冲洗5次;分别加入显色剂A、显色剂B各50 μL,混匀,37℃避光显色15 min,而后加入终止液50 μL以终止反应,于450 nm波长下测量各孔的吸光度值。根据标准曲线求出各组大鼠血浆待测物质的含量。
1.4 统计学方法
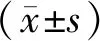

表1 单胺递质对照品的回归方程和线性范围Table 1 Regression equations and linear ranges of three monoamine neurotransmitters
2 结果
2.1 文拉法辛对慢性束缚应激大鼠焦虑行为的影响
在高架十字迷宫实验中,模型组大鼠较正常大鼠的TE、OE%、OT%值均明显下降(P<0.01);文拉法辛给药后,大鼠TE、OE%和OT%值均显著上升(P<0.01或P<0.05);在场景恐惧测试中,模型组大鼠Freezing时间比显著上升,给药后则有较明显的下降(P<0.05)。说明文拉法辛能改善慢性束缚应激大鼠的焦虑样行为。见表2。
2.2 文拉法辛对慢性束缚应激大鼠抑郁行为的影响
旷场实验和强迫游泳实验发现,与正常大鼠比较,慢性束缚应激大鼠自主活动评分显著下降(P<0.01),不动时间增加(P<0.01),展现出运动不能和行为绝望的抑郁样特征,在文拉法辛治疗后,大鼠抑郁样行为得到明显改善,水平和垂直得分增加(P<0.01或P<0.05),强迫游泳不动时间下降(P<0.01)。见表3。
2.3 文拉法辛对慢性束缚应激大鼠海马形态学的影响
如图1所示,正常大鼠海马神经细胞排列整齐紧密,细胞间隙正常,形态结构完整;模型组大鼠海马神经细胞有较明显的缺失,细胞排列紊乱,部分神经元胞体呈空泡状,胞核深染,整体损伤明显;文拉法辛组大鼠海马神经元数量增多,排列趋于正常,整体损伤情况有明显的缓解。
2.4 文拉法辛对慢性束缚应激大鼠单胺神经递质的影响
与对照组相比,模型组大鼠海马组织中神单胺类神经递质5-HT、NE、DA含量均显著下降(P<0.01或P<0.05);而在给予文拉法辛治疗后,单胺神经递质含量明显回升(P<0.01或P<0.05),表明文拉法辛能改善慢性束缚应激大鼠脑内单胺递质失调状态。见表4。

表2 各组大鼠焦虑样行为测试结果 (n=12)Table 2 Results of anxiety-like behavior test in the rats
注:与对照组比较,**P<0.01。与模型组比较,#P<0.05,##P<0.01。
Note. Compared with the control group,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.

表3 各组大鼠抑郁样行为测试结果 (n=12)Table 3 Results of depressive-like behavior test in the rats
注:与对照组比较,**P<0.01。与模型组比较,#P<0.05,##P<0.01.
Note. Compared with the control group,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.

表4 各组大鼠海马单胺神经递质含量 (ng/g,n=6)Table 4 Hippocampal monoamine neurotransmitter content in the rats
注:与对照组比较,*P<0.05,**P<0.01。与模型组比较,#P<0.05,##P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.
2.5 文拉法辛对慢性束缚应激大鼠血浆HPA轴指标的影响
与对照组相比,模型组大鼠血浆CRH、ACTH、CORT含量均有明显的上升(P<0.01),HPA轴紊乱明显;文拉法辛治疗后,血浆CRH、ACTH、CORT含量均有不同程度的下降(P<0.01或P<0.05),其中以CRH下降最为明显(P<0.01),表明文拉法辛能抑制慢性束缚应激大鼠HPA轴过度亢进现象。见表5。
3 讨论
本研究采用21 d慢性束缚应激的方法造模,经多种行为学检测发现,大鼠在高架十字迷宫中的开臂探索行为下降,场景恐惧中的Freezing时间比增加,同时自主活动能力下降,绝望行为增加,表现出稳定的焦虑和抑郁样行为。该结果证明慢性应激是焦虑症与抑郁症的共同发病因素,慢性束缚应激可作为焦虑抑郁共病发病机制研究及药物筛选的动物模型。
单胺假说是目前公认的抑郁症发病关键机制,假说认为抑郁症的发病与中枢神经单胺类递质5-HT、NE、DA的耗竭紧密相关[7]。研究发现,抑郁症的严重程度与体内单胺递质的耗竭呈正相关[8]。目前临床上主要以5-HT、NE重吸收抑制剂(SSRIs)作为抑郁类疾病治疗的首选药物,通过阻断5-HT或NE重吸收,提升其在突触间隙的浓度,进而有效缓解病情[9]。海马作为脑内主要负责学习记忆及情绪行为的组织,是焦虑、抑郁等神经精神疾病研究的关键靶器官[10]。本研究发现,慢性束缚应激大鼠海马组织存在神经元缺失、排列紊乱、部分胞体呈空泡状等病理现象,单胺神经递质含量显著下降,均与其焦虑和抑郁样行为相关,而在给予抗抑郁药文拉法辛干预治疗后,大鼠神经元损伤情况有所缓解,海马组织内单胺递质含量有明显的升高,焦虑及抑郁样行为均明显改善。
HPA轴由下丘脑、垂体和肾上腺构成,是体内重要的反馈调节系统,下丘脑分泌CRH,激活垂体产生ACTH,继而促进肾上腺皮质的组织增生及皮质激素的生成分泌,共同维持机体内环境的平衡[11]。研究表明,焦虑症与抑郁症患者均存在HPA轴功能亢进现象,且抑郁共患焦虑患者HPA轴亢进更为明显[12]。长期接受慢性应激会导致HPA轴基础活性增高,使肾上腺分泌糖皮质激素增多,透过血脑屏障进入到脑,而海马组织又是脑内HPA轴的高位调节中枢,密集分布着糖皮质激素受体,易遭受过量糖皮质激素的攻击而产生神经毒性,影响大脑的认知功能并加重情绪障碍[13-14]。本研究发现,慢性束缚应激大鼠血浆CRH、ACTH、CORT含量为正常大鼠的数倍,显示其体内HPA轴高亢,而文拉法辛治疗后能降低模型大鼠的HPA轴功能亢进状态。

图1 各组大鼠海马组织的病理改变(HE染色)Figure 1 Pathological changes in hypocampal tissues of the rats

组别Groups促肾上腺皮质激素释放激素CRH促肾上腺皮质激素ACTH皮质酮CORT对照组 Control7.85 ± 0.964.27 ± 0.6918.91 ± 3.10模型组 Model20.89 ± 4.64∗∗9.70 ± 1.97∗∗37.37 ± 5.81∗∗文拉法辛组 Venlafaxine 11.79 ± 2.08∗∗ 6.84 ± 0.91# 26.75 ± 4.72#
注:与对照组比较,*P<0.05,**P<0.01。与模型组比较,#P<0.05,##P<0.01。
Note. Compared with the control group,*P<0.05,**P<0.01. Compared with the model group,#P<0.05,##P<0.01.
综上,文拉法辛能改善慢性束缚应激大鼠的焦虑和抑郁样行为,减缓海马组织的损伤,其作用可能与上调脑内单胺神经递质含量,抑制体内HPA轴过度亢进有关。
