左氧氟沙星耐药小鼠模型的建立
2019-06-27崔煦然丁军颖赵京霞郭玉红崔晓兰刘清泉
崔煦然,丁军颖,赵京霞,郭玉红,崔晓兰,刘清泉*
(1.首都医科大学附属北京中医医院,北京 100010;2.北京市中医研究所,北京 100010;3.中医感染性疾病基础研究北京市重点实验室,北京 100010;4.中国中医科学院中药研究所,北京 100700)
细菌性肺炎是常见的重症肺炎。铜绿假单胞菌(Pseudomonasaeruginosa, PA)是引起医院获得性肺炎和呼吸机相关肺炎最多见的革兰阴性杆菌之一[1],常见发生于患有多种基础疾病或免疫力低下的患者[2-3]。PA耐药性强,耐药谱广,对多种抗菌药物表现为天然或获得性耐药[4]。1979 年,Cash等[5]以气管切开注射的方式构建了PA致小鼠肺部感染的模型;1994年,童明庆等[6]采用肺炎克雷伯菌攻击小鼠肺脏造成肺部感染,从而成功地建立了小鼠实验性支气管肺炎模型;2009年李建生等[7]采用细菌滴注和风热刺激结合模型的方法建立了肺炎克雷伯杆菌肺炎痰热证模型。这些模型的制备充分证实了细菌性肺炎模型的可行性。为了探索PA体内耐药性产生的变化和治疗方法,需要建立一种实验模型来进行深入研究。因此,本实验拟通过体内实验,结合重症肺炎诊断标准进行左氧氟沙星耐药研究。
1 材料和方法
1.1 实验材料
1.1.1 实验动物
SPF级ICR小鼠96只,雌雄各半,体重为(14±1)g,购自北京维通利华试验动物技术有限公司,[SCXK(京)2012-0001]。实验在中国医学科学院中药研究所生物安全实验室[SYXK(京)2013-0035]进行,实验操作经过北京市中医研究所动物伦理委员会审批,审批编号:2015010201,并按照实验动物使用的3R原则给予人道主义关怀。
1.1.2 细菌株
PA标准株27853,购自ATCC,实验室传代1次后,-80℃冰箱保存。
1.2 主要试剂与仪器
左氧氟沙星片:第一三共制药(北京)有限公司,生产批号:BNO11A1;氯化钠注射液:石家庄四药有限公司产品,批号1402261909;MH肉汤:Oxoid公司,批号1583507;乙醚为普通市售分析纯。
生物安全柜:购自Thermo公司,型号ThermoMSC1.8/1.2;电子天平(称肺重):购自梅特勒-托利多仪器(上海)有限公司,型号AL204;电子天平(称体重):购自上海越平科学仪器有限公司,型号YP1002;恒温振荡培养箱:购自哈尔滨市东联电子技术开发有限公司,型号HZQ-F160;超低温冰箱:购自Thermo公司,型号ULT Freezer。
1.3 实验方法
1.3.1 剂量设计
(一)左氧氟沙星:人临床用量为0.3 g/60(kg·d),试验时小鼠的等效剂量为0.055 g/(kg·d)。试验中低剂量标准认为未达到临床左氧氟沙星使用剂量。本次试验采用五个剂量,即0.0275、0.037、0.055、0.073、0.092 g/(kg·d),分别为临床剂量的0.5、0.67、1、1.33、1.67倍,0.0275、0.037 g/(kg·d)即为低剂量。药物试验时,小鼠按0.2 mL/10 g体重灌胃给药。
(二)PA菌液:取一定量的菌液,加入MH营养肉汤中,37℃恒温振荡培养24 h。试验时,采用比浊法调整菌液至试验浓度。
1.3.2 低浓度左氧氟沙星对PA(1×109cfu/mL)单次感染小鼠肺炎模型的作用[8]
取ICR小鼠30只,雌雄各半,按体重等级随机分为正常组、模型组1、左氧氟沙星临床治疗剂量组(左氧氟沙星组1)、低浓度左氧氟沙星刺激3 d组(模型组2)、低浓度左氧氟沙星刺激后治疗组(左氧氟沙星组2),每组6只。各组动物麻醉后,以1×109cfu/mL浓度的菌液滴鼻感染,每只50 μL。感染后1 h,各给药组按0.2 mL/10 g灌胃给药,每天1次,连续6 d,模型对照组在同等条件下蒸馏水灌胃。各组小鼠每天称重1次(感染当天记为第1天),并观察小鼠状态,于第7天称重后,将小鼠断颈处死,取肺部,记录肺重。
1.3.3 低浓度左氧氟沙星对PA(1×1010cfu/mL)单次感染小鼠肺炎模型的作用[8]
取ICR小鼠36只,雌雄各半,按体重等级随机分为正常组、模型组1、左氧氟沙星临床治疗剂量组1(左氧氟沙星组1)、左氧氟沙星临床治疗剂量组2(左氧氟沙星组2)、低浓度左氧氟沙星刺激3 d组(模型组2)、低浓度左氧氟沙星刺激后治疗组(左氧氟沙星组3),每组6只。各组动物用乙醚轻度麻醉,以1×1010cfu/mL浓度的菌液滴鼻感染,每只50 μL。感染后1 h,各给药组按0.2 mL/10 g灌胃给药,每天1次,连续6 d,模型对照组在同等条件下蒸馏水灌胃。各组小鼠每天称重1次(感染当天记为第1天),并观察小鼠状态,于第7天称重后,将小鼠断颈处死,取肺部,记录肺重。
1.3.4 低浓度左氧氟沙星对PA重复感染小鼠肺炎模型的作用8]
取ICR小鼠30只,雌雄各半,按体重等级随机分为正常组、模型组1、左氧氟沙星临床治疗剂量组(左氧氟沙星组1)、低浓度左氧氟沙星刺激3 d组(模型组2)、低浓度左氧氟沙星刺激后治疗组(左氧氟沙星组2),每组6只。各组动物用乙醚轻度麻醉,以1×109cfu/mL浓度的菌液滴鼻感染,每只50 μL。感染后1 h,各给药组按0.2 mL/10 g灌胃给药,每天1次,连续3 d,模型对照组在同等条件下蒸馏水灌胃。于第4天,各组动物再次用乙醚轻度麻醉,以1×109cfu/mL浓度的菌液滴鼻感染,每只50 μL。感染后1 h,各给药组按0.2 mL/10 g灌胃给药,每天1次,连续3 d,模型对照组在同等条件下蒸馏水灌胃。各组小鼠每天称重1次(感染当天记为第1天),并观察小鼠状态,于第7天称重后,将小鼠断颈处死,取肺部,记录肺重。
1.3.5 诊断标准[9]
参照文献中大鼠细菌性肺炎模型诊断标准,本次试验小鼠肺炎模型的判定标准确定为
(1)出现行动缓慢、毛色暗淡、摄食饮水量减少等;(2)肺组织增重;(3)诱导→给药组,肺组织增重即视为耐药性产生。
1.4 统计学方法
2 结果
2.1 低浓度左氧氟沙星对PA(1×109 cfu/mL)单次感染小鼠肺炎模型的作用
2.1.1 状态观察

图1 低浓度左氧氟沙星对PA(1×109 cfu/mL)单次感染小鼠体重变化Figure 1 Weight changes in the single PA infection mice (1×109 cfu/mL) plus a low-dose levofloxacin
各组小鼠感染前一般状态正常。第2天,模型组1、模型组2、左氧氟沙星组2小鼠表现出蜷缩聚集、行动缓慢、毛色暗淡、部分小鼠眼眶可见分泌物,摄食摄水量减少;左氧氟沙星组1小鼠毛色暗淡、行动缓慢、摄食摄水量减少。第3天,模型组1、模型组2、左氧氟沙星组2小鼠毛色暗淡、行动缓慢、聚集现象不明显,摄食摄水量增加;左氧氟沙星组1小鼠毛色暗淡、摄食摄水量增加。第4~7天各组小鼠逐渐恢复,一般状态与正常组小鼠相似。正常组小鼠在实验过程中一般状态无明显变化。
2.1.2 体重观察
在试验周期内,正常组小鼠体重每天均有增长;各感染组小鼠体重呈现 “V”型趋势,体重值与正常组比较无显著性差异;于第3天,各感染组小鼠体重逐渐增长,增长趋势基本一致;至第7天,感染组小鼠体重值基本达到正常小鼠体重水平。结果如图1所示。

表1 低浓度左氧氟沙星对PA(1×109 cfu/mL)单次感染小鼠肺炎模型的作用Table 1 Effect of a low-dose levofloxacin and single PA infection on the mice with pneumonia (1×109 cfu/mL)
注:与正常组比较,##P<0.01。
Note. Compared with the normal group,##P<0.01.
2.1.3 肺指数检测
各感染组小鼠肺指数均有不同程度的增高,其中模型组1、模型组2肺指数与正常组比较,均有显著性差异(P<0.01);左氧氟沙星组1肺指数与各组比较,均无显著性差异;左氧氟沙星组2与模型组2比较,结果无显著性差异。结果如表1所示。
2.2 低浓度左氧氟沙星对PA(1×1010 cfu/mL)单次感染小鼠肺炎模型的作用
2.2.1 状态观察
各组小鼠感染前一般状态正常。第2天,感染组小鼠皆表现出蜷缩聚集、行动缓慢、毛色暗淡、部分小鼠眼眶可见分泌物,摄食摄水量减少。第3天,感染各组小鼠毛色暗淡、行动缓慢、摄食摄水量不明显;左氧氟沙星组2小鼠毛色暗淡、摄食摄水量增加。第4~7天各组小鼠逐渐恢复,左氧氟沙星组1、2小鼠恢复迅速,至第7天,一般状态与正常组小鼠相似。正常组小鼠在实验过程中一般状态无明显变化。
2.2.2 体重观察
图2结果显示:在试验周期内,正常组小鼠体重每天均有增长;各感染组小鼠体重呈现先下降后增长的趋势:于第二天体重明显下降(或者增长缓慢),体重值与正常组比较无显著性差异;于第三天,各感染组小鼠体重逐渐增长,增长速度各不相同,其中左氧氟沙星2组小鼠体重增长速度相对较快;至第七天,左氧氟沙星组1、2小鼠体重值基本达到正常小鼠体重水平。
2.2.3 肺指数检测
表2结果显示:各感染组小鼠肺指数均有不同程度的增高;模型组1和模型组2与正常组比较,结果均有显著性差异(P<0.01)。左氧氟沙星组1、2肺指数结果与模型组比较,均有显著性差异(P<0.05,P<0.01);左氧氟沙星组3与模型组2比较,结果无显著性差异。
2.3 低浓度左氧氟沙星对PA重复感染小鼠肺炎模型的作用
2.3.1 状态观察
实验第1~4天,各组小鼠一般状态表现与实验低浓度左氧氟沙星对PA(1×109cfu/mL)单次感染中小鼠第1~4天表现相似。第5天各感染组小鼠摄食摄水量减少、行动缓慢、毛色暗淡,但较第一次感染后状态相对较好。第6~7天,感染组小鼠一般状态迅速恢复,与正常组小鼠相似。正常组小鼠在实验过程中一般状态无明显变化。
2.3.2 体重观察
图1结果显示:正常组小鼠体重在试验周期内,每天均有增长;各感染组中,左氧氟沙星组1小鼠体重较正常组比较,增长趋势相似;其他各组小鼠体重整体均呈现“W”型增长趋势:第一次感染后,于第二天体重均有下降,于第三天,各组小鼠体重逐渐增长,结果与正常组比较均无显著性差异。各组小鼠第二次感染后,左氧氟沙星组1小鼠体重较正常组比较,呈现增长趋势;其余各组小鼠,体重均有所下降。于第六天,各组小鼠体重逐渐增长,结果与正常组比较均无显著性差异。
2.3.3 肺指数检测
表5结果显示,各感染组小鼠肺指数均有增高;模型组1和模型组2与正常组比较,均有显著性差异(P<0.01)。左氧氟沙星组1与模型组1比较,结果有显著性差异(P<0.01);左氧氟沙星组2与模型组2比较,结果无显著性差异。

表2 低浓度左氧氟沙星对PA(1×1010 cfu/mL)单次感染小鼠肺炎模型的作用Table 2 Effect of a low-dose of levofloxacin on the mice after single PA infection (1×1010 cfu/mL)
注:与正常组比较,##P<0.01。与模型组比较,*P<0.05,**P<0.01。
Note. Compared with the normal group,##P<0.01. Compared with the model group,*P<0.05,**P<0.01.
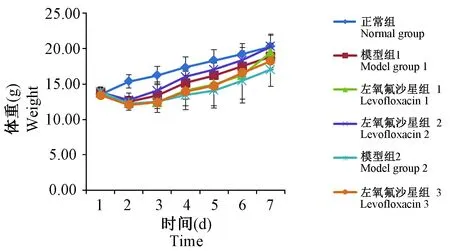
图2 低浓度左氧氟沙星对PA(1×1010 cfu/mL)单次感染小鼠体重变化Figure 2 Effect of a low-dose of levofloxacin on weight changes in mice with single PA infection (1×1010 cfu/mL)
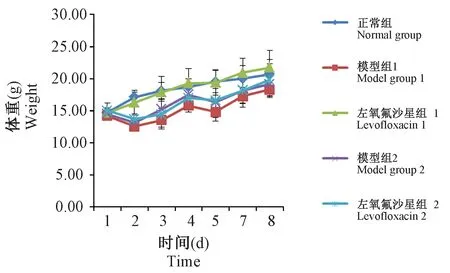
图3 低浓度左氧氟沙星对PA重复感染小鼠体重变化Figure 3 Effect of a low-dose of levofloxacin on weight changes in mice with repeated PA infection

表3 低浓度左氧氟沙星对PA重复感染小鼠肺炎模型的作用Table 3 Effect of a low-dose of levofloxacin on the mice with pneumonia receiving repeated PA infection
注:与正常对照组比较,##P<0.01。与模型组比较,**P<0.01。
Note. Compared with the normal group,##P<0.01. Compared with the model group,**P<0.01.
3 讨论
铜绿假单胞菌(PA)是医院感染的重要条件致病菌[10-11],尤其易发生ICU 病房和老年人肺部感染[12],而对该菌的致病性和耐药性的研究,理想的动物模型是研究基础。PA属于致病力低而抗药性较强的一种杆菌[13],可从淡水和土壤中分离[4],广泛分布于肠道、皮肤及呼吸道[14-15]。近些年,PA 肺炎发病率呈不断升高趋势[16]。左氧氟沙星是一种临床广泛应用的氟喹诺酮类药物[17],对PA具有良好的抗菌活性。部分监测数据表明,PA对氟喹诺酮类药物的耐药性现状仍需重视[18]。左氧氟沙星为氟喹诺酮类药物之一[19],具有口服生物利用度高、半衰期长、不良反应小等特点,主要通过抑制细菌的 DNA旋转酶发挥抗菌作用[20]。左氧氟沙星对多数肠杆菌科细菌,有较强的抗菌活性[21]。但随着细菌耐药现象的加剧,耐左氧氟沙星PA也成为临床常见菌株[22]。同时,结合文献检索结果,细菌感染模型的构建,体外多涉及抗生素刺激诱导细菌耐药性产生、耐药基因表达变化等[23-24];体内感染研究多涉及到囊性纤维化模型、烧伤模型等[25]。因此,本次试验旨在探讨左氧氟沙星诱导致PA感染小鼠肺炎耐药模型的建立方法。
小鼠对多种病原体具有易感性,常用来研究微生物及寄生虫对机体的感染途径、发病机制及综合防治。实验中以小鼠肺炎模型为基础[8],通过不同的给药方法、不同感染次数,模拟不合理用抗生素而致药效降低甚至无效的临床问题。通过组间对照比较分析,以体重和肺指数为评价指标,旨在探讨一种简单而可行的实验方法,实验共涉及三部分:①低浓度左氧氟沙星对PA(1×109cfu/mL)单次感染小鼠肺炎模型的作用中,结果可推测出PA感染可致小鼠肺部感染;同时左氧氟沙星组2与模型组2比较结果无显著性差异,提示低剂量左氧氟沙星干预,对于该模型小鼠的有效治疗产生了影响;结合左氧氟沙星组1小鼠肺指数与各组比较均无显著性差异,猜测该条件下PA感染的浓度稍低,或者在该实验条件下左氧氟沙星的治疗剂量稍低。②在上述实验结果的基础上,增高PA感染菌液的浓度,并适当提高左氧氟沙星的治疗剂量进行实验。低浓度左氧氟沙星对PA(1×1010cfu/mL)单次感染小鼠肺炎模型的作用中,结果显示该条件下PA感染小鼠成功;左氧氟沙星组1、2均能显著性降低模型组肺指数,表明该方法下左氧氟沙星产生了有效治疗作用;结合左氧氟沙星组3与模型组2比较结果无显著性差异,提示低剂量左氧氟沙星干预,对于该模型小鼠的有效治疗产生了影响。进而推测低浓度左氧氟沙星可致PA感染小鼠肺炎模型对左氧氟沙星耐药性产生。③进一步优化实验方法,以低浓度菌液重复感染小鼠,结果显示:该条件下PA感染小鼠成功。左氧氟沙星组对模型小鼠产生了有效治疗作用;而左氧氟沙星组2结果提示低剂量左氧氟沙星干预,对于该模型小鼠的有效治疗产生了影响。该实验提示,低浓度左氧氟沙星可致PA感染小鼠肺炎模型对左氧氟沙星耐药性产生。此外,各试验中小鼠体重监测结果中各组小鼠感染PA后,第二天体重较正常组比较虽无显著性差异,但均有下降趋势, 表明PA肺炎模型小鼠感染成功可以参考体重数据。
综合以上信息分析,小鼠滴鼻感染致细菌肺炎模型操作简单,在此条件下通过左氧氟沙星不同给药量和给药方式的作用,实验低浓度左氧氟沙星对PA(1×1010cfu/mL)单次感染小鼠、低浓度左氧氟沙星对PA重复感染小鼠中,动物模型可在一定程度上模拟临床中耐药产生的现象。但本次实验中评价指标相对单一,后续试验中应注重实验动物生理病理状态,以及相关机制的研究。
