应用季节性流感病毒H3N2鼠适应株建立小鼠模型
2019-06-27李枫棣戚菲菲王顺意王冠澎徐艳峰鲍琳琳
姜 静,吕 琦,李枫棣,戚菲菲,王顺意,王冠澎,徐艳峰,鲍琳琳
(中国医学科学院北京协和医学院医学实验动物研究所,北京 100021)
流感病毒(influenza virus)是引起人和动物传染病流行最重要的病原体之一,目前已经在世界上导致五次人群中的大规模流行。自1918年西班牙H1N1流感大流行后,1957年亚洲H2N2、1968年香港H3N2、1977年俄罗斯H1N1及2009年墨西哥H1N1流感大流行相继出现,造成人力、物力等资源的巨大损失,其中仅在1968~1969 年香港H3N2流感大流行中就有约100 万人被夺去了生命[1-3]。H3N2自1968年香港大流行以来,几乎每年均以季节性流感的形式在我国频繁出现[4-6],是我国季节性流感的主要病毒株,已成为疫苗备选株的重要筛选对象。随着H3N2亚型流感病毒在人群中不断的进化、变异,预防流感或流感严重并发症的疫苗至今也已更新三十余次[7-9]。与以往相比,近年来H3N2发生了较大变异,导致被感染人的数量显著增多、症状明显加重[10-13],亟需开展研发相应的治疗药物、疫苗等流感疫情应对工作。
BALB/c小鼠是流感病毒致病性与疫苗研究常用的动物模型之一[14-16]。季节性流感病毒H3N2并不能直接感染小鼠,国际上大多采用建立鼠适应株、反向遗传学技术构建整合毒株的方式建立小鼠模型[17-23],目前国内还未建成H3N2流感病毒适应株[24-25]。面对国内目前不断出现突变的H3N2流感病毒,新型疫苗株筛选、有效性评价急需H3N2动物模型。本文通过筛选合适的H3N2流感病毒株建立H3N2鼠适应株,并应用其建立小鼠模型,将为疫苗株筛选、疫苗和抗体有效性评价提供合适的研究工具,为季节性流感防控提供有力的实验室支撑。
1 材料和方法
1.1 实验材料
SPF级雌性BALB/c小鼠60 只,4~6 周龄,体重13~15 g,购自北京维通利华实验动物技术有限公司[SCXK(京)2016-0006]。所有的感染实验均在动物生物安全二级实验室(ABSL-2)中进行,所有操作经中国医学科学院北京协和医学院医学实验动物研究所伦理委员会审核并批准(BLL18004)。实验动物的使用遵循3R原则。
季节性流感病毒A/Aichi/2/68(H3N2)(WT),由香港大学陈鸿霖教授惠赠。H3N2鼠适应株(MA-7)由本实验室在BALB/c小鼠体内7 次适应获得。
1.2 实验方法
1.2.1 动物分组
4~6 周龄雌性BALB/c小鼠随机分成2 组,每组30 只,设立WT组(对照组)和MA-7组(实验组),分别用A/Aichi/2/68(H3N2)WT和鼠适应株(MA-7)滴鼻感染小鼠,感染剂量为每只106TCID50。在感染后第1、2、3、5、7和第9 天,每个时间点处死3 只小鼠,取肺、心、肝、脾、肾、肠、脑、眼、气管组织,用于病理检查、病毒载量和病毒滴度的检测。
1.2.2 病毒载量测定
提取组织的总RNA,进行探针法荧光定量PCR (Rea1-time PCR)检测。上、下游引物序列为:InfA-Fwd 5’-GACCGATCCTGTCACCTCTGAC -3’,InfA-Rev 5’- AGGGCATTCTGGACAAAGCGTCTA -3’, InfA-Prb5’FAM-TGCAGTCCTCGCTCACTGGGCACG -BHQ1-3’。Real-time PCR反应条件为:50℃ 30 min;95℃ 15 min;94℃ 15 s,60℃ 45 s,35 个循环。
1.2.3 滴度测定
将组织匀浆接种于单层MDCK细胞中,37℃孵育1 h,PBS洗1遍,补充等体积的病毒培养液,72 h后收集细胞上清,加入火鸡血进行复检。利用Reed-Munch公式计算组织细胞半数感染量(TCID50)。
1.2.4 组织病理学检查
将小鼠的肺、心、肝、脾、肾、肠、脑、眼、气管组织进行标本制备,制备方法采用甲醛固定、石蜡包埋、切片,H.E和免疫组织化学染色。免疫组化使用NP单克隆抗体(1∶1000稀释),4℃过夜,PBS洗;加二抗(1∶1000稀释),室温孵育,PBS洗; DAB显色,苏木素衬染后脱水、透明、中性树胶封片。
1.2.5 基因组测序和比对
合成流感病毒8 个基因片段的PCR引物,对WT和MA-7的8 个基因片段进行高保真PCR扩增。PCR产物纯化和测序后使用DNAStar软件包进行序列拼接及比对。
2 结果
2.1 小鼠一般状态和死亡情况
WT组小鼠感染后,无明显症状变化,14 d内无小鼠死亡。MA-7组小鼠感染后,出现弓背、竖毛、活动迟缓、体型消瘦,第4天开始出现死亡,直至第9 天全部死亡。具体死亡情况见图1。
2.2 小鼠体重变化
WT组小鼠感染后,小鼠体重持续上升,体重上升率最高可达14%。MA-7 组小鼠感染后第1天体重下降,一直持续至感染第9 天(小鼠全部死亡)逐渐下降,体重下降率峰值达到30%。小鼠感染后体重变化率见图2。
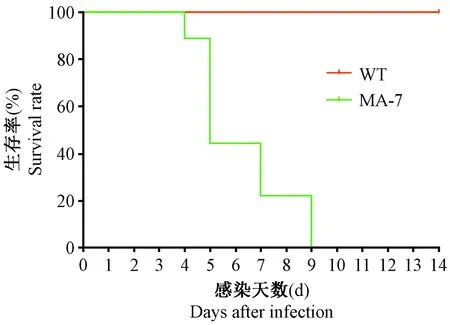
图1 鼠肺适应株小鼠模型的死亡情况(n=10)Figure 1 The survival rate in the mice inoculated with WT and MA-7 virus

注:(a)图中9组bar依次代表小鼠感染鼠肺适应株(MA-7)后心、肺、气管、脾、肾、肠、脑、眼、肝的病毒载量;(b) 图中9组bar依次代表小鼠感染鼠肺适应株(MA-7)后心、肺、气管、脾、肾、肠、脑、眼、肝的病毒滴度。图3 鼠肺适应株小鼠模型各组织的病毒复制(n=3)Note. (a) The viral load in tissues of the mice infected with MA-7 virus. (b) The viral titer in tissues of the mice infected with MA-7 virus.Figure 3 Viral replication curves in tissues of the mice infected with MA-7 virus

图2 鼠肺适应株小鼠模型的体重变化(n=10)Figure 2 The loss of body weight in the mice inoculated with WT and MA-7 virus
2.3 病毒在各组织中复制动态变化
在小鼠感染后第1~9 天,检测MA-7组小鼠的肺、心、肝、脾、肾、肠、脑等组织内的病毒复制情况,用于明确病毒复制的组织器官,并监测其复制动态变化,确定复制高峰期。结果显示,肺、气管、心、肝、肾均能检测到病毒复制,其中以气管和肺组织为主。MA-7组小鼠感染后,在第1~9 天均可在肺组织内检测到病毒复制,第2~5天为复制高峰期,最高可达到105.5TCID50。病毒在气管中的复制能力低于肺组织,最高可达105.2TCID50,其可能与两者的细胞表面受体分布特点相关。心、肝、脾、肾、肠、脑、眼组织均能检测到病毒RNA,肝、肾组织在小鼠感染后第1~9 天间断性地检测到有病毒复制,其余组织均检测不到。以上结果说明H3N2病毒复制只发生在呼吸系统中。具体结果如图3所示。
2.4 小鼠模型的肺组织病理变化
MA-7组小鼠感染后可在肺、气管、心、肝、肾组织内可检测到病毒复制,因此进一步比对病毒入侵的这些组织脏器中引起的病理改变。检测结果显示,气管、心、肝、肾组织均无明显的病理变化。肺组织HE结果显示,在感染后第1~5 天内,随着感染天数增加,肺组织病变严重程度增大。在感染后第1天,局部肺泡间隔轻度增宽,少数支气管上皮细胞变性坏死;在感染后第3天,肺泡间隔明显增宽,支气管上皮细胞变性坏死,肺泡内可见少量炎细胞渗出,血管周围水肿,少量出血;在感染后第5天,肺组织呈现病毒性间质肺炎,肺泡间隔增宽程度增加,部分区域肺泡腔消失,炎细胞浸润,肺泡内可见较多的炎细胞及浆液纤维素渗出,支气管上皮细胞变性坏死,血管扩张充血;在感染后第7天,肺组织病变略有减轻。免疫组织化学结果显示,在感染后第1~5 天内,抗原颗粒随着感染天数呈现增加的趋势。
2.5 基因比对
测序分析结果显示,MA-7 基因序列共检出5 个突变位点,分别位于第 1891、550、1447、868 及 1192 位,其中2 个突变发生在 HA 蛋白中(P162Q、N483P),3 个突变分别发生在 NA、PA、NP 蛋白中(V398I、 G631S、D290 N), 引起氨基酸残基序列改变。具体结果如表1所示。
3 讨论
抗流感病毒的药物、疫苗和抗体评价以及新发流感病毒的致病性方面的研究都需要合适的动物模型,流感动物模型是药物转化应用的必不可少的技术支撑。而近年来H3N2流感病毒不断变异产生新的毒株,疫苗保护效果不理想,需要不断提供新的疫苗株,同时也需要更有效的抗病毒药物;而H3N2流感病毒,野生毒株不能直接感染小鼠[24-26],没有合适的动物模型对于进行一些疫苗评价和药物评价是一个巨大的问题。本研究是应用H3N2流感病毒小鼠适应株建立相应的模型。前期曾应用5株病人分离到的H3N2流感病毒建立小鼠适应株,经过20代左右适应,但病毒不能在小鼠体内复制。另外其他研究机构[27]将H3N2流感病毒(A/Anhui/137/2008)在BALB/c小鼠体内传代40次,也未能构建H3N2的适应株。本次实验应用毒株A/Aichi/2/68(H3N2),通过在BALB/c小鼠体内多次适应,期间通过不断优化组织的处理、病毒的富集方法,连续传至7代后获得敏感的鼠适应株(MA-7),并在此基础上成功建立了小鼠模型。以上结果说明并不是所有H3N2流感病毒通过多次循环能够获得小鼠适应性,并在小鼠体内复制。本次构建的H3N2适应株小鼠模型可用于H3N2流感病毒发病机制及其相应的药物、疫苗、抗体评价等方面的研究。
MA-7(H3N2适应株)可导致小鼠在感染后9天内死亡,与野生毒株相比致病力显著提升。实验人员进行序列分析发现这种致病力的差异来自于病毒分子序列的改变。结果显示,MA-7在HA、NA、PA、NP蛋白中出现了5个氨基酸突变,其中2个突变发生在HA蛋白中(P162Q、N483P),3个突变分别发生在NA、PA、NP蛋白中(NA-V398I、 PA-G631S、NP-D290 N),各位点的突变均未有报道。初步分析MA-7的基因多态性突变是致病力发生显著性提升的分子基础。上述突变位点的功能确认还需通过反向遗传学构建相应的突变毒株,逐个鉴定其功能。
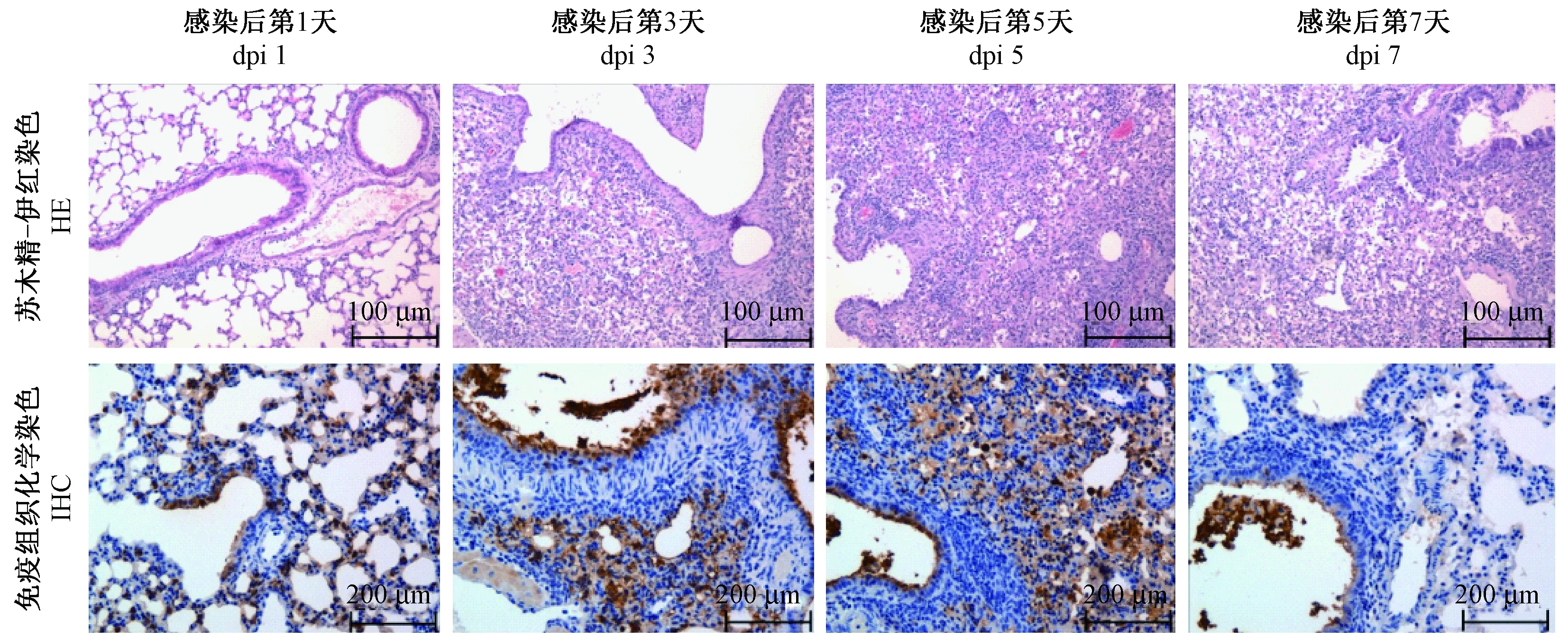
注:上行显示的是4周龄雌性BALB/c小鼠在感染鼠适应株后肺组织HE(100倍)染色结果;下行显示的是BALB/c小鼠在感染鼠适应株后肺组织IHC(200倍)染色结果。图4 流感病毒小鼠肺组织病理切片(HE,IHC)(n=3)Note. The upper line shows the results of the lung tissue HE staining of mice at 1,3,5 and 7 days after infection with MA-7 virus. The upper line shows the results of the lung tissue IHC staining of mice at 1,3,5 and 7 days after infection with MA-7 virus.Figure 4 Histological analysis of the lung tissues of the mice infected with MA-7 virus(HE,IHC staining)

病毒VirusPB2PB1PAHANPNAM2&M1NEP&NS1ntaantaantaantaantaa189163155016214474838682901192398WT--GGlyCProAAsnGAspGVal--MA-7--ASerAGlnGAspAAsnAlle--
注:WT: 野生株;MA-7: 鼠适应株; nt, 碱基;aa, 氨基酸。
Note. WT, wild-type. MA-7, mouse-adapted. nt, nucleotide. aa, amino acid.
综上所述,本次研究成功建立了季节性流感病毒H3N2适应株小鼠模型,并发现HA(P162Q、N483P)、NA(V398I)、PA(G631S)、NP(D290 N)5个氨基酸位点突变与其鼠适应株的致病力增强相关,为进一步研究流感病毒鼠肺适应的分子机理奠定了基础。
