尾静脉注射M1细胞构建BALB/c裸鼠髓系白血病模型
2019-06-27徐昊淼李雅竹许亚梅
徐昊淼,李雅竹,程 涓,赵 勇,许亚梅*
(1. 北京中医药大学东直门医院,北京 100700;2.中国科学院动物所,北京 100101)
急性髓系白血病(acute myeloid leukemia,AML)是髓系造血干/祖细胞恶性疾病,可造成骨髓与外周血中原始和幼稚髓性细胞恶性克隆增殖,临床表现为贫血、出血、感染和发热、脏器浸润等症状,如不及时治疗常可危及生命[1],因此探索白血病的发病急机制、寻求有效的治疗手段成为我们研究的重点[2-3]。M1细胞来源于自发性髓系白血病小鼠的骨髓,本研究应用M1细胞构建小鼠白血病模型,通过尾静脉注射的方式,模拟临床白血病累及骨髓和全身播散特点,为探索药物作用机制、筛选评价奠定基础。
1 材料和方法
1.1 实验材料
SPF级BALB/c裸小鼠12只,雌性,5~6周龄,购于北京维通利华实验动物技术有限公司[SCXK(京)2016-0006],体重15~18 g。小鼠于中国科学院动物研究所SPF层流柜中饲养[SYXK(京)-2013-0015],含复合维生素B的标准颗粒饲料,饮水,垫料及一切与鼠接触的物品均经灭菌处理。实验室内温度约为25℃,相对湿度为40%~70%,每日光照时间为12 h,实验前适应性饲养1周。实验方案符合3R原则并通过了北京中医药大学东直门医院实验动物管理和使用委员会(IACUC)审批(2017-39)。
小鼠白血病细胞M1购于上海素尔生物科技有限公司,接种于含有20%胎牛血清的1640培养基的10 cm细胞培养皿中,37℃、5%CO2、饱和湿度条件下的培养箱中培养并传代。
1.2 主要试剂与仪器
台式冷冻离心机(美国Thermo Scientific,型号Sorvall Legend RT),CO2培养箱(德国Heraeus公司),RPMI-1640培养基(北京利维宁生物科技有限公司),胎牛血清(天津康源生物技术有限公司),青霉素和链霉素各100 U/ml(Sigma),流式细胞仪(美国Beckman Coulter公司,型号EpicsXL),Anti-Mouse CD117-APC、Anti-Mouse CD33-PE-Cyanine7(ThremoFisher)。
1.3 实验方法
1.3.1 造模
将BALB/c裸小鼠分为低、中、高剂量组及空白对照组,每组3只。取对数生长期的M1细胞,将细胞悬液浓度分别调至每只1×106个、每只5×106个、每只8×106个,在无菌条件下经尾静脉分别注射入低、中、高剂量组小鼠体内,空白组小鼠经尾静脉注射等剂量的生理盐水。观察各组小鼠在接种M1细胞后的发病情况、体重变化及生存时间。
1.3.2 外周血常规及血涂片的检查
分别于接种前及接种后第10天、第20天、第30天经尾静脉取外周血约0.1~0.2 mL的加入抗凝管中,送至北京中医药大学东直门医院检验科进行血常规检查,并制备血涂片,经吉姆萨-瑞氏染色后,观察细胞形态,计算白血病细胞的比例。
1.3.3 流式细胞技术检测
CD33是髓系细胞分化抗原,临床中CD33在90%以上的急性髓系白血病中都有表达,是急性髓性白血病的治疗靶标[4],而对应的鼠源CD33分布在分化早期阶段的髓系血细胞中,主要在于小鼠骨髓中的粒细胞和巨噬细胞前体中,此外,CD33也在外周血单核细胞上有少量表达,可作为小鼠白血病细胞的标记进行检测[5]。CD117也称为c-Kit,是由c-Kit原癌基因编码的145×103跨膜酪氨酸激酶,能够调节多种生物反应,包括细胞增殖,凋亡,趋化性和粘附[6-7]。c-Kit突变与多种癌症中的肿瘤生长和进展相关,在急性髓系白血病中可见到c-Kit突变[8-9]。经前期实验检测小鼠白血病细胞M1表面抗原CD33+CD117+所占比例在90%以上,故采用CD33+CD117+对模型鼠进行鉴定。
尾静脉外周血。取50 μL外周血加入2 μL肝素抗凝,加入二蒸水9 mL低渗裂解红细胞及血小板20 s,加入1 mL MPBS终止反应,离心后弃上清并加入1 μL CD117-APC、Anti-Mouse CD33-PE-Cyanine7 摇晃混匀,避光37℃孵育30 min后上机检测。
1.3.4 组织病理切片
处死后取小鼠肝、脾、肾固定于4%甲醛中,修整形状后通过梯度酒精法脱去组织中的水分,加入二甲苯使组织透明后进行包埋并切片,切片厚度为2 μm,经HE染色后,观察白血病细胞的浸润程度。
1.4 统计学分析

2 结果
2.1 小鼠生存状况
接种细胞后7~15 d后,模型组小鼠出现皮肤粗糙、暗淡无华、脊背弓起、萎靡少动等表现,到实验后期小鼠逐渐枯瘦、步态不稳,实验进行过程中小鼠均未出现死亡。(图1)
与空白组相比,高剂量组小鼠体重显著下降,低、中剂量组小鼠体重未见明显变化。(表1)
2.2 血涂片及血常规检查
与空白组相比,第30天时,中、高剂量组小鼠外周血白细胞数明显升高,高剂量组最为显著(P<0.05);第30天时,高剂量组小鼠血红蛋白量量较空白组明显降低(P<0.05),且低于其他各组,低剂量组、中剂量组小鼠血红蛋白含量与空白组比较未见明显变化;各组小鼠血小板的比较差异无统计学意义。(表2-4)

图1 小鼠经尾静脉接种M1细胞后生存状态Figure 1 Living state of the miceafter inoculation of M1 cells

表1 BALB/c Nude小鼠各组体重变化(n=3)Table 1 Changes in body weight of the mice in four groups
注:与空白组比较,*P<0.05,**P<0.01。
Note. Compared with the blank group,*P<0.05,**P<0.01.
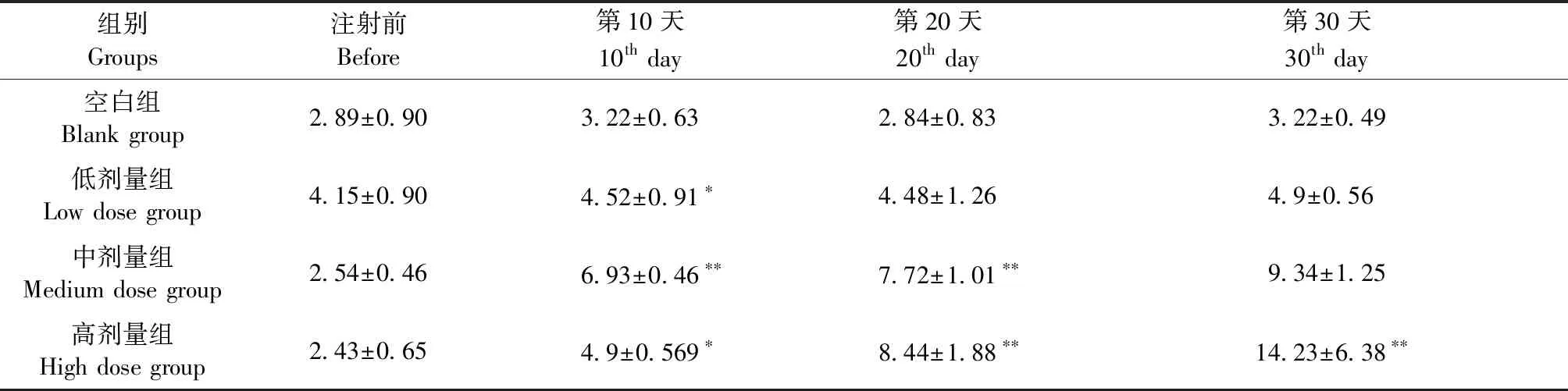
表2 BALB/c Nude小鼠外周血白细胞计数变化(n=3)Table 2 Changes in the peripheral blood WBC counts in mice of the four groups
注:与空白组比较,*P<0.05,**P<0.01。
Note. Compared with the blank group,*P<0.05,**P<0.01.

表3 BALB/c Nude小鼠外周血血红蛋白含量变化Table 3 Changes in HGB of BALB/c Nude mice peripheral blood among five groups
注:与空白组比较,*P<0.05,**P<0.01。
Note. Compared with the blank group,*P<0.05,**P<0.01.

表4 BALB/c Nude小鼠外周血外周血血小板计数变化Table 4 Changes in the peripheral blood platelets counts in mice of the four groups
注:与空白组比较,*P<0.05,**P<0.01。
Note. Compared with the blank group,*P<0.05,**P<0.01.
镜下M1细胞多为圆形或卵圆形,细胞核较大约占面积3/4左右,有多个核仁,细胞质为深蓝色,见图2。造模第20天时,每片计数100个细胞,低、中、高剂量组小鼠外周血均可见到白血病细胞,至第30天时白血病小鼠外周血白血病细胞比例明显增多,高剂量组最为显著。空白组外周血涂片始终未见白血病细胞。(图2-3,表5)

表5 BALB/c Nude小鼠各模型组外周血涂片白血病细胞比例Table 5 Changes of the proportions of leukemia cells in peripheral blood of mice in the two model groups

图2 M1细胞形态(吉姆萨-瑞氏染色,×1000)Figure 2 Cell morphology(Wright-Giemsa staining)

图3 接种M1后小鼠外周血涂片(吉姆萨-瑞氏,×1000)Figure 3 Morphology of leukemia cells in the peripheral blood of mice after MI cell inoculation(Wright Giemsa staining)
2.3 流式表达变化
与空白组比较,造模第30天时,低、中、高三组小鼠外周血及骨髓中CD33+CD117+细胞比例增高,与注射剂量呈正相关。(表6)

表6 BALB/c Nude小鼠各模型组外周血及骨髓中CD33+CD117+比例变化Table 6 Changes of CD33+CD117+ positive proportion of BALB/c Nude mice
注:与空白组比较,*P<0.05,**P<0.01。
Note. Compared with the blank group,*P<0.05,**P<0.01.
2.4 小鼠脏器组织病理学观察
高剂量组小鼠肝脾脏中可见多核肿瘤细胞聚集,核仁清、体积大,为白血病细胞浸润灶;空白组、低剂量组、中剂量组小鼠肝脾中未见明显白血病细胞浸润。
各组小鼠肝脏结构完整,未见白血病细胞浸润。(图5)
2.5 结论
BALB/c Nude小鼠经尾静脉注射8×106个小鼠白血病细胞M1后可构建急性粒细胞性白血病模型,符合急性髓系白血病的生物学特点,高浓度成瘤更快。

图4 小鼠外周血及骨髓流式图Figure 4 Flow cytometric analysis of the mouse peripheral blood and bone marrow cells
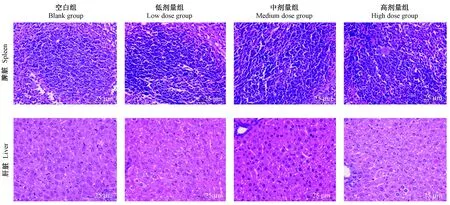
图5 小鼠肝脾组织病理形态(HE染色,×400)Figure 5 Histo pathological changes of the mouse liver and spleen(HE Staining)
3 讨论
前期实验研究中,通过对SCID beige小鼠照射2GyX线预处理,经尾静脉分别接种了1×107个/只、5×106个/只两种不同浓度的HL60、HL60/ADR细胞株,建立了发病时间长,生存期稳定人源性白血病模型[10],本次研究中研究人员采用了鼠源急性髓系白血病M1构建小鼠急性髓系白血病模型,因物种差异小,鼠源细胞相对于人源细胞更容易在小鼠体内生长[11-12]。研究选用BALB/c 裸小鼠作为模型鼠,BALB/c裸小鼠由于无胸腺,不能正常分化T细胞,导致T细胞免疫缺陷,B淋巴细胞正常但功能缺陷,因而为本实验尾静脉造模提供了良好的条件[13-14]。目前建立白血病动物模型的方法有多种,包括尾静脉注射、腹腔注射和皮下注射三种方法[15-17],其中,尾静脉造模白血病细胞可随血液流动全身播散,能更好的模拟临床白血病累及骨髓和弥漫生长特点,贴近临床白血病患者的疾病特点[18-19]。
本次研究采用了每只1×106个、5×106个及8×106个三种浓度,通过接种前及接种后第10天、第20天、第30天后对动物模型的形态学、分子免疫学和组织病理学检测对比发现,高浓度组发病更快,外周血白血病细胞比例均升高明显,更有利于小鼠成模,这与课题既往造模结果相一致[20],为后期药物干预实验提供了良好的模型基础。
