黄芪注射液调节PI3K/AKT通路改善心肌梗死后心肌重塑
2019-06-27崔新明于芷懿关凤英
刘 芬,崔新明,徐 佳,于芷懿,关凤英
(吉林大学基础医学院, 长春 130021)
心力衰竭是指心肌缺血、心脏负荷增加等初始心肌损伤引起的心肌结构和功能改变,进而导致心室功能下降。心力衰竭的发病率和突发性死亡的危险性都较高[1],因此心力衰竭的药物治疗一直是医学界的研究热点。目前心力衰竭的治疗目标在改善症状的前提下,更期望降低并发症、延长寿命并提高生活质量,故药物治疗不仅需要改善血流动力学参数,还需要逆转(恢复)心脏的病理形态学,如心肌重构。所谓心肌重构,即心肌细胞肥大和非肌细胞增生,并伴有左心室形态结构的变化及机械功能的减退。临床上可见心肌重量、心室容量的增加,以及心室形状的改变。
已有研究表明,凋亡、自噬、炎症及氧化应激 (oxidative stress) 参与了心肌重塑过程[2-5],其中氧化应激中产生的活性氧(reactive oxygen species,ROS)发挥了重要作用。正常情况下,机体的ROS不断地产生,又不断地被抗氧化系统清除,处于动态平衡,使其维持在无害的极低水平[6],并参与生理功能的调节,保护细胞;然而在一定的应激损伤条件下,机体ROS产生过多,或ROS清除不足,动态平衡被打破,导致ROS增多并引起组织细胞氧化损伤的病理过程,被称为氧化应激。故抑制损伤性ROS 的生成而不影响生理水平的ROS产生是治疗和预防心肌重塑的新途径,而非以往临床实验一样采用非特异性抗氧化剂治疗而致使疗效欠佳[7]。目前研究发现,nitroso/redox(亚硝基/氧化还原态)平衡是维持心肌细胞正常功能的重要途径,提高内皮型一氧化氮合酶(endothelial nitric oxide synthase,eNOS)、一氧化氮(nitric oxide,NO)表达为抗心肌功能障碍的有效途径[8]。因此,寻找对ROS及NO/eNOS具有双重调节的药物将是抗心肌重构的新方向。黄芪注射液是由中药材黄芪提取的有效成份而制成,有强心的功效,黄芪注射液用于心力衰竭治疗的临床观察结果显示,其治疗疗效显著[9-10]。研究表明:黄芪可加强心肌收缩力,使左心室舒张期容积及收缩期容积减少,改善心脏功能,并可减轻心肌细胞的损伤,还有扩张冠状动脉、改善心肌血供和心肌代谢的作用,但其抑制心肌重塑及其相关机制尚鲜有报道。本课题组前期研究也已经证实:黄芪注射液具有抗心肌细胞氧化应激作用[11]。另外有研究表明,黄芪甲苷能够激活PI3K/AKT通路在阿霉素诱导心肌损伤中发挥保护作用[12],而PI3K/AKT可以通过磷酸化eNOS而生成NO[13],这为其进一步研究提供了依据。基于上述实验和临床研究背景,本文探究黄芪注射液是否通过激活PI3K/AKT调节eNOS/NO发挥抗氧化作用,从而抑制心肌重塑过程。本研究将首次从氧化还原态平衡角度探讨黄芪注射液治疗心力衰竭的作用机制。
1 材料和方法
1.1 实验动物
清洁级7周龄Wistar雄性大鼠,体重210~240 g,吉林大学基础医学院实验动物中心提供[SCXK(吉)2013-0001],实验在机能实验中心实验室进行[SYXK(吉)2013-0005]。本实验使用的麻醉剂和操作方法均有单位伦理委员会的许可,实验动物饲养使用和处理严格遵循动物福利3R原则和吉林大学基础医学院伦理委员会相关条例要求。批准编号[201851]。
1.2 主要试剂与仪器
黄芪注射液由成都地奥制药厂提供。α肌球蛋白重链(α-MHC)、大鼠N端前脑钠素(NT-PROBNP)、丙二醛(MDA)、一氧化氮(NO)及内皮型一氧化氮合酶(eNOS)、ELISA试剂盒由南京建成生物工程研究所提供;ELISA试剂盒北京中杉金桥生物技术有限公司提供;PI3K(sc-423)、AKT(sc-7938)、p-AKT(sc-7985-R)及GAPDH(sc-293335)大鼠多克隆抗体购自Santa Cruz, eNOS(32027),P-eNOS(9571)多克隆抗体购自Cell Signaling Technology;辣根过氧化物酶偶联羊抗兔抗体北京博奥森生物技术有限公司提供。蛋白印迹电泳系统,Bio-Rad公司;凝胶成像系统,上海天能。
1.3 实验方法
1.3.1 模型制备
麻醉大鼠,固定大鼠,连接PowerLab记录分析系统行监测并记录标Ⅱ正常心电。胸部剃毛,用75%酒精棉球消毒皮肤,荷包穿线,于 3~4 肋间心脏搏动最明显处,用止血钳钝性分离肌层,打开胸腔,剪开心包,轻压右侧胸廓挤出心脏。迅速穿线结扎冠状动脉左前降支后将心脏送回胸腔,荷包缝合。假手术组只穿线不结扎。手术结束后记录Ⅱ导联心电图,以ST段抬高0.2 mV定为造模成功[14]。
1.3.2 实验分组
大鼠随机分为假手术组(Sham)、模型组(Model)、AS-L组(1 mL/kg)、AS-H组(3 mL/kg)组,腹腔注射给药。假手术组:冠状动脉下穿线不结扎,其他各组均结扎冠状动脉前降支;假手术组和模型组给予生理盐水2 mL/kg,给药组结扎后2 h给予AS治疗,随后每日给药一次,连续6周,并记录动物死亡情况。
1.3.3 ELISA测定
给药结束后,大鼠腹腔注射3%戊巴比妥1 mL/kg体重,腹主动脉取血,在4℃下,3000 r/min离心10 min,分离血清备用。按试剂盒说明操作,用酶标仪测定血清MDA、NO、NOS,α-MHC及NT-proBNP含量。
1.3.4 HE染色及Masson染色检测心肌组织病理学变化及纤维化情况
将心肌于结扎处下分成4片心肌,并取左心室下1/3心肌组织,于中性福尔马林中固定,进行石蜡包埋,切片,二甲苯脱蜡,乙醇脱水,封片,进行HE及Masson染色,于光学显微镜下观察。
1.3.5 Western blot方法检测心肌细胞内蛋白表达
组织裂解缓冲液的配制,溶液1∶0.05 mol/L Tris.Cl(pH 7.4),1 mmol/L EDTA, 1% 的Triton X-100,0.3 μmol/L aprotinin,1 mmol/L PMSF,裂解心肌组织并提取蛋白。取120~150 mg在液氮内冻存的心肌组织,于液氮内研磨成粉末后置入一塑料管中,加入1 mL裂解缓冲液悬浮,冰上匀浆3次,每次10 s,超声处理3次,每次5 s,14 000 r/min离心20 min,取上清即为蛋白。
Bradford 法测定蛋白浓度,取40 μg 蛋白进行SDS-PAGE后,电转移至硝酸纤维素膜,用5%脱脂奶粉PBS配制液封闭后,将膜置于含兔抗多克隆抗体(1∶1000 稀释)溶液中,室温摇床反应1 h后再加入HRP 标记的山羊抗兔IgG (1∶3000 稀释),室温轻摇1 h 后, ECLKit 发光。用NIH Image 软件对条带实施扫描,检测各部分蛋白含量。
1.4 统计学方法
2 结果
2.1 黄芪注射液对心肌梗死后大鼠生存百分率的影响
在大鼠心肌梗死6周后,记录其生存百分率,各组结果如图1所示,结果显示AS能够提高大鼠心肌梗死后的生存时间及生存率,但是组间无显著性差异。
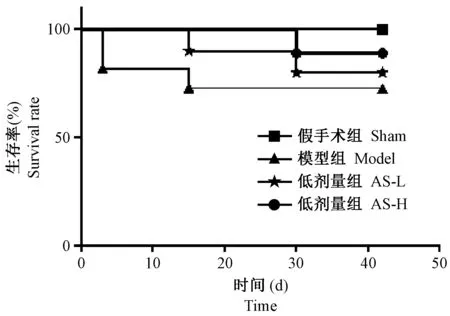
注:各组无显著性差异。图1 黄芪注射液对心肌梗死后大鼠生存率的影响(n=11)Note. There is no significant difference between each two groups.Figure 1 Effect of Astragalus on survival rate of rats at 6 weeks after ligation of the left anterior descending coronary artery
2.2 黄芪注射液对心肌梗死后大鼠α-MHC、NT-proBNP的影响
α肌球蛋白重链(α-MHC)水平与心肌细胞肥大程度成正比,而NT-PROBNP值则主要反映心衰的可能性。与假手术Sham组比较,模型Model组的α-MHC显著升高(P<0.01),AS低剂量组心肌肥大程度较模型组有所减轻,但无显著性差异,而AS高剂量组则显著降低(P<0.05),结果提示适宜剂量AS可抑制心肌肥大。Model组的NT-proBNP较Sham组高(P<0.05),AS低剂量组有所减轻,但无显著性差异,而AS高剂量组则显著降低NT-proBNP(P<0.05), 故适宜剂量的情况下可以减缓心力衰竭的过程。见图2、3。
2.3 黄芪注射液改善心肌梗死后大鼠的心肌损伤及心肌纤维化
由图可见, Sham组可见心肌纤维排列整齐,无胶原纤维增生纤维化,未见炎性细胞浸润及出血;

图4 黄芪注射液对心肌梗死后大鼠组织病理损伤及心肌纤维化的影响(HE及Masson染色)Figure 4 Effects of Astragalus injection on the pathological changes of heart tissues and myocardial fibrosis in rats after myocardial infarction. HE and Masson staining.

注:与假手术组比较,##P<0.01, 与模型组比较,*P<0.05。图2 黄芪注射液对心肌梗死后大鼠α肌球蛋白重链的影响(n=8)Note. Compared with the sham group,##P<0.01. Compared with the model group,*P<0.05.Figure 2 The effect of Astragalus injection on serum α-MHC in the rats after myocardial infarction
Model组可见心肌纤维肥大,排列不规则,可见大量炎细胞浸润、充血及纤维化;ASL组略好于Model组,较Model组炎细胞浸润少、充血少及纤维化略轻;ASH组好于低剂量组,较低剂量组炎细胞浸润少、充血少及纤维化轻。结果显示AS对于大鼠心肌结构损伤及纤维化具有改善作用。见图4。
2.4 黄芪注射液抑制心肌梗死后大鼠的过氧化产物产生并上调NOS
给药8周后,检测各组大鼠血清MDA、NO及eNOS含量。与Sham组相比,Model组大鼠血清中MDA含量显著上升(P<0.001);与Model组相比,AS高剂量组大鼠血清中MDA含量显著降低(P<

注:图中4组bar代表N端前脑钠素,与假手术组比较,#P<0.05, 与模型组比较,*P<0.05。图3 黄芪注射液对心肌梗死后大鼠N端前脑钠素的影响 (n=8)Note. Compared with the sham group, ##P<0.05. Compared with the model group,*P<0.05.Figure 3 Effect of Astragalus Injection on the serum NT-proBNP in rats after myocardial infarction
0.001)。NO及eNOS结果显示,与Sham组相比,两者在Model组血清中的含量略增,但无统计学意义,而AS高剂量组的NO及eNOS含量显著高于Model组(P<0.05)。见图5。
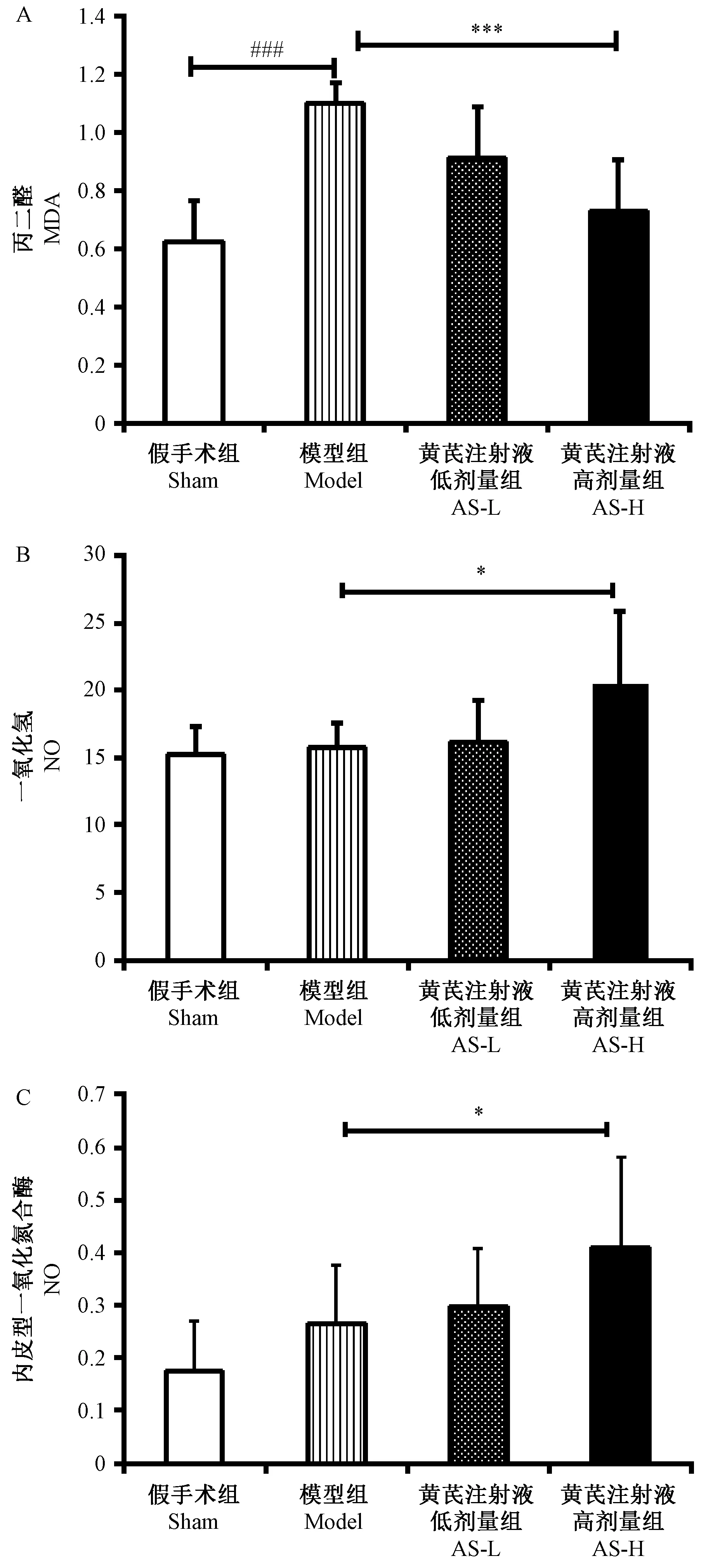
注:与假手术组比较,###P<0.001, 与模型组比较,*P<0.05,*** P<0.001。图5 黄芪注射液对对心肌梗死后大鼠血清中MDA、NO、eNOS的影响(n=8)Note. Compared with the sham group,###P<0.001. Compared with the model group,*P<0.05,***P<0.001.Figure 5 Effects of Astragalus injection on the rat serum levels of MDA, NO, and eNOS after myocardial infarction
2.5 黄芪注射液对PI3K、AKT及凋亡相关蛋白的影响:
采用Western blotting方法检测AS对PI3K及P-AKT的作用,结果显示ASH可显著上调PI3K蛋白表达(P<0.001),AS可显著上调P-AKT蛋白表达(P<0.05)。另外,ASH可以有效上调P-eNOS(P<0.05)的表达。见图6-7。
3 讨论
经过6周黄芪注射液的治疗,心肌梗死后大鼠的生存率。由α-MHC及Masson染色结果可以看出,心肌肥大及纤维化程度减轻,而NT-proBNP 值的降低主要反映心衰的可能性降低,证明黄芪注射液具有抑制心力衰竭、逆转心肌重构的作用。进一步结果表明黄芪注射液可以改善过氧化损伤并上调PI3K、P-AKT及P-eNOS。
PI3K/AKT通路被公认是促进心肌细胞生存的重要途径[15]。PI3K 是二聚体蛋白质,由85×103的调节亚单位和110×103的催化亚单位组成,PI3K 的 p85通过直接与G 蛋白偶联而被活化,也可与生长因子受体或生长因子相关蛋白结合而活化[16]。活化的 PI3K 募集到细胞膜后,其 p110 部位将底物磷脂酰肌醇4, 5-二磷酸催化为磷脂酰肌醇3, 4, 5-三磷酸,PIP3 可作为第二信使传递信号,介导 PI3K的多种生物学功能。PIP3能够将含有 PH结构域的信号蛋白募集到细胞膜表面并使之激活[17]。AKT又称蛋白激酶B,其氨基末端含有普列克底物蛋白同源序列,被认为是与 PI3K 结合的关键部位,结合后使AKT磷酸化并活化。活化的AKT将会转移至细胞质或细胞核内进一步活化下游的靶点,进而调节细胞的生长、增殖与分化[18]。
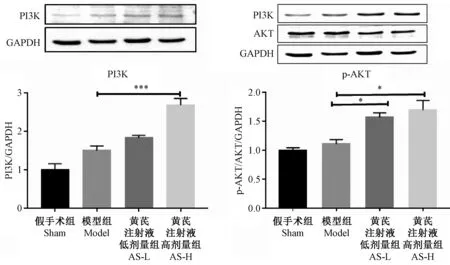
注:与模型组比较,*P<0.05,*** P<0.001。图6 黄芪注射液对心肌梗死后大鼠心肌细胞PI3K及磷酸化AKT的影响(n=4)Note. Bars of the four groups in the figure show the PI3K and P-AKT level.Compared with the model group, *P<0.05,***P<0.001.Figure 6 Effects of Astragalus injection on the serum PI3K and p-AKT levels in cardiomyocytes of rats after myocardial infarction
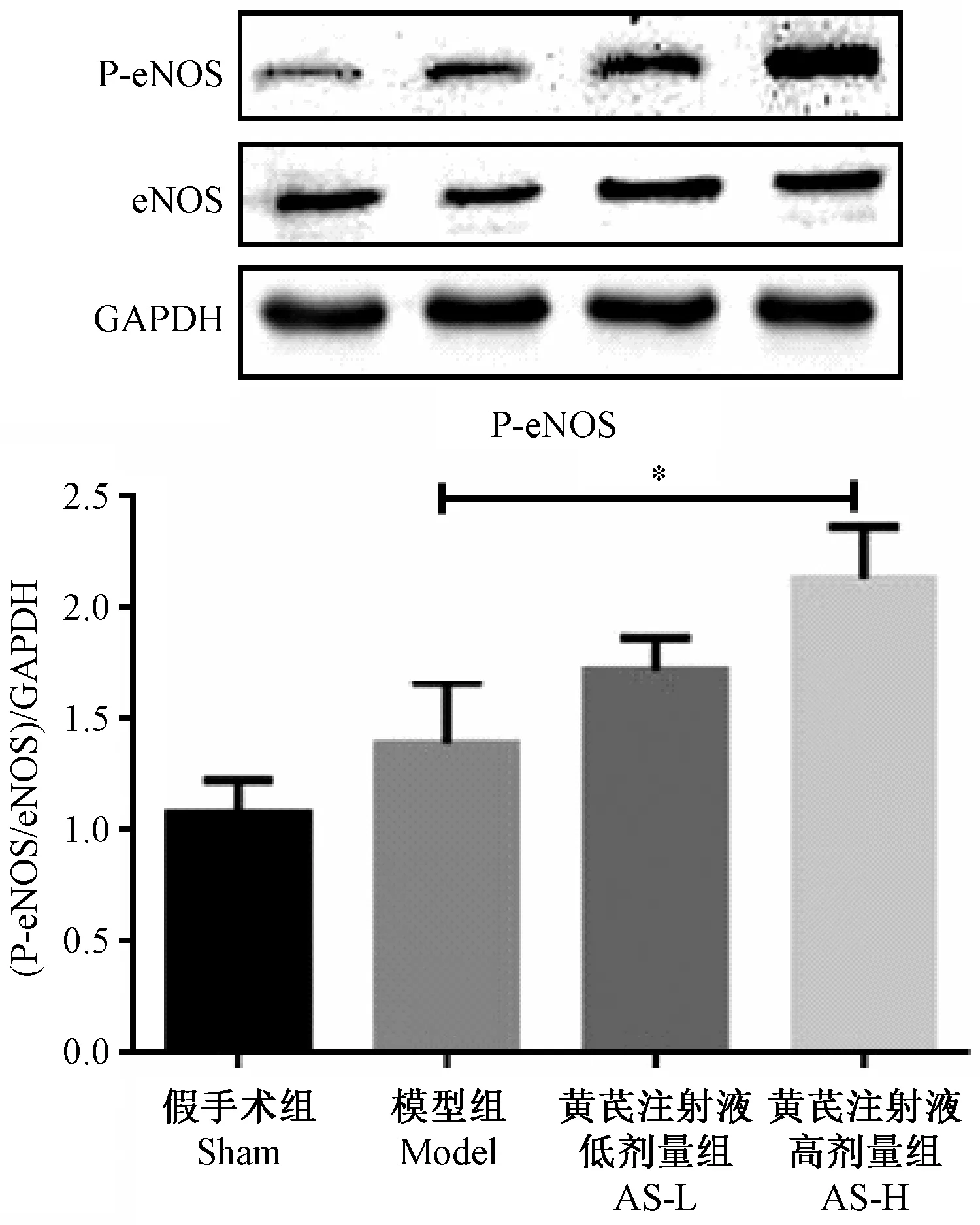
注:图中4组bar代表磷酸化内皮型一氧化氮合酶蛋白水平,其中与模型组比较,*P<0.05。图7 黄芪注射液对心肌梗死后大鼠P-eNOS蛋白的影响(n=4)Note. Bars of the four groups in the figure show the P-eNOS level. Compared with the model group, *P<0.05.Figure 7 Effect of Astragalus injection on p-eNOS protein levels in cardiomyocytes of the rats after myocardial infarction
已有研究表明PI3K/AKT可以通过磷酸化内皮型一氧化氮合酶(endothelial nitric synthase,eNOS)降低过氧化损伤从而抑制心肌重塑[13]。多个研究表明AKT Ser473磷酸化后,再通过eNOS Ser1177磷酸化而活化eNOS[19-22],eNOS可催化左旋精氨酸生成一氧化氮(nitric oxide, NO)。与野生型小鼠相比,eNOS 缺陷小鼠在心梗后将发展为更严重的左心室功能不全和心肌重构[23 ],反之亦然,过表达eNOS使心梗后左心室功能不全程度减轻[24]。然而NO的这种保护作用却在与来自失偶联eNOS形成的氧化应激共存的情况下消失,并反而促进心脏的病理重构。已有实验证明,eNOS基因敲除小鼠在低水平ROS 存在情况下,虽然具有很强的压力负荷,但却只有轻微的向心性肥厚和纤维化,而没有发展为左心室扩张[25]。因为在适宜的ROS存在下,NO是一种负性调控因素,无论内源性还是外源性NO均可抑制AngII诱导的心肌重塑及心肌细胞c-fos的基因表达[26]。以上研究成果证实,激活PI3K/AKT通路可以通过调节eNOS降低氧化应激水平从而抑制心肌重塑。
综上所述,结合本实验结果,说明黄芪注射液的抗心力衰竭、逆转心肌重构的作用其激活PI3K/AKT通路调节eNOS有关,但尚需进一步验证其内在关系。
