豌豆酯酶的纯化和酯酶活性表征及其对农药的敏感性
2019-06-26黄嫒马志强王玮宋燕飞李荣陈强陈祥贵杨潇
黄嫒,马志强,王玮,宋燕飞,李荣,陈强,陈祥贵,杨潇
(西华大学 食品与生物工程学院,四川 成都,610039)
农药的大规模广泛使用虽然促进了农业的发展,但是残留问题也造成了严重安全风险[1]。据统计,中国每年农药中毒人数高达上万人,其中70%以上是有机磷农药中毒[2]。因此采用快速农残检测方法普查食品和环境中的农药残留是农残监管的重要措施,而目前广泛应用的农残快检方法为酶抑制法。与传统的仪器分析方法相比,该类方法具有操作简便、成本低廉、可实现现场检测等优点[3]。在此基础上发展起来的酶生物传感器法则极大地提高了农残快检的自动化水平[4-6]。
由于酶的活性和对农药的敏感度,对于酶抑制法的准确性和检出限十分重要,因此关于酶源的筛选和酶性能的改良一直是研究的热点。目前酶抑制法中常用酶为胆碱酶,包括乙酰胆碱酯酶(AChE,EC3.1.1.7)和丁酰胆碱酯酶(BChE,EC3.1.1.8)两类。但是由于胆碱酶广泛存在于动物组织中,如目前使用的AChE主要提取于电鳗及家蝇、库蚊等敏感昆虫头部,BChE主要提取于马血。然而动物酯酶来源有限,提取过程复杂,产量低,成本高,酶活性不稳定。而植物酯酶具有来源广泛、价格低廉等优点,最近的研究表明,小麦[7-8]、大豆[9-10]和麻风树[11]中的植物酯酶具有与AChE相似的农药敏感性。
豌豆(PisumsativumLinn.),又名寒豆、麦豆、雪豆等,在全球范围内分布广泛,作为植物酶源具有明显成本优势。然而关于豌豆酯酶的制备与纯化研究却鲜有报道,豌豆酯酶的酶学特征和对农药的敏感性也并不明确,这极大地限制了豌豆酯酶在农药检测中的应用。
本研究从豌豆中分离纯化了植物酯酶,通过底物和抑制剂特异性实验对酯酶的类型进行了鉴别。对豌豆酯酶的酶促反应条件进行了优化,并通过有机磷和氨基甲酸酯农药对豌豆酯酶的抑制实验来评估该酶对农药的敏感性。本研究的结果为豌豆酯酶在农药检测中的应用奠定了理论基础。
1 材料与方法
1.1 材料与试剂
豌豆由成都市农林科学院提供,并由成都市农林科学院作物研究所鉴定为蝶形花科植物豌豆(PisumsativumLinn.) 的种子。
α-醋酸萘酯(α-NA)、固蓝B盐、α-萘酚、S-乙酰硫胆碱碘化物(ATChI)、S-丁酰硫代胆碱碘化物(BTChI)、5,5′-二硫双-2-硝基苯甲酸(DTNB)、盐酸多奈哌齐、毒扁豆碱、磷酸双4-硝基苯酯(BNPP)、乐果(纯度≥98%)、毒死蜱(纯度≥95%)、久效磷(纯度≥99%)、辛硫磷(纯度≥95%)、敌百虫(纯度≥99%)、残杀威(纯度≥99%)、三唑磷(纯度≥98%)、氧乐果(纯度≥95%)、敌敌畏(纯度≥99%)、灭多威(纯度≥99%)、涕灭威(纯度≥99%)、克百威(纯度≥99%):Sigma-Aldrich公司。
1.2 仪器与设备
1.3 酶活性测定
在96孔板中,加入50 μL酶液,50 μL磷酸盐缓冲液(20 mmol/L,pH 6.5)和100 μL的α-NA(0.2 mmol/L),混匀并在35 ℃孵育15 min。然后加入100 μL固蓝B盐溶液(2.5 g/L),于酶标仪中在550 nm处测量吸光度[12]。1个酶活性单位(U)被定义为:在标准测定条件下每分钟产生1 μmol的酶反应产物α-萘酚。
1.4 酶的提取和纯化
将新鲜豌豆冷冻干燥并研磨成细粉。将2.00 g豌豆粉加入20 mL的磷酸盐缓冲液(20 mmol/L,pH 5.0)中。将混合物于4 ℃温和振荡过夜,并在4 ℃下8 000×g离心10 min,上清即为粗酶液。粗酶液再通过以下步骤进行纯化:(1)在5 mL Hi-Trap SP HP柱(GE Healthcare)上进行阴离子交换层析。用磷酸盐缓冲液(20 mmol/L,pH 5.0,含有20 mmol/L NaCl)平衡后,将粗酶液上样。用3倍柱体积的磷酸盐缓冲液(20 mmol/L,pH 5.0,含有20 mmol/L NaCl)洗柱。然后用含有NaCl的磷酸盐缓冲液(20 mmol/L,pH 5.0)进行0.02~0.5 mol/L NaCl的线性梯度洗脱,洗脱液在4 ℃下用自动馏分收集器按每管2 mL收集。收集的酶液按峰合并后检测酯酶活性,选择酶活性高的洗脱液进行超滤浓缩。(2)在Superdex 200柱(GE Healthcare)上进行凝胶过滤层析。将浓缩的酶液上样到预先用磷酸盐缓冲液(20 mmol/L,pH 5.0)平衡的柱子上,然后用磷酸盐缓冲液(20 mmol/L,pH 5.0)按0.5 mL/min的流速洗脱。洗脱液按每管1.0 mL收集,洗脱液按峰合并后检测酯酶活性,选择酶活性高的洗脱液冷冻干燥,储存于-20 ℃。
1.5 酶底物和抑制剂的特异性测定
分别采用ATChI、BTChI和α-NA作为底物进行底物特异性实验,并根据DTNB方法[13]进行以ATChI和BTChI为底物的酶活性测定。
分别用毒扁豆碱、盐酸多奈哌齐和BNPP作为抑制剂进行酶抑制剂的特异性实验,并通过测定酶抑制率比较酶抑制剂的特异性。
1.6 酶浓度、温度、pH值对酶活性的影响
为了确定酶反应的最佳酶浓度、温度和pH,分别在不同的酶质量浓度0.25、0.35、0.45、0.70、1.40 μg/mL,温度20、25、30、35、40、45、50 ℃和pH值5.5、6.0、6.5、7.0、7.5下按照1.3提供方法测定酶活性。
1.7 酶动力学参数测定
为确定米氏常数Km和最大酶反应速度Vmax,分别测定底物α-NA在不同浓度(0.010、0.025、0.050、0.100、0.200、0.400、0.600、0.800、1.000 mmol/L)下的酶反应速度(即单位时间内α-萘酚的产生量)。实验结果通过Origin 8.5软件(Origin Lab)直接进行米氏方程的非线性回归拟合,并计算Km和Vmax值。
1.8 农药对酶的抑制率测定
有机磷和氨基甲酸酯类农药对植物酯酶的抑制率测定根据PRUETT等报道的方法[14]并做改进。即在96孔板中,加入50 μL不同浓度(2×10-9~2×10-3mol/L)的农药样品和50 μL酶液(1 mU/mL),混匀并在35 ℃孵育30 min,再通过1.3提供方法测定3 min的吸光度的变化。对照组在反应体系中用50 μL蒸馏水替代农药样品。根据公式(1)计算抑制率:
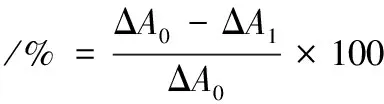
(1)
式中:ΔA0为对照组吸光度变化;ΔA1为样品吸光度变化。用该方法进行农药残留检测时,以抑制率≥50%作为农药被检出的阈值[15]。
根据不同农药浓度对酶的抑制率,参照何绍志等[16]报道的方法,拟合酶抑制曲线方程,计算抑制率为50%时的农药浓度,即为该农药对酶的IC50值。再根据下式计算该酶应用于酶抑制法检测该农药的检出限(LOD),如公式(2)所示。
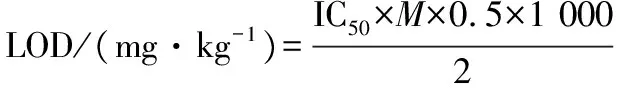
(2)
式中:IC50为该农药对豌豆酯酶的IC50值(mol/L);M为该溶液的摩尔质量(g/mol);0.5为根据国标方法[17]有机提取液挥干后用加入0.5 mL缓冲液定容;2为果蔬样品2.00 g;1 000为1 g等于1 000 mg。
1.9 数据转换和统计分析
所有数据均以3个独立样本(n=3)的(x±SEM表示。采用SPSS 22.0 软件(IBM)进行统计分析,两组之间数据使用Student′st检验进行比较,多组数据通过单因素方差分析后,再使用Duncan检验进行多重比较。以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 豌豆酯酶的纯化
目前已有不同来源的植物酯酶通过如离子交换层析和凝胶层析等方法被纯化和表征(包括小米[18]、拟南芥[19]、麻疯树[11]、燕麦[20]、苹果[21]和西葫芦[22])。但不同来源的植物酯酶其性质也不尽相同。
本研究主要通过Hi-Trap SP HP柱的阳离子交换层析和Superdex 200柱的凝胶过滤层析对豌豆酯酶进行纯化,表现出较好的纯化效果。表1中给出了每个纯化阶段的回收率、纯化倍数和比酶活性。从中可知豌豆酯酶的最终纯化倍数达41倍,回收率为21.6%,比酶活性为0.695 U/mg。从阳离子交换层析的洗脱图(图1-A)可知,有2个蛋白峰被洗脱,峰I具有较高的酯酶活性(图1-C)。收集峰I流分进行凝胶过滤层析,有5个蛋白质峰被洗脱(图1-B),其中峰Ⅶ具有最高的酯酶活性(图1-C)。通过SDS-PAGE确认纯化所得的豌豆酯酶的分子质量和纯度(图1-D)可知,纯化的豌豆酯酶为单一条带。已有的研究发现,大多数植物酯酶具有低分子质量,并含有单一的多肽链,分子质量范围为20~60 kDa[23-25]。从SDS-PAGE中发现,豌豆酯酶的分子量约为26.0 kDa。
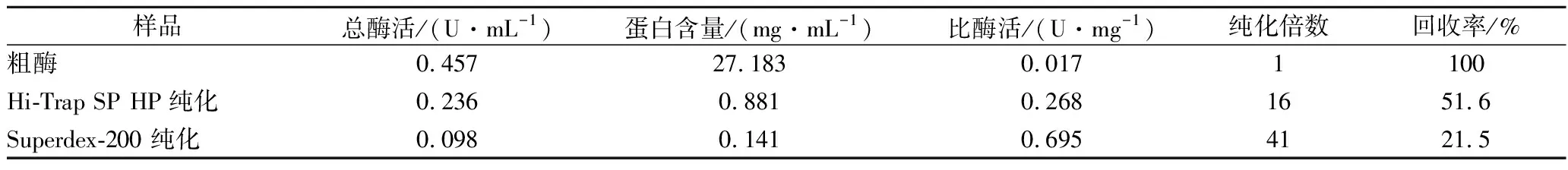
表1 豌豆酯酶纯化效果Table 1 Purification of esterases from pea
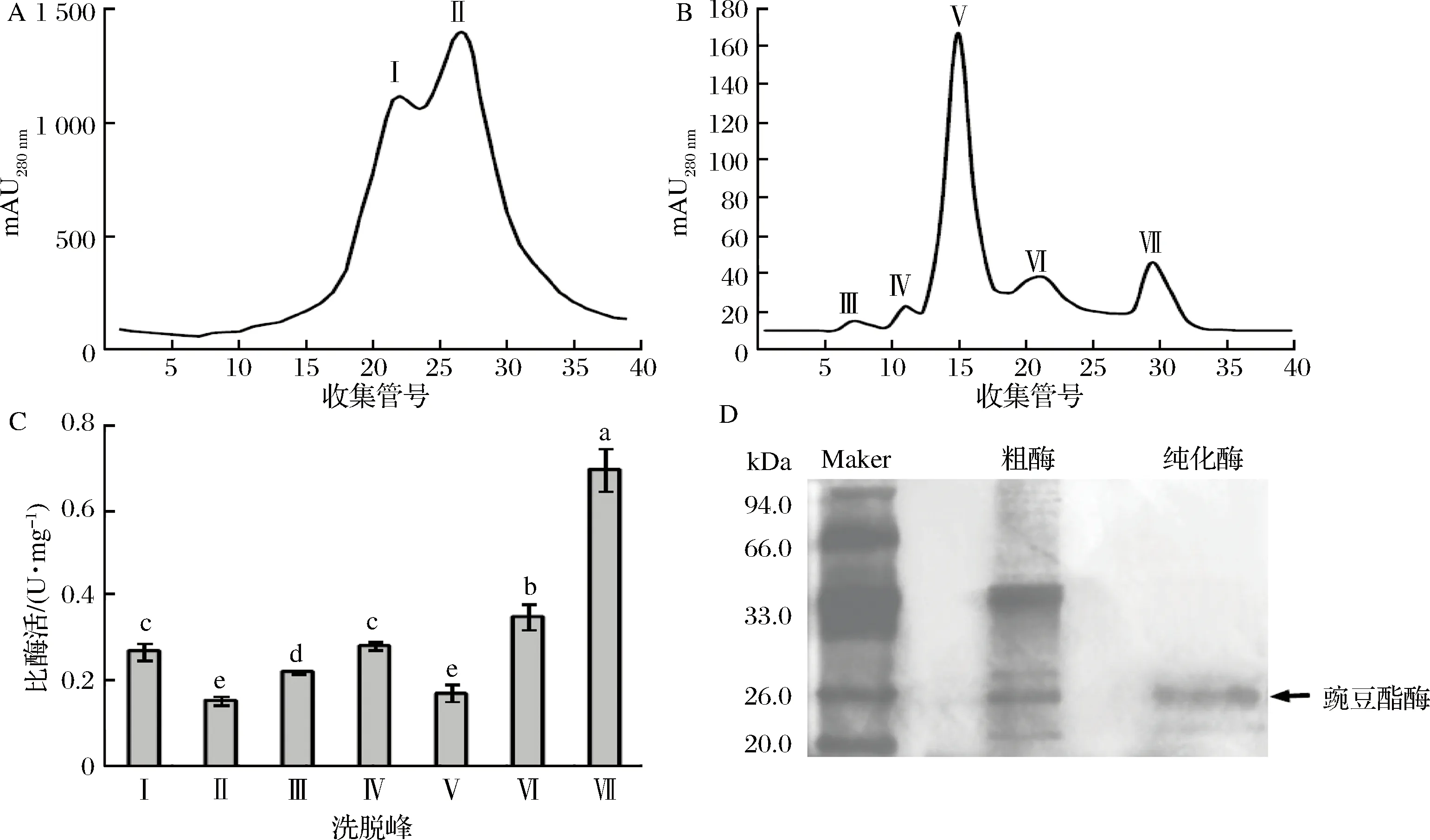
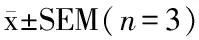
A-Hi-Trap SP HP离子交换色谱的洗脱图谱; B-Superdex 200凝胶过滤层析的洗脱图谱;C-通过离子交换层析和凝胶过滤层析洗脱峰的酯酶活性; D-酯酶粗酶和纯化酶的SDS-PAGE图1 豌豆酯酶的纯化和SDS-PAGEFig.1 Purification and SDS-PAGE of pea esterase注:数据以表示,用不同字母表示各组差异显著,P <0.05。
2.2 豌豆酯酶的分类
酯酶分为羧酸酯酶(EC 3.1.1.1),芳基酯酶(EC 3.1.1.2),乙酰酯酶(EC 3.1.1.6)和胆碱酯酶(乙酰胆碱酯酶,EC 3.1.1.7和丁酰胆碱酯酶,EC 3.1.1.8)。其中只有羧酸酯酶和胆碱酯酶可被有机磷和氨基甲酸酯农药抑制,可用于农药检测。
豌豆酯酶的底物特异性实验发现,底物的活性按α-NA> ATChI> BTChI的顺序降低,且后两者底物几乎无酶活性(图2-A)。因此豌豆酯酶更像羧酸酯酶。在其他豆类[26]、麻风树种子[11]和小米[18]酯酶的底物特异性研究中使用的苯基酯,甘油酯和萘基酯的实验结果也显示,这些酯酶通常优先水解短链酯。这一特异性对植物生长和发育过程中短链脂肪酸酯的水解可能具有重要作用[27]。
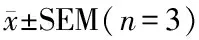
A-对不同底物豌豆酯酶的活性;B-不同抑制剂对豌豆酯酶的抑制率图2 豌豆酯酶鉴定Fig.2 Classification of pea esterase注:数据以表示,用不同字母表示各组差异显著,P<0.05。
为了进一步确认豌豆酯酶的类型,分别采用酯酶广谱抑制剂毒扁豆碱,乙酰胆碱酯酶特异抑制剂盐酸多奈哌齐和羧酸酯酶抑制剂BNPP进行酶抑制实验。酶抑制率按BNPP>毒扁豆碱>盐酸多奈哌齐顺序递减,BNPP抑制率显著高于后两者(图2-B)。由于BNPP已被证明是淡色库蚊[28]和大鼠[23]中的羧酸酯酶特异性抑制剂。因此豌豆酶可被BNPP抑制,却不能被盐酸多奈哌齐[29]抑制的结果,进一步证明了豌豆酯酶可能属于羧酸酯酶类。
2.3 酶质量浓度、pH和温度对酶活性的影响和酶动力学参数测定
从酶浓度实验可知酶浓度对酶促反应有显着影响(图3-A)。随着酶质量浓度的增加,550 nm的吸光度值也增大,呈现浓度依赖性。然而,根据朗伯比尔定律,测定底物浓度的线性范围在吸光度0.2~0.8,所以0.45 μg/mL为最佳酶质量浓度。
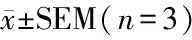
A-不同酶浓度下的酶反应的吸光度;B-不同温度下的豌豆酯酶活性;C-不同pH值的豌豆酯酶活性;D-以α-NA为底物的豌豆酯酶的米氏方程非线性回归曲线图3 酶质量浓度、pH和温度对酶活性的影响和酶动力学参数测定Fig.3 Effects of enzyme concentration, pH and temperature on enzyme activity and enzyme kinetics注:数据以表示,用不同字母表示各组差异显著,P<0.05。
为了优化反应温度,在20~50 ℃测定酶活性。随着温度的升高,酶促反应加速,使酶活性升高,但在高温下酶活可能由于蛋白质变性而受到抑制,该酶的最适反应温度为40 ℃(图3-B)。其他植物酯酶如来源于小米[18]、大戟科植物[25]和西葫芦[22]的酯酶的最适温度也在上述范围内。
pH值也可以显着影响酶活性,每种酶都具有最适的pH范围。在植物酯酶中,小麦[7-8]的最适pH为6.5,黧豆属种子[24]的最佳pH为7.0,小米[18]和大戟科植物[25]的最适pH为7.5。豌豆酯酶在5.5~7.5的pH范围内均显示出活性,但在pH 6.5时观察到最大的酶活性(图3-C)。
米氏常数Km值可近似表征酶与底物的亲和力。根据米氏方程进行非线性回归(图3-D)确定了豌豆酯酶作用于α-NA的Km和Vmax值分别为0.119 mmol/L和9.23 μmol/min。
2.4 豌豆酯酶粗酶和纯化酶的对农药的敏感性
根据酯酶与农药的相互作用,一般将酯酶分为3种类型,A型酯酶不受有机磷农药抑制,却能水解有机磷农药,C型酯酶不水解有机磷农药,也不被有机磷农药抑制[30]。只有B型酯酶很容易被有机磷农药抑制,可用于农药检测。
为了解豌豆酯酶对农药的敏感性,对不同浓度(2×10-9~2×10-3mol/L)的8种有机磷农药和4种氨基甲酸酯农药进行酶抑制率测定。当使用酶抑制法检测农药时,通常以酶抑制率大于或等于50%作为样品中农药被检出的阈值。因此,可以使用IC50值来计算豌豆酯酶用于农残检测的LOD值。表2中列出了豌豆酯酶粗酶和纯化酶的对不同农药的IC50值和LOD值,并将其与不同农药的最大残留限量值(MRL)[31]进行比较。
从表2中可知,纯化后的豌豆酯酶IC50值均小于粗酶,这意味着对农药的检测灵敏度显著提高。通过纯化使得豌豆酯酶对一些农药的检出限达到MRL。然而,仍有2种有机磷农药(久效磷,毒死蜱)的检出限高于其MRL,说明豌豆酯酶对不同类型农药的敏感性差异较大。该结果表明,豌豆酯酶(B型酯酶)可以代替AChE用于酶抑制法检测有机磷农药和氨基甲酸酯农药。
3 结论
本研究从豌豆中提取的植物酯酶通过阳离子交换层析和凝胶过滤层析被纯化。通过底物和抑制剂特异性实验将豌豆酯酶鉴定为羧酸酯酶。豌豆酯酶在酶浓度为0.45 μg/mL,缓冲液pH 6.5和反应温度40 ℃时,具有最好的催化活性。有机磷和氨基甲酸酯农药可抑制豌豆酯酶活性。这表明豌豆酯酶属于B型酯酶,因此可以代替AChE,用于酶抑制法检测有机磷和氨基甲酸酯类农药残留。经过纯化的豌豆酯酶通过酶抑制法检测农药的LOD值显著低于粗酶,满足大多数农药MRL检测的要求。
