胶红酵母Rhodotorula mucilaginosa CICC 33013胞外多糖的分离纯化及抗氧化活性研究
2019-06-26马文锦李梅林王博张永显于长青班省华
马文锦,李梅林,王博,张永显,于长青,班省华
(甘肃省轻工研究院有限责任公司,甘肃 兰州,730030)
胶红酵母(Rhodotorulamucilaginosa)是酵母种属的1种,属子囊菌门/隐形酵母科/红酵母属,是单细胞真核生物,在土壤、水和空气中均有存在。酵母胞外多糖(YEPS)是酵母细胞在生长代谢过程中分泌到细胞壁外,常渗于培养基的一类糖类化合物[1],具有潜在的抗氧化,抗凝血,抗血栓和抗病毒活性,可用于生产有机体免疫调节剂,具有广阔的市场前景。迄今为止,已经报道了几种酵母可以产生胞外多糖,其中包括:隐球菌属(Cryptococcus)[2],汉逊酵母属(Hansenula)[3],油脂酵母属(Lipomyces)[4],短梗霉属(Aureobasidium)[5]和胶红酵母属(Rhodotorula)[6]。目前,国内外对细菌胞外多糖和一些大型真菌胞外多糖的研究较多,而对酵母胞外多糖的菌株筛选、多糖的结构解析和功能活性研究较少,尤其是胶红酵母菌,属于空白。
本文以胶红酵母菌株R.mucilaginosaCICC 33013为研究对象,通过分离纯化得到胞外多糖单一纯品,并对其抗氧化活性做了初步研究。
1 材料与方法
1.1 材料
1.1.1 材料与试剂
胶红酵母菌株由中国典型培养物保藏中心提供;抗坏血酸、乙醇、三氯乙酸(分析纯),天津市天力化学试剂有限公司;酵母浸膏、蛋白胨(生物试剂),北京双旋微生物培养基制品厂;琼脂粉(生物试剂),北京奥博星生物技术有限责任公司;1,1-二苯基-2-三硝基苯肼(DPPH),安徽酷尔生物工程有限公司;ABTS,合肥博美生物科技有限责任公司。DEAE纤维素(DE-52),北京华中海威基因科技有限公司;葡聚糖凝胶(G-100),北京满仓科技有限公司。
1.1.2 仪器与设备
CT15RT高速冷冻离心机,上海天美生化仪器设备有限公司;RE-3000旋转蒸发器,上海市亚荣生化仪器厂;LCll00安捷伦液相色谱仪,安捷伦科技(中国)有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;EYELA冷冻干燥机,上海爱朗仪器有限公司;BSZ-1000自动部分收集器、HL-2恒流泵,上海沪西分析仪器厂有限公司;EM-30 Plus扫描电镜,北京天耀科技有限公司;VERTEX 70傅里叶红外光谱仪,德国布鲁克光谱仪器公司。
1.2 实验方法
1.2.1 胶红酵母胞外多糖的制备
将胶红酵母菌种接入平板活化后,转入种子液培养基(酵母膏1%、葡萄糖2%、蛋白胨2%),在pH值为6的条件下培养2 d。随后以5%的量转入优化培养基(葡萄糖5%、(NH4)2SO40.1%、KH2PO40.1%、CaCl20.01%、NaCl 0.04%、MgSO4·7H2O 0.1%),在28 ℃,pH 7的条件下,培养6 d。分离上清液与细胞,提取酵母胞外多糖。将液体培养液于9 000 r/min、4 ℃条件下离心6 min,分离酵母菌与培养液,浓缩液用4倍体积75%乙醇沉淀24 h,离心、冷冻干燥,得白色沉淀,即为酵母胞外多糖粗品。采用三氯乙酸法脱蛋白:称取2.00 g的胶红酵母胞外多糖样品,蒸馏水复溶。在胶红酵母胞外多糖的水溶液里缓慢滴加10%的三氯乙酸。置于4 ℃的冰箱内放置24 h,离心去除白色沉淀。将去除蛋白的多糖溶液醇沉后进行冻干处理,得到粗多糖REPS,保存后备用。
1.2.2 多糖含量的测定
采用苯酚硫酸法[7]。
1.2.3 胶红酵母胞外多糖的分离、纯化
1.2.3.1 DEAE-52纤维素层析柱纯化
在原有方法[8]基础上进行了修改,具体方法如下:将粗多糖REPS溶解于蒸馏水中,离心去除未溶解的沉淀与杂质,上清液用DEAE-52阴离子交换柱进行层析分离,依次用0.0,0.3,0.6,0.9和1.2 mol/L的NaCl以0.5 mL/min的流速洗涤,苯酚-硫酸法跟踪检测收集液,合并各洗脱峰洗脱液,浓缩,透析,冷冻干燥,备用。
1.2.3.2 Sephadex G-100凝胶柱层析
将DEAE-52纤维素柱层析分级得到的胞外多糖溶解,用滴管将多糖溶液沿壁缓慢地加入平衡好的SephadexG-100色谱柱中,蒸馏水洗脱,流速为0.5 mL/min,苯酚-硫酸法跟踪检测收集液,合并各洗脱峰洗脱液,浓缩,透析,冷冻干燥,备用,即得到多糖REPS纯品。
1.2.4 多糖分子质量的测定和纯度鉴定
将REPS纯品组分采用高效凝胶渗透色谱法(high performance gel permeation chromatography, HPGPC)[9]测定纯度和分子量。
1.2.5 红外光谱测定
将多糖样品用KBr压片。通过Vector 33 FT-IR(fourier transform infrared spectrometer)分光光度计扫描,以4~400 cm-1的分辨率记录2 cm-1的FT-IR光谱[10]。
1.2.6 多糖抗氧化性的研究
1.2.6.1 清除DPPH自由基能力的测定
在WANG等[11]的方法上有所改动,具体操作如下:准确吸取DPPH试剂3.9 mL,与0.1 mL甲醇试剂混合,以甲醇作参照,记录混合液于517 nm处所得的OD值(A对照)。吸取5份相同体积REPS纯品组分溶液,分别稀释到1、2、4、6和8 mg/mL;吸取5份相同体积的Vc溶液,分别稀释到1、2、4、6和8 mg/mL。量取上述试样各1 mL,加入3 mL DPPH(25 mg/L)试剂,涡漩均匀,30 ℃保温,避光静置40 min。甲醇为参照,记录各混合液在517 nm处所得的OD值(A样品),所有的试样做3个重复后求平均值。取上述样液各0.1 mL,分别与3.9 mL甲醇试剂混合均匀,用甲醇做参照,记录各混合液在517 nm处所得的OD值(A参比);记录各组数据,计算其清除率(percentage of scavenging radical capacity, SR),得到清除率在一定浓度范围内的线性回归方程,通过线性回归方程计算半数清除率IC50。
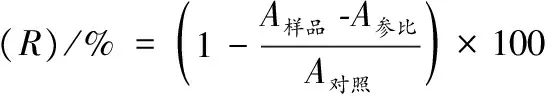
(1)
1.2.6.2 还原力的测定
在ZHU等[12]的方法基础上稍作修改。具体操作如下:吸取5份同体积的REPS纯品组分溶液,分别稀释到1、2、4、6、8 mg/mL。移取不同浓度试样0.4 mL,与磷酸盐缓冲溶液(0.5 mL 0.2 mol/L,pH 6.6)和0.5 mL六氰合铁酸钾[K3Fe(CN)6](1.0%)溶液混合。反应混合物在50 ℃水浴保温反应20 min后,快速冷却,加入0.5 mL 10%的三氯乙酸,2 min后加入0.5 mL蒸馏水和0.5 mL 0.1% FeCl3。室温静置5 min,在700 nm处测其OD值(A)。用蒸馏水代替0.1% FeCl3作为空白对照。
1.2.6.3 ABTS自由基清除实验
在CHENG等[13]的方法基础上稍作修改。具体操作如下:ABTS阳离子自由基(ABTS+·)通过将7.00 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾水溶液混合而产生,并在室温下于黑暗中放置16 h。然后将3.6 mL的ABTS+溶液加入到0.4 mL不同质量浓度(1.0~8.0 mg/mL)的多糖组分REPS2-A中。将反应混合物在室温下放置20 min,于734 nm处测量吸光度。以不同浓度Vc作为阳性对照。
ABTS自由基清除率按公式(2)计算:
模块化设计以模块为基础,通过“搭积木”的方式将模块组合成一系列标准化的模型,也可以在性能、结构上有所差异,充分适应不同用户的需求。在建筑设计中,模块化设计更倾向于对各类功能空间进行划分,使相同功能空间处于同一单元当中,并对单元模块进行集成,使建筑完成从单元到整体的转变。目前,在许多公寓住宅、医院、酒店、教学楼等建筑中得到了广泛应用。
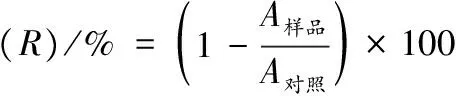
(2)
式中:A样品,样品吸光值;A对照,对照管的吸光值。
2 结果与分析
2.1 胶红酵母细胞菌落形态
如图1所示,在固体琼脂培养基平板上的胶红酵母(R.mucilaginosaCICC 33013)的菌落形态是均匀的,中等大小,暗红色,具有光滑的表面。SEM图像(图1-b)显示细胞形态为球形或椭圆形,3~4 μm,菌落分布为单个,配对或连环,出芽生殖。
a-胶红酵母平板菌落形态;b- R. mucilaginosa CICC 33013细胞表面扫描电子显微(SEM)图像图1 胶红酵母细胞菌落形态Fig.1 R. mucilaginosa CICC 33013 cell colony and morphology
2.2 多糖含量的测定
葡萄糖标准曲线的回归方程为:y=0.013 43x-0.106 7,线性相关系数R2=0.991 8。由葡萄糖标准曲线,可计算REPS产量为6.2 g/L。
2.3 胞外多糖的分离、纯化
通过醇沉,脱蛋白,透析等方法得到粗多糖组分REPS,复溶,DEAE-52离子交换柱层析,由洗脱曲线可知,分别得到蒸馏水洗脱峰REPS1和REPS2,0.3 mol/L NaCl洗脱峰REPS3三个多糖组分(图2)。将占主要部分的中性多糖REPS2用蒸馏水洗脱,并通过凝胶渗透在Sephadex G-100柱中进一步纯化,分别得到了2个多糖组分REPS2-A和REPS2-B(图3)。

图2 REPS的DEAE-52纤维素柱层析洗脱曲线Fig.2 DEAE-52 cellulose column chromatography elution curve of REPS
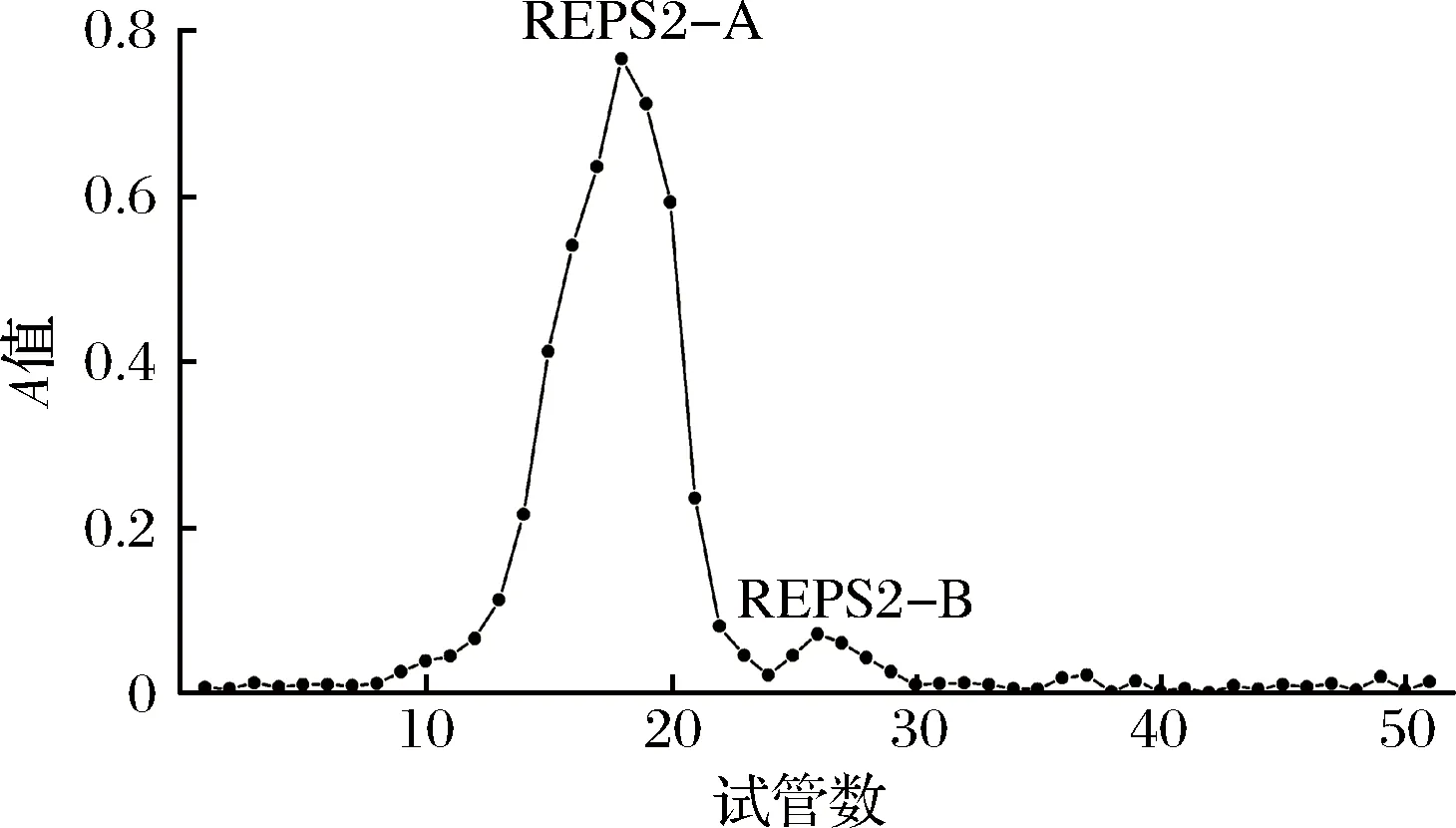
图3 REPS2的SephadexG-100凝胶柱层析洗脱曲线Fig.3 Sephadex G-100 gel column chromatography elution curve of REPS2
由于多糖组分REPS2-A占REPS2的75.2%(质量占比),因此多糖组分REPS2-B未作研究。收集多糖组分REPS2-A,透析、干燥用于进一步分析。
2.4 多糖分子质量的测定和纯度鉴定
HPGPC色谱图显示多糖组分REPS2-A是单一、对称峰,表明得到的多糖组分REPS2-A是均相样品。如图4所示,根据葡聚糖标准,REPS2-A的平均分子质量为7.125×106Da。
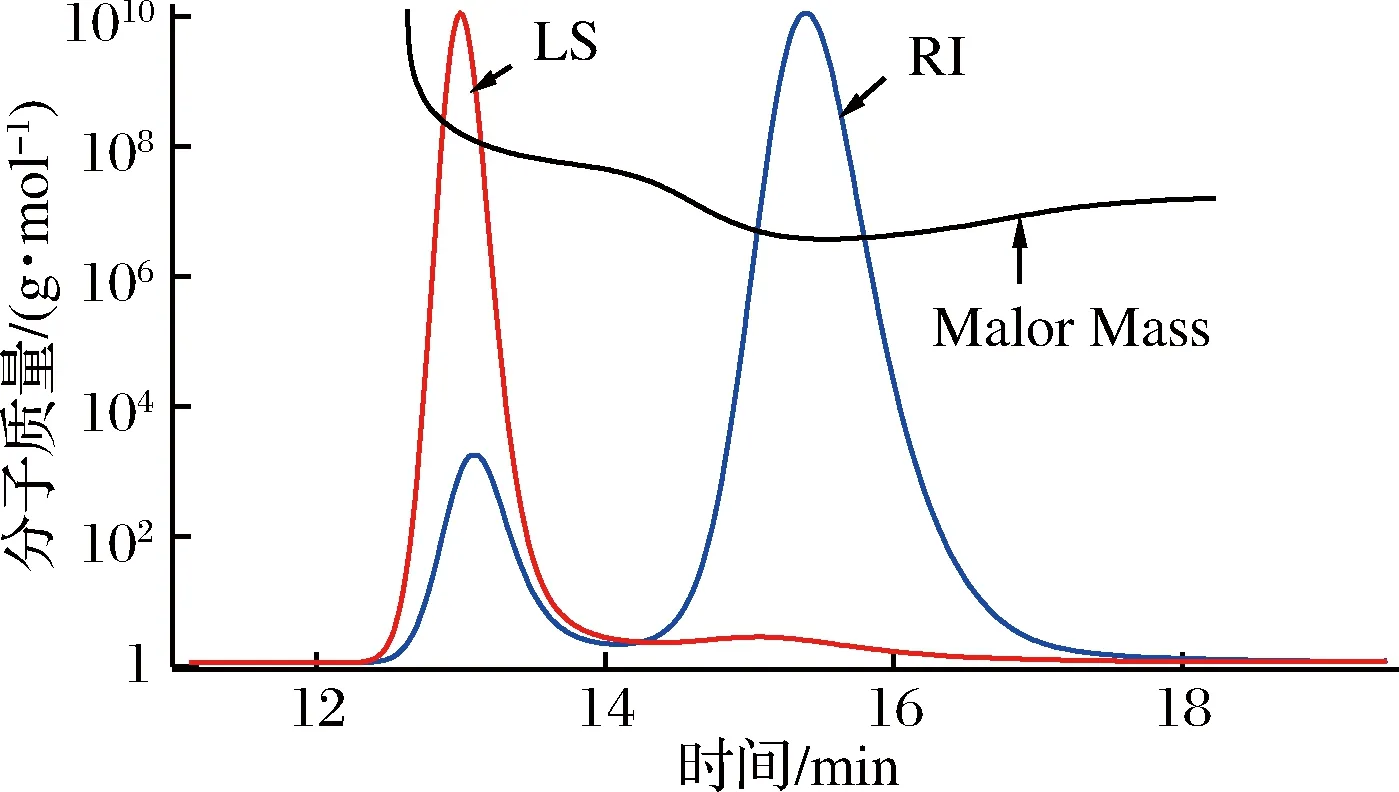
LS-激光光反射强度;RI-示差强度图4 REPS2-A分子质量分布图Fig.4 The molecular weight distributions of REPS2-A
2.5 红外光谱测定结果

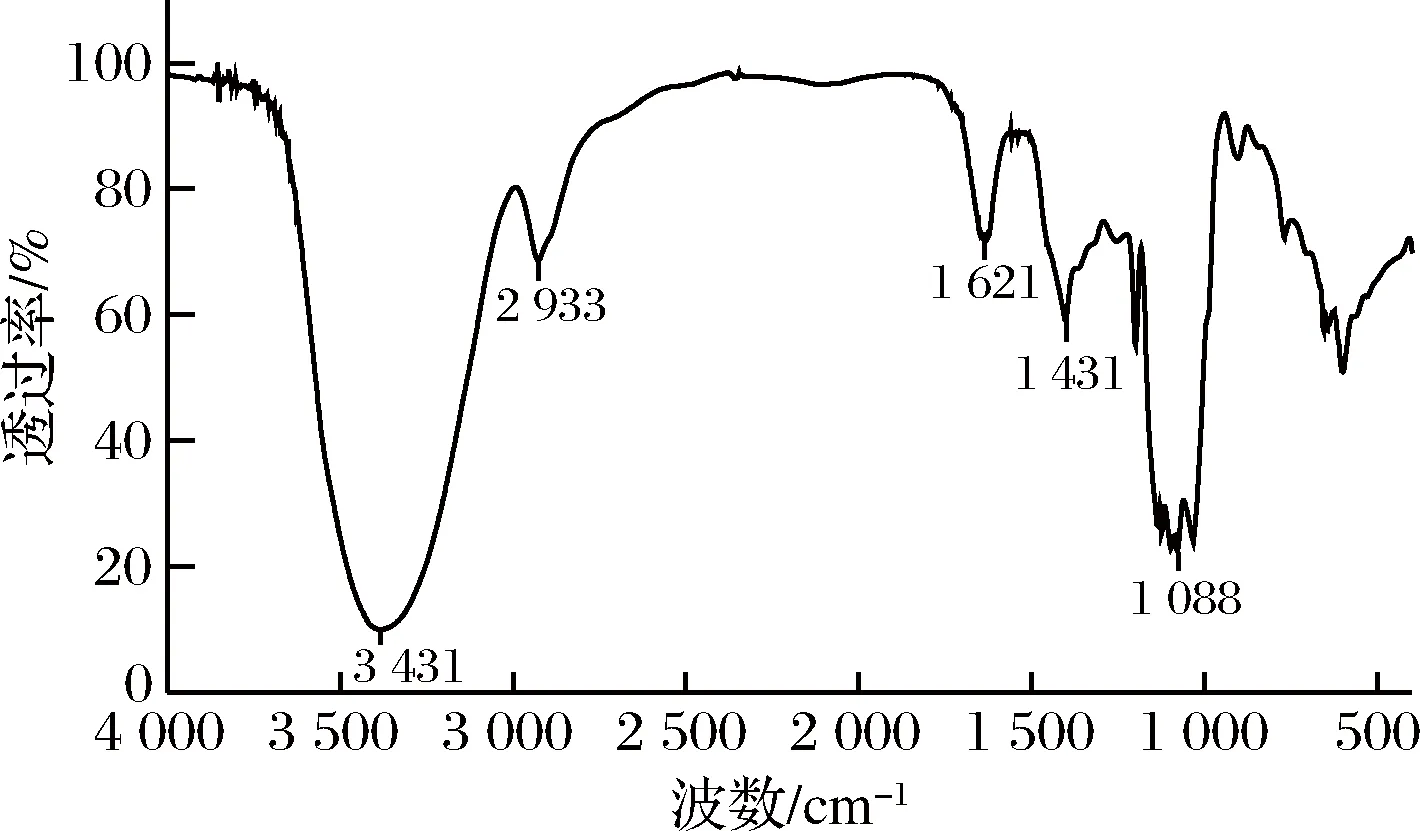
图5 REPS2-A红外光谱图Fig.5 FT-IR spectrum of the REPS2-A fraction.
2.6 多糖抗氧化性的研究
2.6.1 DPPH清除活性分析
如图6所示,随着多糖组分REPS2和REPS2-A浓度的增加,DPPH清除作用呈剂量依赖性增加。当质量浓度为1.0 mg/mL时,多糖组分REPS2和REPS2-A的DPPH自由基清除能力分别为(25.05±1.60)%和(19.05±1.00)%。此外,多糖样品在较高质量浓度(1.0~8.0 mg/mL)下表现出较高的清除能力。结果表明,多糖组分REPS2和REPS2-A具有较高的DPPH自由基清除能力,这意味着它们可以将电子或氢供给DPPH自由基。但是,粗多糖组分REPS对DPPH自由基清除能力的机制尚需进一步研究。
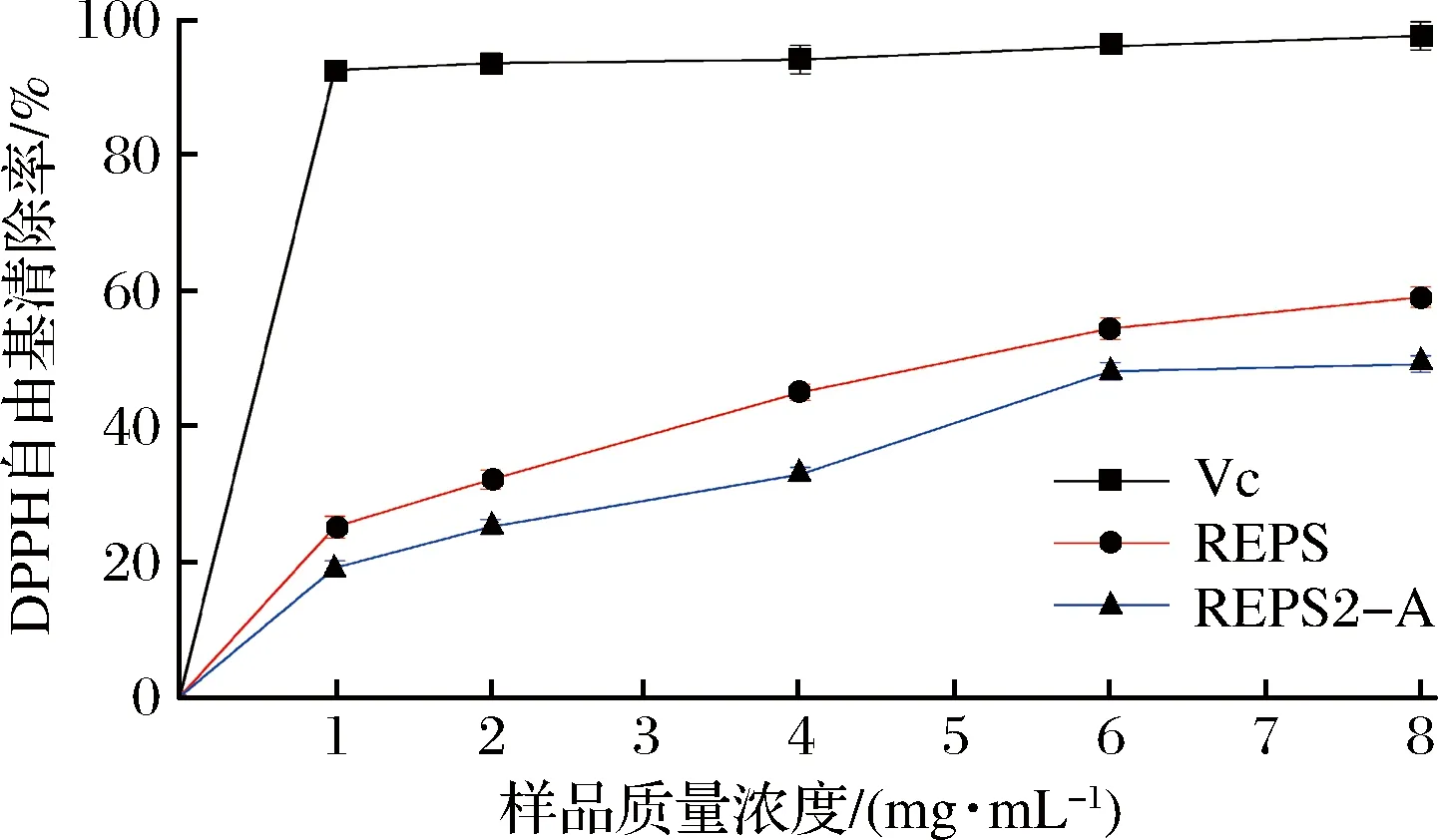
图6 清除DPPH自由基能力测定结果Fig.6 DPPH radical scavenging activity of REPS2 and REPS2-A
2.6.2 ABTS清除率结果的测定
抗坏血酸、多糖组分REPS和REPS2-A对ABTS自由基的清除能力如图7所示。多糖组分REPS2-A的清除能力与其浓度高度相关(浓度越高,清除能力越高),但低于相同浓度的抗坏血酸。抗坏血酸浓度仅为1.0 mg/mL时,清除率已经高达90%,且随着浓度增加,清除效果基本趋于平稳。REPS2-A和REPS在浓度达到8.0 mg/mL时表现出超过50.0%的ABTS自由基清除能力。结果表明,多糖组分REPS2-A和REPS对ABTS自由基具有清除能力,可作为潜在的抗氧化剂进一步研究。
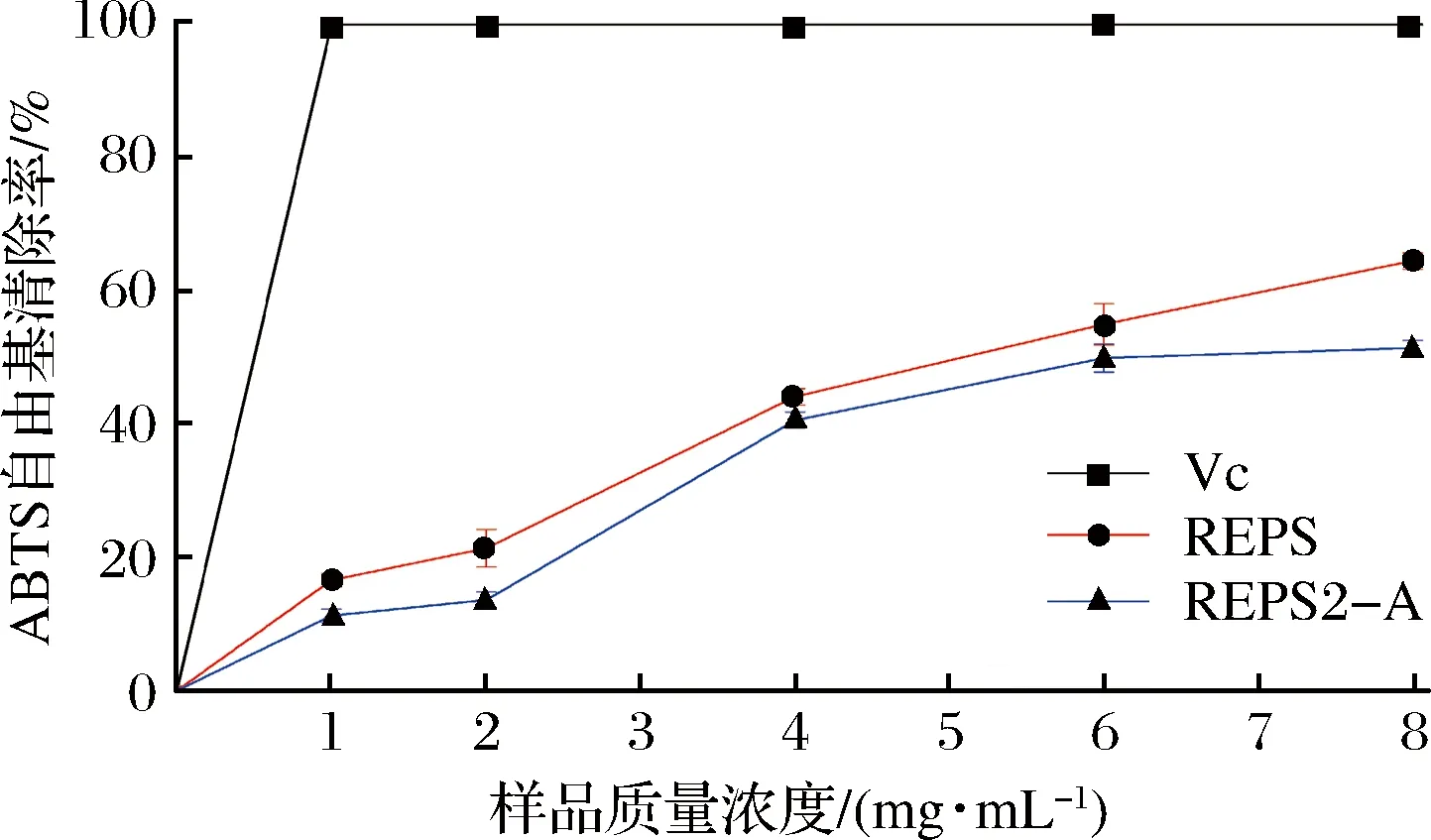
图7 清除ABTS自由基的能力Fig.7 ABTS radical scavenging capacity of REPS2 and REPS2-A
2.6.3 还原力实验结果
还原力的活性可以有效地用于显示抗氧化活性的能力。在反应中还原剂的存在导致Fe3+/铁氰化物络合物的还原,将其转化为Fe2+形式,可以通过在700 nm形成普鲁士蓝来检测[20-21]。本文比较了抗坏血酸,多糖组分REPS和REPS2-A的还原能力,如图8所示,较高的吸光度表明较强的还原能力,有相互依赖性。当浓度为8.0 mg/mL时,抗坏血酸、多糖组分REPS和REPS2-A的最大还原力分别为2.789±0.030,0.710±0.040和0.352±0.010。当多糖组分REPS和REPS2-A组分的浓度逐渐增大时,两者的还原力都在逐渐的增强,而多糖组分REPS的增加量大于REPS2-A,这说明经纯化后的多糖组分REPS2-A组分其活性低于粗多糖组分REPS,这也与上述2种抗氧化活性试验结果一致。
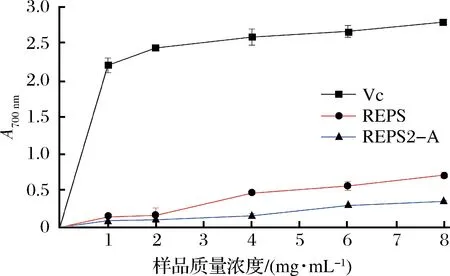
图8 REPS2和REPS2-A的还原力Fig.8 Reducing power of REPS2 and REPS2-A
3 结论
本文主要对胶红酵母R.mucilaginosaCICC 33013菌株代谢的胞外多糖REPS进行分离纯化、初步结构解析及抗氧化活性分析等方面进行研究。结果表明:从R.mucilaginosaCICC 33013中分离出水溶性胞外多糖REPS,其产量为6.2 g/L。REPS经分离纯化得到多糖组分REPS2-A,分子质量为7.125×106Da。通过不同方法的抗氧化能力体外测定(DPPH、ABTS、还原力),证明REPS2-A具有较好的自由基清除能力,当多糖组分REPS2-A质量浓度为8 mg/mL时,DPPH自由基清除率为49.1%,ABTS自由基清除率为51.2%,还原力为0.352。多糖组分REPS2-A在各种反应体系中表现出不同的抗氧化活性,这可能与其特殊的结构和组成有关。研究表明,抗氧化活性的不同归因于不同机制,例如防止链引发,过渡金属离子催化剂的结合,过氧化物的分解,还原能力和自由基清除[22-25]。此外,研究发现,酵母多糖(如酵母多糖和颗粒葡聚糖)能够刺激超氧化物的产生并减少由自由基或PMN白细胞诱导的DNA链断裂[26]。然而,胶红酵母胞外多糖REPS2-A的抗氧化机制尚不清楚,未来的研究主要集中在抗氧化机制与多糖组分REPS2-A结构之间的关系上。此外,多糖组分REPS2-A的体内抗氧化活性还有待进一步研究。
