氧化葡萄糖酸杆菌产2-酮基-D-葡萄糖酸的发酵过程优化
2019-06-26蔡文曾伟主周景文
蔡文,曾伟主,周景文
(国家工程实验室(江南大学),江苏 无锡,214122)
2-酮基-D-葡萄糖酸(2-keto-D-gluconicacid,2-KGA)是一种重要的有机酸,用途广泛[1],能够作为食品添加剂、水泥增塑剂、洗涤剂和照片显影剂,最主要的用途是作为食品添加剂D-异抗坏血酸及其钠盐的前体[2]。此外,2-KGA还可以在2-酮基-D-葡萄糖酸脱氢酶的作用下转化成2,5-二酮基-D-葡萄糖酸(2,5-KDG),2,5-KDG通过2,5-KDG还原酶可以生成用于维生素C合成的前体2-酮基-L-古龙酸(2-KLG)[3]。2-KGA主要以化学法、酶催化法以及发酵法生产。化学合成法以Pt/Pb为催化剂,催化D-葡萄糖与分子氧反应形成2-KGA;酶法是指在相关氧化酶的催化作用下,将溶液中的D-葡萄糖经多步氧化形成2-KGA;发酵法是通过细菌发酵直接将D-葡萄糖转化为2-KGA,当前,普遍应用于工业生产2-KGA的方法为细菌发酵法。主要的细菌有荧光假单胞菌、恶臭假单胞菌、铜绿假单胞菌、球状节杆菌、产酮产碱菌、巴氏醋酸杆菌、氧化葡萄糖酸杆菌、粘质沙雷氏菌等[4-7]。我国的工业生产以荧光假单胞菌为主,在以18%的葡萄糖溶液为底物时,最终的转化率可达90.0%。但是荧光假单胞菌作为生产菌株,存在生产过程噬菌体污染、高浓度底物对发酵过程中菌体生长的抑制和发酵液中成分过多,分离困难等问题。
本研究中采用的菌株为氧化葡萄糖酸杆菌[8],具有耐高渗、耐酸等特点,同时对葡萄糖的利用率较高,因此可以用作生产2-KGA的菌株。本实验主要对5株野生菌进行初步筛选,针对具有较强2-KGA积累能力的菌株进行发酵优化,包括摇瓶培养的温度、培养基的组成以提高2-KGA的产量。
1 材料与方法
1.1 实验材料
1.1.1 菌株与质粒
GluconobactercerinusCGMCC 1.110[9]、Glucono-bacterjaponicusCGMCC 1.49[10]:中国普通微生物菌株保藏中心;Gluconobacteroxydans621H[11]:美国模式培养物集存库(ATCC);GluconobacteroxydansWSH-003[12]:江苏江山制药有限公司;GluconobacteroxydansT-100:日本NBRC菌株保藏中心。
1.1.2 主要试剂
头孢西丁钠盐、卡纳霉素抗生素,阿拉丁生物;蛋白胨、酵母粉,Oxoid生物。其他常规试剂购自国药试剂。
1.1.3 培养基
种子培养基(g/L):酵母抽提物10,山梨醇50,相应的固体培养基加入2%琼脂条,115 ℃灭菌20 min。
摇瓶发酵培养基(g/L):葡萄糖100,玉米浆粉20,CaCO320,MgSO40.2,(NH4)2SO42,KH2PO40.5,115 ℃灭菌20 min。
3 L发酵罐发酵培养基(g/L):葡萄糖100,玉米浆粉20,CaCO30.1,MgSO40.2,(NH4)2SO42,KH2PO40.5,115 ℃灭菌20 min。
1.1.4 仪器与设备
高效液相色谱仪,美国安捷伦公司;高压蒸汽灭菌锅,上海博讯实业有限公司;恒温摇床,上海知楚仪器有限公司。
1.2 实验方法
1.2.1 种子活化
从冰箱中取出保存的菌株甘油管解冻后,用接种针蘸取菌液划线于平板上,放置于30 ℃恒温培养箱中培养24 h后,挑取平板上的单菌落于装有种子培养基的摇瓶中,放置于30 ℃恒温摇床中,220 r/min培养24 h。
1.2.2 细胞培养
摇瓶培养:将活化后的种子液以10%接种量转接至装液量为50 mL的500 mL摇瓶中,30 ℃下220 r/min培养24 h。
发酵罐培养:以10%接种量将培养好的种子液转接到3 L发酵罐中,装液量为1 L,搅拌转速600 r/min,通气量4 vvm,30 ℃下培养。
1.2.3 检测方法
采用高效液相色谱法(HPLC)测定发酵液中的2-KGA含量。利用AMINEX HPX-87H有机酸柱进行检测,检测条件为:流动相0.5 mmol/L稀H2SO4溶液,流速0.5 mL/min,柱温35 ℃,进样量10 μL。
标准曲线的绘制:将购买的标准品溶于纯水中,按照一定比例稀释成不同质量分数的溶液后,以液相检测的峰面积为Y轴,标准品浓度为X轴,绘制标准曲线,得到液相检测的峰面积与产物浓度的关系。
1.2.4 最终转化率计算

(1)
2 结果与分析
2.1 高产2-KGA菌株筛选
本实验室保藏的菌株共5株:G.cerinusCGMCC 1.110、G.japonicusCGMCC 1.49、G.oxydans621H、G.oxydansWSH-003 和G.oxydansT-100。分别以这5株野生菌作为出发菌株进行摇瓶发酵,以葡萄糖质量浓度为50 g/L的培养基为底物发酵,催化生产2-KGA。通过液相色谱检测产量进行对比,筛选出1株高产菌株作为后续发酵优化的出发菌株。从图1可以看出,在这5株野生菌中,G.japonicusCGMCC 1.49的产量最高,为19.9 g/L,转化率为36.9%,将其作为后续研究的出发菌株。
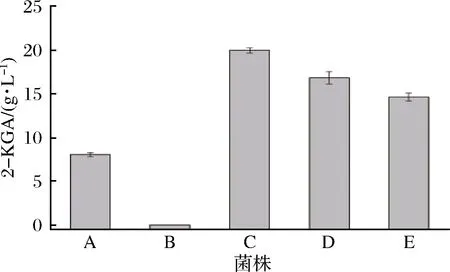
A-G. oxydans WSH-003;B- G. oxydans 621H;C-G. japonicusCGMCC 1.49;D-G. cerinus CGMCC 1.110;E-G. oxydans T-100图1 五株出发菌株发酵产量对比Fig.1 Comparison of 2-KGA titer of 5 starting strains
2.2 摇瓶发酵条件优化
2.2.1 葡萄糖质量浓度对发酵的影响
氧化葡萄糖酸杆菌中含有较多的脱氢酶,不同的底物可以被特异性催化生成不同的代谢产物[13]。以葡萄糖为底物时,产物为酮基葡萄糖酸,包括2-KGA和5-酮基葡萄糖酸(5-KGA)以及2,5-二酮基-D-葡萄糖酸(2,5-KDG)[14]。本实验中,确定以葡萄糖作为底物,探究不同浓度的底物对发酵以及产率的影响。

A-不同底物浓度对应的生长曲线;B-不同底物浓度条件下的2-KGA产量图2 葡萄糖浓度对发酵过程的影响Fig.2 Effects of glucose concentrations on fermentation process
从图2和表1中可以看出,培养基中的葡萄糖浓度不同,对于发酵过程中菌体的生长量、生长速率和2-KGA的产量有一定影响。当培养基中的葡萄糖质量浓度为50 g/L和100 g/L时,菌体的生长速度较快,最大的OD600值分别为12.5和13.7,可以看出当葡萄糖初始浓度较小时,有利于菌体的生长,生长速率较快;浓度较高时,对菌体的生长有较大的抑制作用,导致最终的菌体量较小。综合考虑菌体的生长速率、产量以及转化率,选取底物质量浓度为100 g/L作为发酵的初始浓度。

表1 初始葡萄糖浓度对发酵的影响Table 1 Effect of initial glucose concentration onfermentation process
2.2.2 氮源种类以及最优氮源浓度对发酵的影响
本实验选取的氮源有硝酸钠、硫酸铵、氯化铵、尿素、玉米浆粉、酵母粉和牛肉浸膏,添加量均为10 g/L,发酵72 h后,对比2-KGA的产量,确定最佳氮源[15]。从图2-A中得出,以玉米浆粉作为氮源时,对比生长情况在各个氮源种类中最佳,发酵72 h后,2-KGA产量为23.8 g/L,转化率为44.2%。在所选氮源中,最终的产率最高。
在确定最佳的氮源为玉米浆粉后,对玉米浆粉添加量进行优化。选取5个浓度梯度进行发酵验证。不同玉米浆粉质量浓度对菌体的生长和产物的合成都有一定的影响,通过图3-B中比较可以得出玉米浆粉的最优添加量为20 g/L。
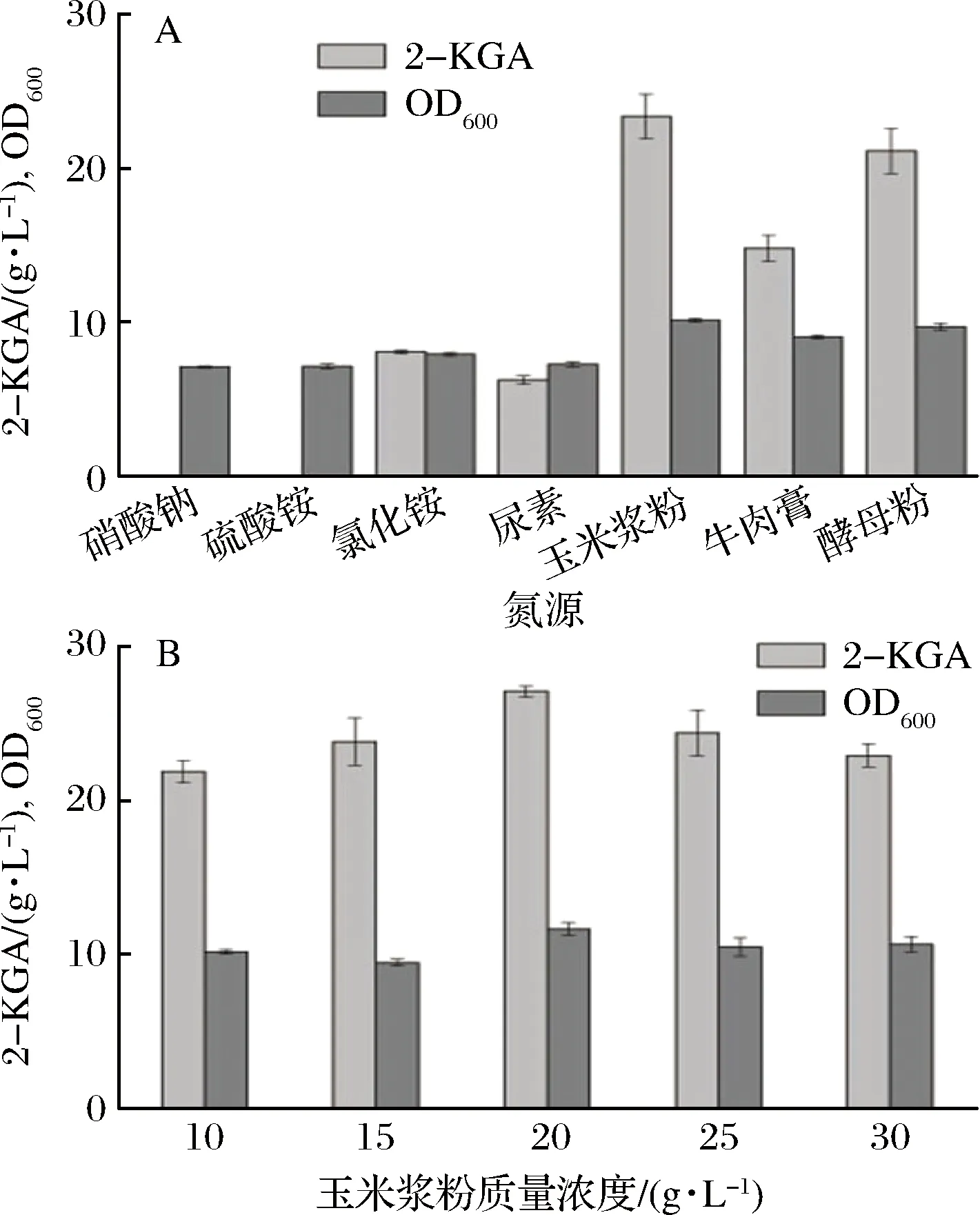
A-不同氮源对2-KGA产量及菌体生长的影响;B-玉米浆粉添加量对2-KGA产量及菌体生长的影响图3 氮源及最佳氮源添加量对2-KGA的产量以及菌体生长的影响Fig.3 Effects of different nitrogen sources and optimum nitrogen sources on titer of 2-KGA and growth of strain
2.2.3 温度对发酵的影响
氧化葡萄糖酸杆菌中已知的相关酶类的性质,主要涉及的葡萄糖脱氢酶和葡萄糖酸-2-脱氢酶最适温度与菌体生长的最适温度有差别,所以本实验对不同温度条件下的发酵情况进行比较[13,16-17]。主要控制发酵温度在28~32 ℃范围内,以50 g/L底物质量浓度发酵,控制其他条件相同,比较菌体的生长和最终产率情况。从图4可以得出,同一批次中,当控制发酵温度在30 ℃时,菌体的生长速度较快,发酵至终点的菌体量及最终的产率最高,产量达到23.7 g/L,转化率为49.6%。

A-温度对2-KGA产量的影响;B-不同温条件下的生长曲线图4 温度对发酵过程的影响Fig.4 Effects of temperature on fermentation process
2.3 3 L发酵罐实验
2.3.1 初始pH值对发酵的影响
通过在摇瓶上对发酵条件的摸索,确定培养基的基本组成,在发酵罐中对摇瓶实验进行放大[1,18]。在摸索摇瓶发酵条件时,对pH值条件的摸索受到限制,主要通过碳酸钙的添加来维持摇瓶中的pH值,在发酵罐上主要采用50%的氨水溶液进行pH值的调节。在摇瓶上进行发酵时,对比不添加碳酸钙进行发酵,最终的发酵液的pH值仅为2.8左右,且检测不到产物。所以猜想,在发酵过程中如果pH值一直维持较低水平,不利于产物的产生。当初始pH值为4.0或更低时,菌体的生长受到了很大抑制,所以需要在发酵罐上对发酵过程中的pH值进行调控。本实验主要选取了pH值为5.0、6.0、7.0进行对比。
对比图5不同pH条件下的发酵情况发现,当控制发酵过程中的pH值为6.0,发酵时间达到60 h时,产量最高达到93.4 g/L,转化率为87.2%。在该条件下,菌体的生长状况最好,所以在后续的发酵实验中,控制pH值为6.0。从葡萄糖消耗速率与中间产物葡萄糖酸的产生速率来看,前24 h内,底物被快速消耗,大部分转化为中间产物葡萄糖酸,菌体持续快速生长。经历了前24 h后,菌体量保持增加,底物逐渐消耗尽,中间产物开始转化为终产物2-KGA。另外检测发酵过程中溶氧发现,在0~36 h内变化剧烈且出现最低值,说明此阶段菌体生长旺盛,耗氧量增加。36 h后,溶氧开始慢慢上升,发酵持续到42 h后,溶氧水平保持平衡,菌体生长开始放缓。后续发酵罐上的溶氧水平优化可以此作为参考。
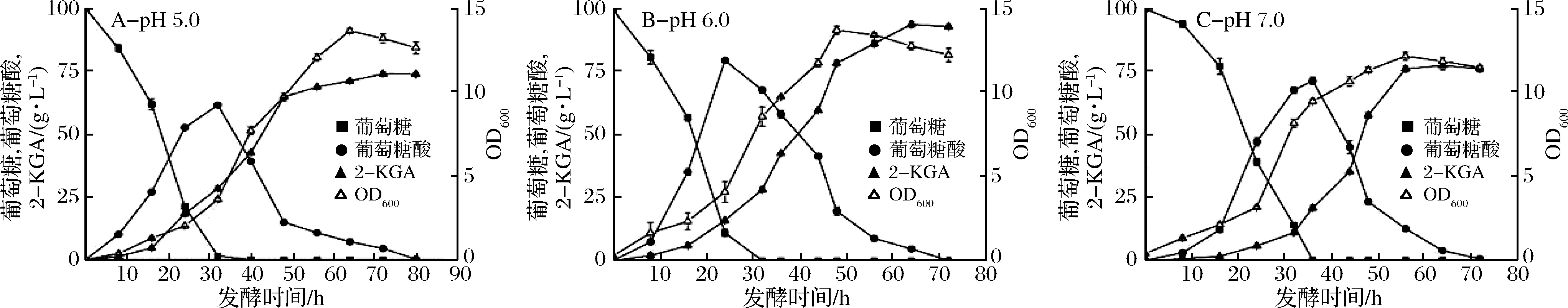
图5 pH对发酵过程的影响Fig.5 Effects of pH on fermentation process
2.3.2 溶氧对发酵的影响
溶氧(DO)是好氧微生物生长所必须的条件,更是对产物生成和能量代谢产生影响的关键环境因素之一。溶氧作为发酵过程中的重要参数,对发酵生产的稳定性和生产成本具有重大影响。在研究确定了最佳的pH值后,继续对溶氧进行探究。通过前期对罐上发酵过程的溶氧水平进行监测可知,在接种后的0~24 h内,溶氧量剧烈波动不断下降,最低降为0且维持一段时间;在36 h后,溶氧水平慢慢回升至最高值后维持恒定。所以本实验中对发酵前36 h内控制溶氧条件分别为20%、30%、40%和50%由图6可知,随着DO的升高,菌体生物量逐渐升高,至DO为40%时达到最大。当DO上升至50%时,菌体的生长量反而减小,同时当控制DO为30%时,2-KGA产量达到最大,且此条件下的产率也达到最高,分别为97.3 g/L和90.3%。虽然氧化葡萄糖酸杆菌是好氧菌,但是过多的氧气容易引起超氧化物和羟基自由基等物质形成,破坏细胞的组成,从而对菌体自身的代谢产生影响。
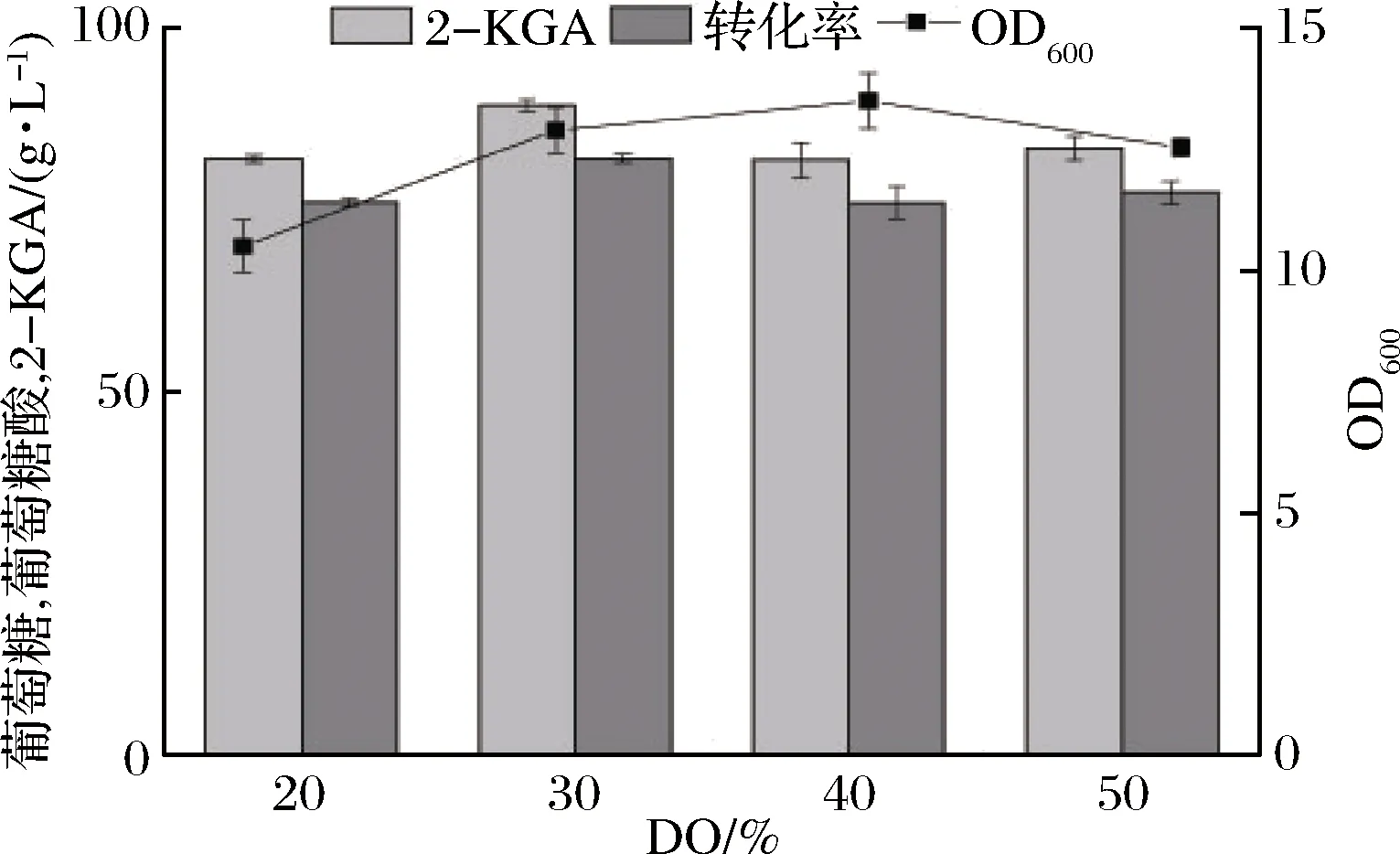
图6 不同DO水平对发酵过程的影响Fig.6 Effects of different DO levels on fermentation process
2.3.3 一次性补料时残糖质量浓度对发酵的影响
本实验采用3 L自动发酵罐进行2-KGA的分批补料发酵实验,初始的葡萄糖质量浓度均为100 g/L,装液量为1 L。发酵过程中以发酵液中的残糖质量浓度为指标,分别选取残糖质量浓度降低至15、25、35和45 g/L四个水平,一次性补加葡萄糖250 g/L,补糖量为200 mL,再以同样的条件发酵至终点。在发酵开始后10~18 h内,每1 h取样1次,监测残糖质量浓度,确定补料时机,补料之后每6 h取样1次。
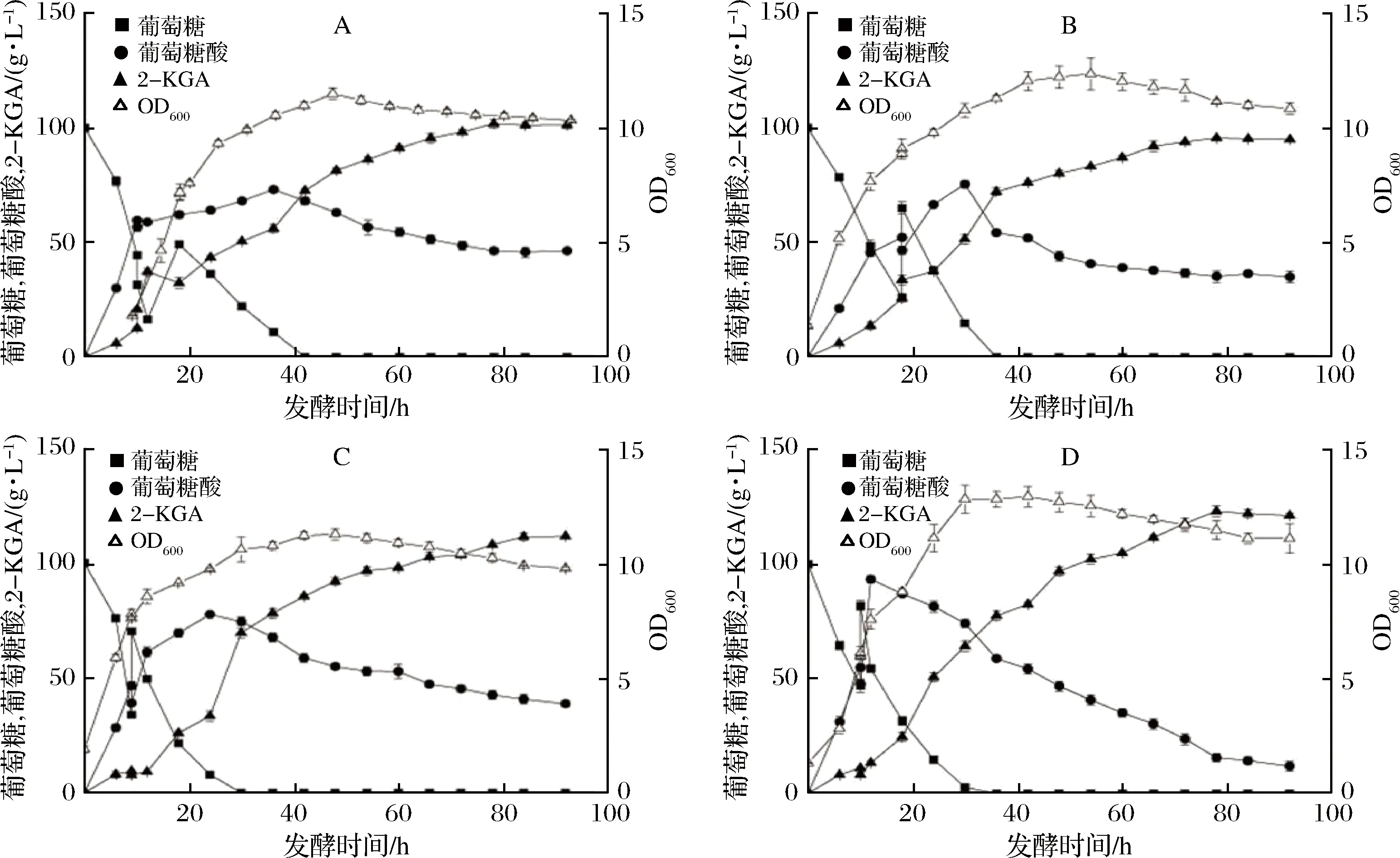
残糖质量浓度分别为:A-15 g/L;B-25 g/L;C-35 g/L;D-45 g/L图7 残糖质量浓度对生长的影响Fig.7 Effect of residual sugar concentration on growth
由图7可知,在不同的残糖质量浓度下,一次性添加50 g葡萄糖补料发酵,有利于减弱底物抑制,避免快速利用碳源的阻遏效应;补料发酵还可以控制最佳的生长和产物合成条件,稳定生产工艺。在25 g/L和45 g/L时一次性补料,菌体生长较旺盛,在对数生长期比生长速率较快,且能获得较高的菌体浓度。结合在发酵过程中的葡萄糖消耗、中间产物以及2-KGA生成的速率分析,在残糖质量浓度为35 g/L和45 g/L时一次性补料后底物的消耗以及产物的形成速率较快。残糖质量浓度为35 g/L时一次性补料,最大的生产强度为4.33 g/(L·h),发酵92 h后产量最终达到112.1 g/L;而残糖质量浓度为45 g/L时,最大的生产强度为6.16 g/(L·h),发酵92 h后产量最终达到122.1 g/L。同时,当选择残糖质量浓度为45 g/L时进行补料,最终发酵液中残留的葡萄糖酸最少,给后期产物提纯带来的影响较小。在15 g/L和25 g/L时进行补料,菌体生长较慢,2-KGA产量较低,生产强度和底物利用率不高。综合产物得率以及转换率对比得出,在残糖质量浓度为45 g/L时一次性补料后,菌体生长较好,产物转化率和生产强度最高,分别为75.5%和6.16 g/(L·h),产量较分批发酵提高了43.5%。
3 讨论
本文从5株菌中筛选出最适菌株G.japonicusCGMCC 1.49,并对其产2-KGA的发酵工艺进行了优化,在此最适条件下,2-KGA摇瓶发酵最高产量为76.3 g/L,较优化前提高了120.0%。对3 L罐中生产2-KGA的最优pH值和溶氧条件进行探究,得到在pH值为6,DO为30%条件下,2-KGA的产量为97.3 g/L,较摇瓶最高水平提高了26.7%。通过一次性补料优化后,产量达到122.1 g/L,转化率达75.5%。在后期的研究中,可以通过对补料方式和补料时机进一步探究,完善氧化葡萄糖酸杆菌产2-KGA过程中的各项参数,实现高产2-KGA的目标。本文筛选最适菌株后主要通过发酵优化手段实现2-KGA的高产,没有对其进行分子改造。最终结果表明,潜在副产物5-KGA和2,5-DKG的含量极低,对后期的分离提纯影响较小。近年来,对氧化葡萄糖酸杆菌的基因操作手段日趋完善[13,19-21]。在后续工作中,通过代谢工程策略强化2-KGA合成的关键酶、优化补料发酵条件,将有望进一步提升2-KGA产量[22-23]。本研究为后续利用氧化葡萄糖酸杆菌发酵生产2-KGA,及利用代谢工程改造实现维生素C前体2-KLG的直接发酵提供理论与技术参考[24-25]。
