白芍多糖体内、外抗氧化活性组分筛选研究
2019-06-24秦亚东汪荣斌周娟娟
秦亚东, 汪荣斌, 周娟娟
(1.安徽中医药高等专科学校 药学系,安徽 芜湖 241002;2.芜湖市中医医院 制剂室,安徽 芜湖 241000)
人体的氧化与抗氧化作用应处于一个相对平衡状态。由于种种原因产生过量的自由基和活性氧与人体的衰老、细胞的损伤等有密切关系,自由基过多会使细胞发生超氧化,引起细胞结构或功能的改变[1],最终导致人体皮肤、内脏、大脑等组织器官衰老并引发多种严重疾病[2]。人体具有系统的抗氧化防御机制,可以最大限度的将体内的自由基和活性氧清除。其中酶系统抗氧化物包括身体自身的细胞内抗氧化酶,如超氧化物歧化酶(SOD)、谷肽甘肽过氧化物酶(GSH-Px)、过氧化氢酶(POD)等;非酶系统抗氧化物包括金属结合蛋白、还原性谷胱甘肽(GSH)、各种维生素、激素等。
机体自由基的清除除依靠自身的抗氧化系统外,自然来源的药物植物提取物也逐渐应用于抗氧化保健产品领域。研究表明植物中的多糖类物质具有明显的生物活性, 是一种潜在的天然的抗氧化物质[3-5]。传统中药多糖抗氧化作用对预防和治疗心脑血管系统疾病发挥重要作用,从传统中药多糖中寻求能够清除体内自由基或能抑制机体氧化作用的活性组分或成分是中医药大健康行业发展的热点领域。相关研究[6-7]已经证实白芍多糖在体内、外均具有一定的抗氧化作用[8]。为进一步探索白芍多糖体内、外抗化作用活性组分,本研究采用热水回流提取后分步醇沉法,通过控制醇沉条件,将白芍多糖按分子量大小分为PRPS20、PRPS40、PRPS60、PRPS80四个组分,通过对四个组分的白芍多糖进行体内、外抗氧化活性组分筛选研究,明确白芍多糖抗氧化作用的活性多糖成分群所处组分,以期为白芍老药新用及保健产品开发提供参考和借鉴。
1 材料与方法
1.1 供试材料
1.1.1 试药与试剂 白芍饮片购于安徽亳州中药材大市场(批号:201607);抗坏血酸(VC),1,1-二苯代苦味肼基自由基(DPPH)购于国药集团化学试剂有限公司;D-葡萄糖对照品购于中国食品药品检定研究院(批号:110833-201603);维生素E(VE)胶丸购于广州白云山制药总厂(批号:2015021106);无水乙醇,乙醚,丙酮等均为市售分析纯;丙二醛(MDA,批号:20150211),超氧化物歧化酶(SOD,批号:20150507),谷胱甘肽过氧化物酶(GSH-Px, 批号:20150507)均购自于南京建成生物工程研究所。
1.1.2 受试动物 ICR小鼠,雄性,20±2 g,SPF级,购于南京市江宁区青龙山动物繁殖场,许可证号:SCXK(苏)2017-0001,动物合格证号:NO.201711181。
1.1.3 仪器 RE-5002型旋转蒸发仪(西安比诺仪器设备有限公司);Cary60型紫外-可见分光光度仪(美国Agilent公司);Sigma3-18K型台式离心机(德国Sigma公司);CAP124S型电子天平(德国赛多利斯公司)。
1.2 试验方法
1.2.1 不同组分白芍多糖的制备 在前期研究基础,取白芍适量,粉碎后,经无水乙醇已经浸泡过夜处理2次,以除去小分子物质及色素等成分,药渣自然晾干后热水提取2次,合并滤液,水浴蒸发至原体积的三分之一,向滤液中缓慢加入无水乙醇使含醇量达到20%(v/v),置冰水浴中12 h,收集下层沉淀,离心处理(3 000 r/min,5 min),沉淀经丙酮、乙醚反复冲洗后,挥干溶剂即得PRPS20组分;继续向上述滤液中加入无水乙醇使含醇量达到40%(v/v),其余操作方法相同,以此类推,分别制得PRPS40组分、PRPS60组分、PRPS80组分。
1.2.2 多糖得率及多糖含量的测定 将1.2.1节下所得的PRPS20、PRPS40、PRPS60、PRPS80组分在60 ℃低温干燥至恒重后称定重量,分别计算各组分的多糖得率和多糖含量。多糖得率=不同组分多糖干燥后重量(g)/白芍取样量(g)×100%;以D-葡萄糖为对照品,采用硫酸-苯酚显色,紫外分光光度计于490 nm下测定[9],计算白芍各组分多糖含量。
1.2.3 体外DPPH清除作用 参考文献方法[5-7],精密称取白芍各组分多糖,以蒸馏水为溶剂,配制浓度为0.8 mg/mL溶液,然后梯度稀释后分别得到浓度分别为0.8、0.4、0.20、0.10、0.05 mg/mL的多糖样品溶液。分别取各样品溶液与等体积的DPPH溶液加入同一具塞棕色试管中,震摇均匀后避光反应30 min,于517 nm下测定吸光度T,同时测定DPPH溶液与等体积纯水混合液的吸光度C,以及待测液与等体积95%乙醇混合液的吸光度T0,清除率=[1-(T-T0)/C]×100%,本试验采用抗坏血酸作为对照,同时计算半数清除率IC50。
1.2.4 体内抗氧化作用 受试小鼠随机分为6 组:正常对照组、D-半乳糖模型组(100 mg/kg)、VE对照组(50 mg/kg)、白芍多糖PRPS20、PRPS40、PRPS60、PRPS80组(200 mg/kg),每组10 只。白芍多糖组、VE对照组均使用0.3% CMC-Na配制成混悬液,10 mL/kg每天灌胃给药1 次,正常组及D-半乳糖模型组给予等体积0.3% CMC-Na溶液灌胃给药。除正常对照组外,其余各组每天颈背部皮下注射D-半乳糖(100 mg/kg),注射剂量为0.01 mL/g,适应性饲养3 d后开始给药,连续21 d。末次给药后,禁食不禁水,16 h后取眼底静脉血约1.0 mL收集与EP管中,静置后低温离心处理,取上层血清,按试剂盒操作说明,测定血清中MDA、SOD和GSH-Px活力。
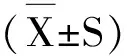
2 结果与分析
2.1 白芍不同多糖组分得率及含量
分步醇沉对白芍多糖得率和含量的影响见图1。醇沉浓度为20%时,多糖得率最高为1.69%,依次是40%和60%,最后当醇沉浓度为80%时多糖得率最低仅为0.67%,因此多糖得率有随着醇沉浓度升高而下降的趋势,同时也说明白芍多糖不同醇沉部分多糖的分布是不均匀的,20%和40%(高分子量多糖部分)醇沉部分占全部多糖的61%,80%醇沉部分(小分子量多糖)所占多糖比例较低为12.8%;各部分多糖含量的变化趋势是先增加后降低,40%醇沉部分含量最高,80%多糖组分含量最低,可能与含有色素等小分子杂质有关。
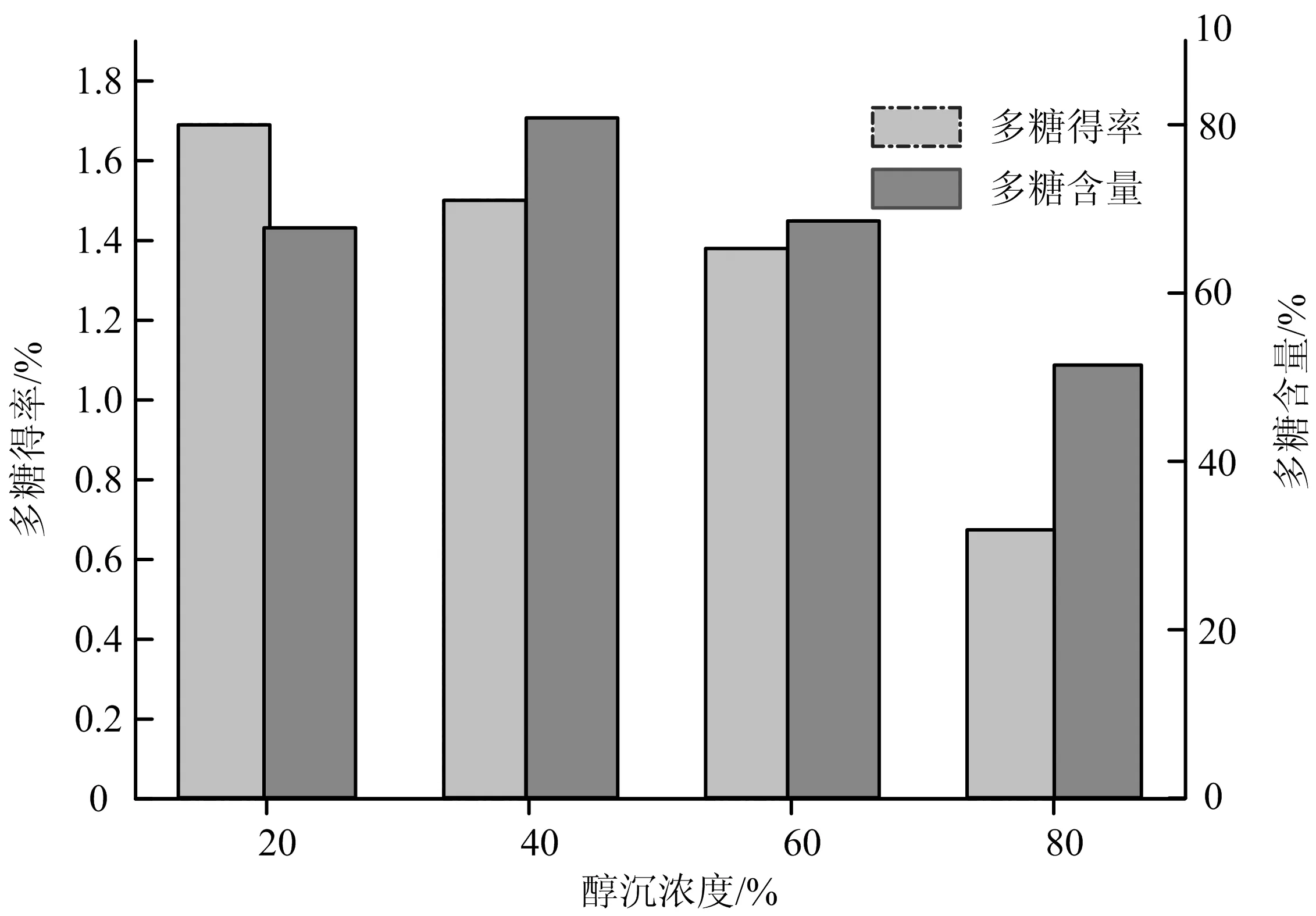
图1 分步醇沉对白芍多糖得率和含量的影响
2.2 体外清除DPPH作用
白芍多糖不同组分系列浓度对DPPH的清除作用呈现不同的规律,由图2可见,PRPS20、PRPS40对DPPH的清除率随浓度的增加无明显变化;PRPS60、PRPS80随着浓度的增加对DPPH的清除率逐渐增加,尤其是PRPS80组分更是显示出了明显的浓度依赖性。PRPS60、PRPS80和抗坏血酸的IC50分别为0.355、0.086、0.002 mg/mL,而抗坏血酸对照样品在0.008 mg/mL时对DPPH的清除率达到50%。与抗坏血酸相比,白芍不同组分多糖对DPPH的清除能力较弱。

图2 白芍多糖对DPPH清除作用
2.3 白芍多糖对衰老小鼠血清中SOD、MDA及GSH-Px的影响
各组试验小鼠血清中SOD、MDA及GSH-Px活力测定结果见表1,由于中、低剂量组(100 mg/kg、50 mg/kg)对小鼠血清中SOD、MDA及GSH-Px活力影响不具统计学意义(P>0.05),表1为高剂量组(200 mg/kg)试验结果。D-半乳糖模型组小鼠血清中SOD、GSH-Px活力比正常对照组明显降低,MDA活力明显升高,均且具有统计学差异(P<0.01),说明小鼠衰老造模成功;PRPS40组能显著升高小鼠血清中SOD、GSH-Px活性,同时显著降低MDA活性,具统计学差异(P<0.05或P<0.01),其他多糖组作用不明显。提示PRPS40组是白芍多糖体内发挥抗氧化作用的物质基础,可能是白芍多糖体内抗氧化的活性多糖组分。
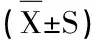
表1 PRPS对衰老小鼠血清中SOD、MDA、GSH-Px的影响
注:与正常对照组比较,*P<0.05,**P<0.01;与模型组比较,△P<0.05,△△P<0.01。
3 结论与讨论
随着对中药多糖研究的不断深入,越来越多的中药多糖被证实具有多方面的生物学活性。传统中药多糖具有复杂的化学结构,因此中药多糖均一成分的提取分离难度较大。为降低白芍多糖体内外抗氧化活性组分的研究难度,结合课题组前期研究确定白芍多糖在体内、外均具有一定的抗氧化作用[6-7],为寻求白芍多糖抗氧化药效物质基础,本研究利用分步醇沉手段,通过控制醇沉浓度,将白芍多糖按分子量大小分为PRPS20、PRPS40、PRPS60、PRPS80四个组分,通过对4个分子量范围不同的白芍多糖组分进行体内、外抗氧化作用比较,以确定白芍多糖抗氧化活性组分。
本研究利用经典体外抗氧化作用试验DPPH自由基清除率测定试验,由于其稳定性高、结果重现性好,且在同一测试条件下结果具有极大的可比性。由研究结果可见白芍多糖4个组分在体外抗氧化活性总体效果较弱,如图2所示。PRPS80和PRPS60在试验所用浓度范围内尚呈现一定的浓度依赖性,尤其是PRPS80可以说是白芍多糖体外抗氧化的活性组分,但和抗坏血酸相比,其抗氧化作用较弱(PRPS80组分的IC50为0.086 mg/mL,抗坏血酸的IC50为0.008 mg/mL)。白芍多糖体外抗氧化作用虽然较弱,但不能代表白芍多糖在体内抗氧化的真实情况,任何体外抗氧化的化学模式都不可能完全模拟体内真实生理环境下的抗氧化作用。白芍多糖体内抗氧化作用结果提示PRPS40组分高剂量组(预试验表明200 mg/kg作用明显,中低剂量组(50、100 mg/kg)效果不显著,P>0.05)在对抗衰老小鼠试验中表现出了一定的抗氧化作用,PRPS40组分多糖可以升高SOD、GSH-Px活力,降低MDA水平,体现出了明显的体内抗氧化作用,而其他3个组分作用则不明显,提示PRPS40组分是白芍多糖是体内抗氧化作用的物质基础,是起到体内抗氧化的活性多糖组分[10]。PRPS40组分仍不是分子量均一的多糖化学成分,课题组将进一步对PRPS40组分进行分离纯化,继续寻求分子量均一的多糖化学成分,并对其进行结构表征和生物学活性的深入研究。通过本试验研究,以期为多糖抗氧化活性成分的深入研究提供思路和借鉴。
