白桦脂醇通过抑制PI3K/AKT途径抑制宫颈癌小鼠移植瘤增殖①
2019-06-24刚小青吴衡慧周文磊
刚小青 吴衡慧 周文磊
(河南省人民医院妇科,郑州 450000)
宫颈癌是全球主要的健康问题,是女性癌症死亡的第二常见原因,每年造成27万人死亡[1],占癌症死亡人数的8%[2]。尽管已经为预防宫颈癌做出了努力,但在过去的几十年里,子宫颈癌的发病率仍在增加[1]。标准治疗包括手术治疗、放疗和化疗。化疗有很大的副作用,比如顺铂,不仅对人体产生严重的副作用还会使肿瘤产生耐药性[3]。因此,迫切需要开发其他治疗宫颈癌的药物[4]。白桦脂醇(Betulin)是一类可以从多种植物中提取的带有羽扇烷骨架[3β-lup-20(29)-en-3,28-diol]的五环三萜类化合物[5]。白桦脂醇拥有广泛的生物学活性,如抗癌、抗病毒和抗炎作用[6,7],已经被证明对几种类型的癌症细胞有抑制作用,包括RCC4、DLD-1、PC-3、HeLa、SK-HEP-1、HepG2、A549和MCF-7细胞,其机制是通过诱导凋亡相关的线粒体通路促进肿瘤细胞凋亡,发挥抗肿瘤活性[8,9]。然而,白桦脂醇对宫颈癌细胞系c4-1的体内外研究还未见报道。多数关于三萜化合物,包括白桦脂醇或桦木酸抗肿瘤性质的数据,都是从体外研究得来的。本研究的目的是体内研究白桦脂醇是否抑制宫颈癌细胞系c4-1裸鼠移植瘤的生长及可能的作用机制。
1 材料与方法
1.1材料
1.1.1主要试剂 白桦醇酯购自美国Selleck公司,分子式为C30H50O2,分子量 442.72,纯度=99.05%;TUNEL试剂盒(In Situ Cell Death Detection Kit)购自罗氏(Roche);抗Ki67和抗VEGF免疫组化抗体购自赛默飞世尔公司;抗PI3K和磷酸化PI3K(P-PI3K)、抗AKT和磷酸化AKT(P-AKT)抗体购自Abcam公司;苏木素伊红(HE)染色试剂盒购自Solarbio公司;Waymouth′s MB 752/1 培养基和胎牛血清购自美国Gibco公司。
1.1.2细胞系和实验动物 宫颈癌细胞系c4-1 (ATCC®CRL-1594TM)购自ATCC,培养于完全培养基Waymouth′s MB 752/1 含10%胎牛血清,37℃恒温培养于CO2培养箱中。无病原体(SPF级)雌性裸鼠(BALB/c),13~15 g,4周龄,购自上海赛莱科实验动物有限公司。裸鼠在无病原体条件下喂养,并根据国家卫生研究院对实验动物的护理和使用进行研究。所有动物的手术和护理都得到了机构伦理委员会的批准。
1.2方法
1.2.1移植瘤模型建立和分组 白桦醇酯溶解到DMSO中,配制成20 mg/ml储藏液。异种移植瘤模型建立:将1×106宫颈癌细胞系c4-1细胞(100 μl)通过皮下注射植入6周的雌性BALB/c裸鼠,7 d内异种移植瘤出现表示模型建立成功,随后分为:对照组(DMSO)、白桦脂醇低剂量组(Betulin 50):模型组裸鼠腹腔注射Betulin 50 mg/kg体重、白桦脂醇高剂量组(Betulin 200):模型组裸鼠腹腔注射Betulin 200 mg/kg体重;腹腔注射药物或DMSO持续1周,3次/d。
1.2.2肿瘤体积测定和裸鼠生存率测定 肿瘤大小用长径(L)和短径(W)计算,计算公式为:肿瘤体积V (mm3) =L×W2/2。用游标卡尺每5 d测量一次。在停止治疗30 d后,采取颈椎脱臼处死裸鼠。将3组裸鼠培养30 d,每天记录存活裸鼠数量,制成存活曲线。
1.2.3免疫组化 免疫组化检测Ki67和VEGF表达。切片脱蜡复水处理,用3%过氧化氢在37℃处理10 min。然后,用10%正常山羊血清在37℃封闭30 min。随后,在4℃过夜孵化抗Ki67和VEGF抗体。用PBS冲洗3次后,在室温下孵育二抗30 min,然后加入显色试剂3′3′-二氨基苯胺,用光学显微镜观察凋亡细胞并拍照。
1.2.4TUNEL染色 二甲苯脱蜡,每次5 min ;梯度乙醇(100%、95%、90%、80%、70%)复水,每次3 min;Proteinase K 工作液在25℃消化组织15 min ;PBS 漂洗;按照说明书进行TUNEL染色,漂洗;玻片干燥后加50 μl converter-POD 于标本上,加盖玻片在暗湿盒中37℃反应30 min,漂洗;在组织处加50 μl DAB 底物,在25℃下反应10 min,漂洗;拍照,然后用苏木素复染3~5 s,立即用自来水冲洗。梯度酒精脱水、二甲苯透明、中性树胶封片。加一滴PBS在视野下,用光学显微镜观察TUNEL阳性细胞。
1.2.5Western blot检测蛋白相对表达水平 液氮研磨各组肿瘤组织,冰上裂解,提取组织中总蛋白;用BCA试剂盒进行蛋白定量;取等量蛋白与Loading buffer混合,100℃金属浴10 min;离心,取上清上样到SDS-PAGE凝胶电泳中分离蛋白,并转移至 0.22 μm 孔径的PVDF膜;5%的脱脂奶粉室温封闭1~2 h;加入抗PI3K及磷酸化PI3K(p-PI3K)和AKT及磷酸化AKT(p-AKT)的一抗,4℃过夜孵育,次日,TBST清洗后再加标记HRP的二抗,室温孵育1 h,清洗。最后加入ECL发光液,于凝胶成像系统进行曝光拍照,并用Image J软件统计灰度值计算相对表达量。GAPDH作为内参,进行3次独立的重复实验。
1.3统计学分析 本实验所有对比数据用SPSS 16.0软件进行统计学分析,两两比较用独立的t检验,分析比较处理组与对照组之间肿瘤体积、裸鼠存活率、凋亡率以及蛋白表达的差异。以上各组检验标准取P<0.01为差异具有显著统计学意义。
2 结果
2.1白桦脂醇减小宫颈癌c4-1移植瘤体积 观察3组移植瘤并拍照,分别计算3组移植瘤的体积。如图1A所示,对照组(DMSO)肿瘤明显较大,且含有丰富的血管,而白桦脂醇低剂量组(Betulin 50)和白桦脂醇高剂量组(Betulin 200)肿瘤依次较小,且看不到明显的血管组织。统计肿瘤体积,如表1和图1B所示,白桦脂醇低浓度和高浓度均能抑制肿瘤体积增长(P<0.01)。
2.2白桦脂醇提高宫颈癌c4-1移植瘤裸鼠生存率 白桦脂醇移植瘤模型建立后,每天统计裸鼠的存活率。存活曲线如图2所示,可以看到,对照组(DMSO)没有进行治疗,注射10 d后生存率显著下降(P<0.01);而注射白桦脂醇的低剂量组(Betulin 50)和高剂量组(Betulin 200)10 d后存活率没有下降,且高剂量组(Betulin 200)存活率>低剂量组(Betulin 50)存活率(P<0.01)。
2.3白桦脂醇下调c4-1移植瘤中Ki67和VEGF蛋白表达 免疫组化原位检测Ki67和VEGF的表达情况,如图3A、B所示,同一视野下,对照组(DMSO)Ki67和VEGF阳性细胞较多;与对照组(DMSO)相比,加药组(Betulin 50)和(Betulin 200)染色细胞大大减少。白桦脂醇明显减少c4-1移植瘤中Ki67阳性细胞率和VEGF阳性细胞率(P<0.01)。
2.4白桦脂醇促进c4-1移植瘤细胞凋亡 TUNEL结果如图4A所示,对照组(DMSO)染色细胞很少;与对照组(DMSO)相比,加药组(Betulin 50)和(Betulin 200)染色细胞明显增加(P<0.01),尤其是(Betulin 200)组,出现了大量染色的凋亡阳性细胞。统计凋亡细胞数结果如图4B所示,明显看出低浓度和高浓度白桦脂醇均能促进c4-1细胞凋亡。

图1 白桦脂醇减小宫颈癌c4-1移植瘤体积Fig.1 Betulin reduced tumor volume of cervical cancer c4-1 xenograft tumorNote: *.P<0.01 vs DMSO group.
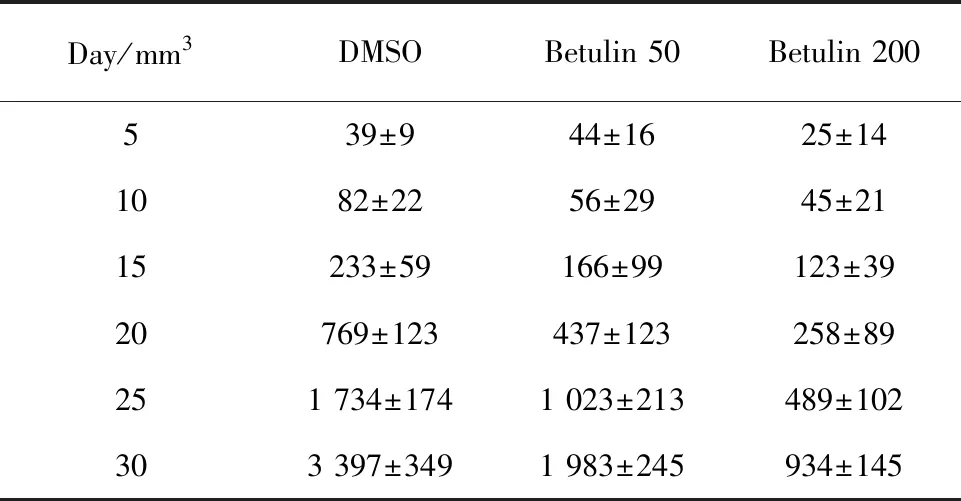
表1 肿瘤体积Tab.1 Tumor volume
2.5白桦脂醇抑制PI3K/AKT信号 磷脂酰肌醇3-激酶(PI3K)/AKT通路是细胞中抑制凋亡的重要通路。Western blot 分析肿瘤中P-PI3K/AKT表达情况,如图5A所示,对照组(DMSO)P-PI3K/AKT呈高表达状态;与对照组(DMSO)相比,加药组(Betulin 50)和(Betulin 200)P-PI3K/AKT表达水平明显被抑制(P<0.01)。统计灰度值,计算P-PI3K/PI3K、P-AKT/AKT的比值,如图5B所示,低浓度和高浓度白桦脂醇抑制PI3K/AKT磷酸化激活,从而抑制该通路。
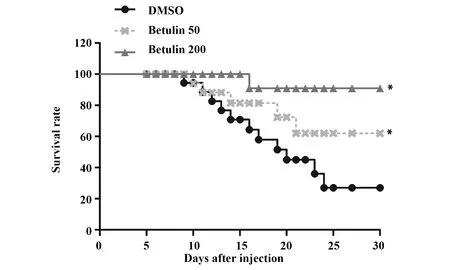
图2 白桦脂醇提高宫颈癌c4-1移植瘤裸鼠生存率Fig.2 Betulin improved survival rate of nude mice with cervical cancer c4-1 xenograft tumorNote: *.P<0.01 vs DMSO group.
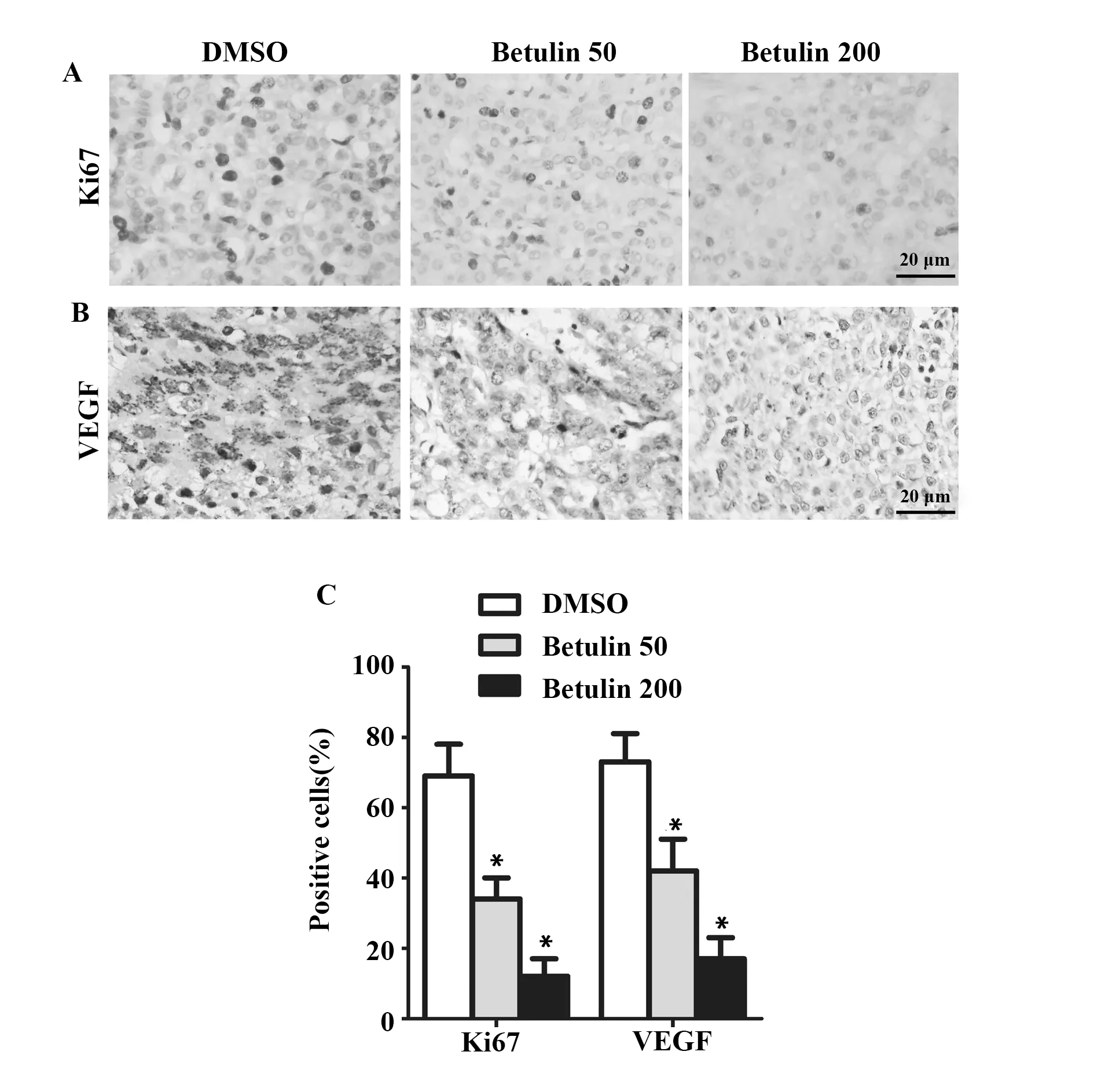
图3 白桦脂醇降低Ki67 和VEGF的表达水平Fig.3 Betulin decreased expression levels of Ki67 and VEGFNote: *.P<0.01 vs DMSO group.
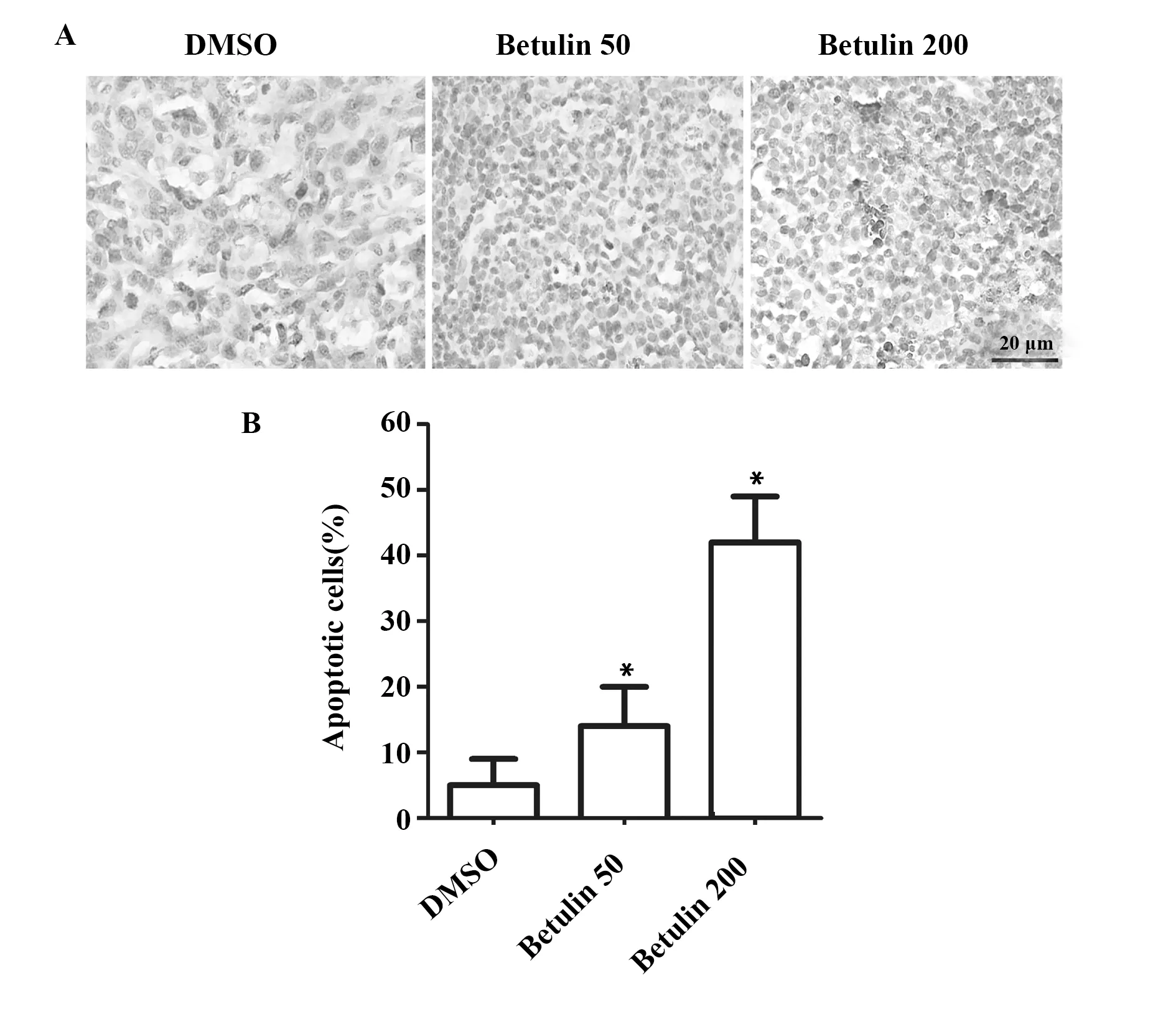
图4 白桦脂醇促进c4-1移植瘤细胞凋亡Fig.4 Betulin promoted apoptosis of tumor cells in cervical cancer c4-1 xenograft tumorNote: *.P<0.01 vs DMSO group.

图5 白桦脂醇抑制PI3K/AKT信号通路Fig.5 Betulin inhibited PI3K/AKT signaling pathwayNote: *.P<0.01,vs DMSO group.
3 讨论
天然化合物诱导癌细胞凋亡是治疗和预防肿瘤的机制之一。白桦脂醇是一种具有药理活性的三萜,天然存在于桦树皮中。有研究报道,白桦脂醇在人肺、宫颈癌和肝癌细胞中具有抗癌作用[11]。宫颈癌在盆腔和盆腔主动脉淋巴结的扩散是常见现象,宫颈癌患者的预后不良主要来源于高频率的转移[12]。如果宫颈癌细胞的高转移能力可以通过“靶向”治疗有效地消除,那么宫颈癌患者的预后就可以大大改善。肿瘤血管生成在肿瘤的生长、侵袭和转移过程中起着重要的作用。血管内皮生长因子(VEGF),通过自分泌和或旁分泌机制促进肿瘤血管生成和肿瘤侵袭。VEGF的表达增加,促进肿瘤血管生成[13]。因此,下调VEGF的表达可能有效抑制肿瘤促血管生成作用。本文研究结果表明,白桦脂醇抑制宫颈癌c4-1移植瘤的生长,支持证据为白桦脂醇治疗后,肿瘤体积明显减小;Ki67表达降低。同时,本研究还观察到白桦脂醇下调宫颈癌c4-1移植瘤中VEGF表达,且观察到移植瘤血管减少。表明白桦脂醇抑制宫颈癌c4-1移植瘤的血管生成。该研究结果提示白桦脂醇可能通过抑制血管新生,使肿瘤生长减缓或抑制肿瘤生长或由于血供不足而诱导肿瘤凋亡。上述证据表明,白桦脂醇抑制宫颈癌c4-1移植瘤生长和存活。
药物的抗肿瘤活性一般体现在抑制生长,抑制生长的主要方式一般为促凋亡和抑制增殖两个方面。因此,本文检测了白桦脂醇对宫颈癌c4-1移植瘤细胞凋亡的影响。前人研究表明,白桦脂醇可以促进多种癌细胞凋亡。例如,白桦脂醇可以通过调节TRAIL受体和TNFR1从而调节抗凋亡或促凋亡蛋白的表达进而促进人肾癌细胞RCC4凋亡[8];白桦脂醇可促进人类黑色素瘤细胞518A2、人肺癌细胞A549、头颈癌细胞、乳腺癌细胞MCF-7和结肠癌细胞 HT-29凋亡[14]。本文TUNEL实验证明白桦脂醇可以促进宫颈癌c4-1细胞凋亡,与上述研究结果一致。
据报道,三萜类化合物通过调节PI3K/Akt通路诱导细胞周期阻滞和凋亡[15]。PI3K/Akt是一种细胞内信号通路,在调节多个细胞过程中起重要作用。PI3K/Akt通路的激活已被证实能促进癌细胞的细胞存活[16]。PI3K/Akt信号通路是一个重要的抗癌靶点,尤其是线粒体凋亡,因为Akt通过蛋白翻译途径对线粒体呼吸活动进行调控[17,18]。生长因子和激素触发一个PI3K磷酸化事件,进而协调细胞生长、细胞周期进入、细胞迁移和细胞存活[19]。此外,PI3K通路通过下游分子Akt发挥作用,调节各种细胞功能,包括细胞增殖、细胞转化、细胞凋亡、肿瘤生长和血管生成[20,21]。鉴于PI3K/Akt在肿瘤细胞中的重要作用,本文探究了白桦脂醇是否改变了c4-1细胞中 PI3K、AKT表达和磷酸化状态。本文Western blot 实验结果证明,白桦脂醇明显抑制了PI3K、AKT磷酸化水平,抑制了PI3K/Akt信号激活,抑制宫颈癌c4-1移植瘤存活。本研究表明白桦脂醇是通过调节PI3K/Akt信号诱导宫颈癌细胞凋亡,与上述白桦脂醇抗肾癌机制研究有所不同。说明白桦脂醇在不同癌细胞中的作用机制可能不一样,或存在交叉调控,需要进一步研究。
综上所述,三萜化合物白桦脂醇可以通过抑制PI3K/Akt信号通路,从而下调Ki67和VEGF表达,促进宫颈癌c4-1移植瘤细胞凋亡,最终导致宫颈癌c4-1移植瘤存活抑制。本文研究补充了白桦脂醇抗癌的相关机制,并提示白桦脂醇可能作为治疗宫颈癌的潜在药物。