虎杖苷对非酒精性脂肪肝的影响及相关分子机制探究①
2019-06-24刘皎皎何瑾瑜李瀚旻
刘皎皎 戴 玲 董 璐 何瑾瑜 李瀚旻
(陕西省中医医院,西安 710003)
非酒精性脂肪肝病(Non-alcoholic fatty liver disease,NAFLD)是指除酒精和其他明确因素对肝造成损伤,以肝细胞内脂肪堆积为主的一类综合征,包括单纯性脂肪肝、非酒精性脂肪性肝炎(Non-alcoholic steatohepatitis,NASH)、肝纤维化和肝硬化[1]。其相关发病机制尚未完全阐明。有研究报道,胰岛素抵抗、氧化反应、脂质在肝脏蓄积以及炎症反应这几个方面与NAFLD的发病密切相关[2,3]。目前缺乏针对NAFLD有效的治疗手段,临床上主要使用胰岛素增敏剂、抗氧化剂、调脂药以及护肝药物治疗NAFLD,但治疗效果不尽人意,并且临床及实验发现部分药物会产生明显的毒副作用,对患者自身伤害较大。而中医药治疗NAFLD具有多角度、多层次、多途径、多靶点,且疗效稳定持久,毒副作用较小等优势,已成为目前研究的热点[4]。
虎杖苷是一种多酚、非黄酮类植物抗毒素,在虎杖、葡萄和花生中的含量较高。研究报道,虎杖苷具有抗炎、抗肿瘤、抗氧化、诱导细胞凋亡以及抗心血管疾病等作用[5]。虎杖具有清热、破瘀及利湿等功效,自古以来常用来治疗肥胖、黄疸、胁痛等疾病[6],虎杖苷作为中药虎杖的主要活性成分之一,在降脂、保护肝细胞等方面具有重要的效果。目前,研究表明虎杖苷能够降低大鼠体重、血脂,且能改善肝功能异常,在治疗非酒精性脂肪肝治疗中显现初步的疗效[7,8],而本实验旨在进一步阐明其相关机制,为临床使用虎杖苷治疗NAFLD奠定基础。
1 材料与方法
1.1动物与试剂 健康的雄性SD大鼠42只,体重180~200 g,SPF级,由陕西省中医医院实验动物中心提供,动物许可证号:SCXK(陕)2013-003。虎杖苷(>98%,HPLC,购自南京广润生物制品有限公司,批号:GR-133-131018);谷胱甘肽-S-转移酶(GST)测定试剂盒、超氧化物歧化酶(SOD)测定试剂盒、微量丙二醛(MDA)测定试剂盒、血糖测定试剂盒均购自南京建成生物工程研究所;大鼠胰岛素酶联免疫分析试剂盒购自上海江林生物科技有限公司。PPAR-α一抗(Abcam,ab8934)、LXR-α一抗(Abcam,ab176323)、SREBP-1c一抗(Abcam,ab28481),羊抗兔二抗(cell signaling technology,#5151)。
1.2方法
1.2.1动物模型的建立与分组 大鼠称重后分笼喂养,正常喂养1周后随机分为5组:正常组(A组,9只)、模型组(B组,9只)、虎杖苷剂量组1[C1组,8只,50 mg/(kg·d)]、虎杖苷剂量组2[C2组,8只,100 mg/(kg·d)]以及虎杖苷剂量组3[C3组,8只,200 mg/(kg·d)]。5组大鼠体质量差异无统计学意义(P>0.05)。A组给予标准饲料,其他4组大鼠给予高脂饲料,造模期间实验动物自由进食和饮水,动物房保持安静,自然采光,温度保持25℃左右。喂养持续8周后,从A组和B组中随机挑选1只大鼠,取肝脏做病理切片,验证模型组大鼠非酒精性脂肪肝的形成。依据《NASH 临床研究网病理工作组指南》内容对肝组织病理学和形态学进行评价[9],并对NAS积分进行统计学分析。
1.2.2给药 A组和B组给予生理盐水灌胃,5 ml/次。C1、C2、C3组分别以50、100、200 mg/(kg·d)的虎杖苷混悬液灌胃,持续4周。
1.2.3检测指标 ①造模后第12周当晚大鼠禁食不禁水,次日腹腔注射麻醉,腹动脉取血10 ml,离心分离血清,-20℃保存。迅速提取肝脏称重,生理盐水冲洗后在肝右叶边缘1 cm处横切2块肝组织,一块用中性福尔马林固定,进行HE染色后观察病理学改变,另一块用来制备组织匀浆。②按照试剂盒说明书测定GST、SOD及MDA含量。③提取组织匀浆中总RNA,逆转录合成cDNA后进行实时定量PCR检测炎性因子肿瘤坏死因子-α(TNF-α)和白细胞介素-6(IL-6)表达水平。PCR扩增引物序列为TNF-α上游引物:5′-ATGAGCACAGAAAGCATGATG-3′,下游引物:5′-TACAGGCTTGTCACTCGAATT-3′;IL-6上游引物:5′-TTGCCGAGTAGACCTCATAGTGACC-3′,下游引物:5′-CAAGAGACTTCCAGCCAGTTGC-3′。④按照试剂盒说明书,采用酶法测定血清血糖(FBG),采用放射免疫方法测定空腹胰岛素水平(FNS)。并计算胰岛素抵抗指数(IRI)=FBF×FNS/22.5;胰岛素敏感指数(ISI)=1/(FBG×FNS)。⑤提取肝组织蛋白,采用Western blot方法检测PPAR-α、LXR-α、SREBP-1c蛋白的表达。
2 结果
2.1肝脏大体性状和病理观察 A组大鼠肝脏包膜光滑完整,表面颜色呈暗红色,光润,边缘锐利,切面细颗粒感,无油腻感。B组大鼠肝脏呈棕黄色,无光泽,表面细小颗粒感,边缘钝。虎杖苷组大部分颜色暗红,润泽,切面无油腻感。C1及C2组大鼠肝脏呈淡黄色,切面油腻感。
A组肝细胞小叶结构清晰,胞浆均质红染,小静脉、胆管和汇管区小动脉结构正常,肝索排列整齐,肝窦清晰可见,肝细胞胞浆粉染,颗粒大小均匀。模型组肝细胞肿胀,多数肝细胞内可见大小不等的脂滴空泡,部分肝细胞呈气球样变,肝索排列紊乱。C3组有明显改善,其脂肪滴与模型组相比明显减少,如图1。同时, 对肝组织病理学和形态学进行评价后,各组NAS 积分情况如表1所示,虎杖苷能降低NAFLD大鼠模型的NAS积分,差异具有统计学意义(P<0.05),表明虎杖苷对NAFLD具有一定的治疗作用。
2.2虎杖苷对各组大鼠肝组织氧化应激的影响 结果如表2所示,与A组比较,B组SOD和GST含量均显著性降低,而MDA显著性升高。与B组比较,虎杖苷各剂量组中SOD和GST含量显著性升高,而MDA显著性降低,差异具有统计学意义(P<0.05)。
2.3虎杖苷对各组大鼠TNF-α、IL-6 mRNA表达的影响 与A组比较,B组TNF-α、IL-6 mRNA表达均显著性增加,给予虎杖苷后,大鼠肝脏中TNF-α、IL-6 mRNA表达明显降低。与B组比较,C2及C3组TNF-α表达显著性降低,C1、C2及C3组IL-6表达显著性降低,差异具有统计学意义(P<0.05),如图2。

图1 各组大鼠肝组织HE染色(×400)Fig.1 HE staining of liver tissue of each group of rats(×400)
2.4虎杖苷对各组大鼠体内IR的影响 如表3所示,与A组比较,B组FBG、FNS及IR显著性升高,而ISI显著性降低。与B组比较,C2及C3组FBG、FNS及IR显著性降低,而ISI显著性升高,差异具有统计学意义(P<0.05)。
2.5虎杖苷对各组大鼠PPAR-α、LXR-α、SREBP-1c蛋白表达的影响 结果如图3所示,与A组比较,B组PPAR-α蛋白表达显著性降低,LXR-α、SREBP-1c蛋白表达显著性增加,差异具有统计学意义(P<0.05)。与B组比较,C2和C3组LXR-α、SREBP-1c表达显著性下调,而PPAR-α蛋白无明显变化。

表1 NAS积分在各组间的比较情况Tab.1 Comparison of NAS scores between
Note:Compared with group A,1)P<0.05;compared with group B,2)P<0.05.
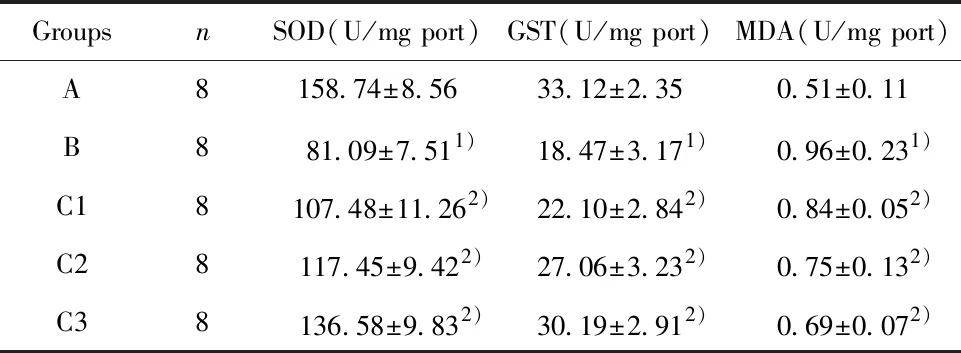
表2 虎杖苷对各组大鼠肝组织氧化应激的影响Tab.2 Effect of polydatin on oxidative stress in liver tissue of rats in each group
Note:Compared with group A,1)P<0.05;compared with group B,2)P<0.05.
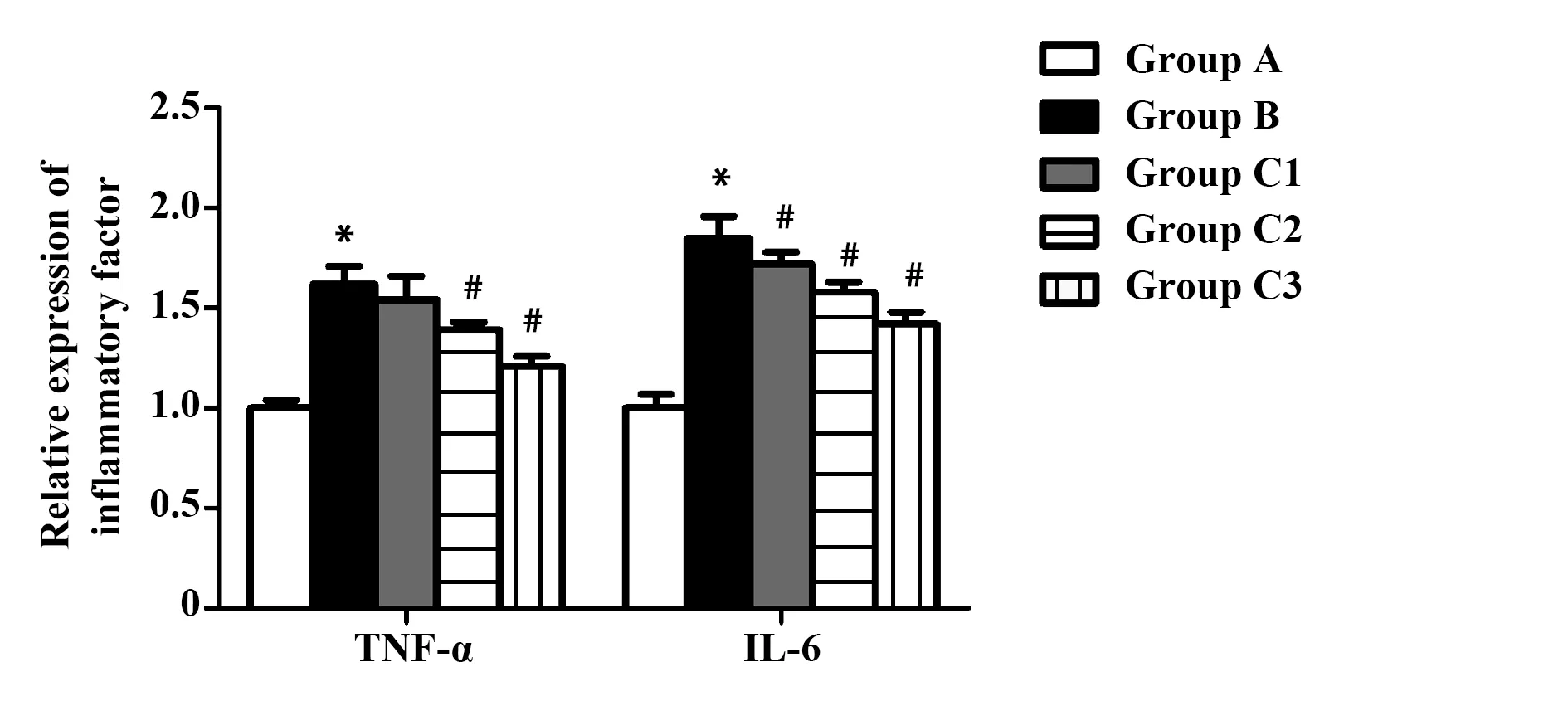
图2 虎杖苷对各组大鼠TNF-α、IL-6 mRNA表达的影响Fig.2 Effect of polydatin on expression of TNF-α and IL-6 mRNA in each groupNote: Compared with group A,*.P<0.05;compared with group B,#.P<0.05.

表3 虎杖苷对各组大鼠体内IR的影响Tab.3 Effect of polydatin on IR in rats
Note:Compared with group A,1)P<0.05;compared with group B,2)P<0.05.
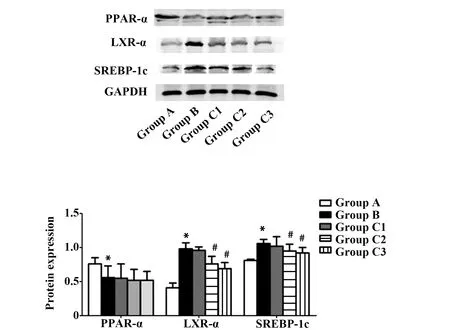
图3 虎杖苷对各组大鼠PPAP-α、LXR-α、SREBP-1c蛋白表达的影响Fig.3 Effect of polydatin on expression of PPAP-α,LXR-α and SREBP-1c in ratsNote: Compared with group A,*.P<0.05;compared with group B,#.P<0.05.
3 讨论
NAFLD是一类与遗传、环境和代谢相关的疾病,目前尚缺乏有效的治疗药物。NAFLD多系过食肥甘厚味,临床多以肥胖、乏力,胁肋部隐痛或胀痛,口苦,舌苔黄、厚等为主要表现,属中医“肥胖”、“黄疸”、“肝胀”、“胁痛”等范畴[10]。而虎杖苷作为虎杖中重要的活性成分,药理学研究表明其具有降血脂,保肝作用,但相关机制尚未阐明,因此,本研究旨在探究虎杖苷对NAFLD的影响的相关分子机制。
肝细胞内含有大量的线粒体可以产生ATP,为肝细胞提供能量,并在此过程中产生大量的活性氧[11]。如果没有相应的抗氧化机制,很容易引起肝细胞损伤[12]。本实验结果发现,模型组大鼠脂质大量沉积,肝组织SOD、GST显著性降低,MDA显著性升高,因此,氧化应激在脂肪肝的形成和进展中可能发挥了重要的作用。而给予大鼠虎杖苷后,其SOD和GST的含量明显升高,且MDA明显降低,起到了明显的抗氧化作用。同时剂量越大,效果越明显。因此,虎杖苷可能是通过抗氧化作用,抑制脂质过氧化,减轻肝脏沉积来治疗NAFLD。
长期高脂饮食会导致肝脏产生炎症因子,其中TNF-α可以诱导成纤维细胞、血管内皮细胞和平滑肌细胞产生粒细胞巨噬细胞集落刺激因子,介导炎症反应、脂质代谢、免疫调节和抗肿瘤等作用[13,14]。IL-6是多种炎性疾病重要的炎症介质[15,16]。本实验结果发现,长期高脂饮食会导致炎症基因如TNF-α、IL-6等表达明显上调,而虎杖苷对其有显著的抑制作用。因此,虎杖苷可以抑制机体炎症反应,从而起到保护肝脏的作用。
胰岛素抵抗是指机体组织对胰岛素敏感性降低或胰岛素信号传导存在缺陷而导致机体对一定量的胰岛素生物学效应低于正常水平的现象。早期研究发现,多数NAFLD患者存在胰岛素抵抗[17-20]。本实验结果表明,NAFLD模型大鼠血清血糖、胰岛素、胰岛素抵抗指数显著性增加,胰岛素敏感指数明显降低,因此IR在NAFLD形成中起到了重要的作用。与模型组比较,虎杖苷C2、C3剂量组能显著性降低胰岛素抵抗指数,增加胰岛素敏感指数,从病理上显著性减轻肝细胞脂质沉积,表明虎杖苷能够减轻NAFLD大鼠胰岛素抵抗,增加胰岛素敏感性。
肝细胞内有两组脂肪调控基因,分别为脂肪合成基因和脂肪酸氧化基因。肝细胞脂质合成基因受孤核受体SREBP-1c的调控,研究发现SREBP-1c高表达使肝细胞脂肪酸合成增加,导致脂肪酸和三酰甘油在肝细胞内堆积从而形成脂肪肝,抑制SREBP-1c下调脂质合成基因的表达[21]。脂肪酸氧化基因受孤核受体PPAR-α的调控,PPAP-α的活化可上调脂肪酸氧化基因的表达。SREBP-1c对代谢的调控是通过多个转录子间的相互作用实现的,如LXR-α等。LXR-α在肝脏呈高表达,研究发现LXR-α可被细胞内升高的胆固醇水平活化,进而诱导一系列参与胆固醇吸收、转运和分泌基因的表达[22]。本实验研究结果表明,与对照组比较,模型组PPAR-α蛋白表达显著性降低,LXR-α、SREBP-1c蛋白表达显著性增加,因此,PPAR-α、LXR-α和SREBP-1c蛋白在NAFLD形成中发挥了重要作用。尽管虎杖苷各剂量组并不能上调PPAR-α的表达,但能下调LXR-α和SREBP-1c的表达,因此虎杖苷可能通过下调LXR-α表达,抑制其与RXR的结合,从而导致SREBP-1c基因表达下调。
综上研究,虎杖苷可能是通过抗氧化作用、抑制脂质过氧化,抑制机体炎症反应,降低胰岛素抵抗,下调脂质合成因子SREBP-1c和LXR-α蛋白的表达,减少脂质合成等关键途径来治疗NAFLD。