扩散峰度成像诊断直肠腺癌:与DWI对比分析
2019-06-24印隆林彭盛坤
周 蜜,印隆林,彭盛坤
(四川省医学科学院 四川省人民医院放射科,四川 成都 610072)
直肠癌是常见的消化道恶性肿瘤。在美国,结直肠癌位列常见肿瘤及因癌死亡的第3位[1]。近年来我国直肠癌的发病率越来越高,沿海地区已经接近或达到结直肠癌高发国家水平[2]。正确诊断直肠癌对选择治疗方案十分重要。DWI单指数模型及DTI模型认为水分子的扩散呈高斯分布,生物组织中水分子以自由、非受限的形式进行扩散运动[3]。扩散峰度成像(diffusion kurtosis imaging, DKI)基于非高斯扩散理论[4-5],最初主要应用于神经领域[6],随着DKI对肿瘤鉴别和分级作用的凸显,已逐渐用于诊断前列腺及其他组织器官疾病[7]。本研究探讨DWI的ADC值及DKI各参数在直肠癌诊断中的价值,以及ADC值与DKI各参数间的关系。
1 资料与方法
1.1 一般资料 回顾性分析2017年1—6月就诊于我院经手术病理证实为直肠癌并顺利完成MR检查(包括常规MR扫描序列、DWI及DKI)的38例患者(直肠腺癌组)的资料,男28例,女10例,年龄25~80岁,平均(54.6±12.9)岁。纳入标准:①检查前1周未接受手术或放化疗;②图像无运动伪影;③术后病理活检证实为直肠腺癌。排除标准:①MRI伪影严重,不能满足诊断需求;②MR检查后10天内未接受手术治疗;③手术前接受放化疗;④术后病理结果为黏液腺癌、腺瘤、炎症;⑤病灶小,无法进行ROI测量。
另收集年龄、性别与直肠腺癌组相匹配的健康志愿者38名(正常对照组),男28名,女10名,年龄25~80岁,平均(53.1±11.2)岁。纳入标准:可耐受检查;无肠道疾病;未接受放化疗;MRI未见明显异常。本研究经我院医学伦理委员会审批通过,受试者均签署知情同意书。
1.2 仪器与方法 采用Siemens Magnetom Aera 1.5T超导MR系统,32通道体部阵列线圈。常规扫描序列:轴位TIW正反相位GRE序列,TR 262 ms,TE 2.62 ms,FOV 400 mm×320 mm,矩阵256×256,层厚6 mm,层间距1.2 mm,NEX 1;高清T2W序列,TR 7 520 ms,TE 96 ms,FOV 160 mm×160 mm,矩阵360×512,层厚3 mm,层间距0,NEX 2,体素0.3 mm×0.3 mm×0.3mm。单b值DWI采用轴位单次激发自旋平面回波序列,TR 5 498 ms,TE 76 ms,b值为1 000 s/mm2,FOV 330 mm×258 mm,矩阵256×256,层厚6 mm,层间距1.2,NEX 2。DKI:TR 6 200 ms,TE 78 ms,b值为0、250、500、750、1 000、1 500、2 000 s/mm2,NEX从2开始依次加1,FOV 330 mm×258 mm,矩阵192×192,层厚6.5 mm,层间距1.3 mm,每个b值扩散敏感梯度场施加的方向数为15个,扫描时间10 min 42 s。
1.3 图像后处理 以DICOM格式存储所需MRI图像。采用Matlab 2013b软件获取DKI参数。将DKI扫描所得图像导入后处理软件dkiMain,经calculate处理,生成代表扩散信息的平均扩散系数(mean diffusivity, MD)和平均扩散峰度(mean kurtosis, MK)图像。由1名具有8年盆腔系统疾病诊断经验的放射科医师于肿瘤最大面积层面放置ROI(面积7.12~9.68 mm2),测量MK及MD值,尽量避开坏死、囊变部位;于ADC图中肿瘤最大层面放置ROI(面积6.58~9.47 mm2),测量ADC值,避开囊变、坏死及血管走行区。所有参数分别测量3次,取均值。
1.4 统计学分析 采用SPSS 21.0统计分析软件。计量资料以±s表示。数据不符合正态分布,采用Mann-WhitneyU检验比较2组各参数的差异。以病理结果为金标准,绘制ROC曲线,计算AUC,根据最大约登指数确定阈值,评价各参数对直肠腺癌的诊断效能。采用Spearman秩相关分析ADC值与MD和MK值的相关性。P<0.05为差异有统计学意义。
2 结果
术后病理证实38例直肠腺癌中,10例为高分化腺癌,13例为中分化腺癌,15例为低分化腺癌;病理T分期≤T2期8例,T3期17例,T4期13例。
与正常对照组比较,直肠腺癌组MK值升高,MD值、ADC值降低,差异均有统计学意义(Z=-6.163、-5.014、-4.801,P均<0.001),见表1和图1、2。
以MK、MD及ADC值诊断直肠腺癌的ROC曲线见图3,AUC分别为0.911、0.888及0.827(P均<0.05),分别以MK值0.59、MD值2.15×10-3mm/s2、ADC值1.35×10-3mm/s2为阈值,诊断直肠腺癌的敏感度、特异度见表2。

图1 患者男,58岁,直肠中分化腺癌T3期 A.直肠癌管壁呈不规则增厚且肿块呈稍长T2信号; B~D.分别为MK、MD、ADC图,MK、MD、ADC值分别为0.895、1.61×10-3mm/s2、0.91×10-3mm/s2; E.病理表现(HE,×200)
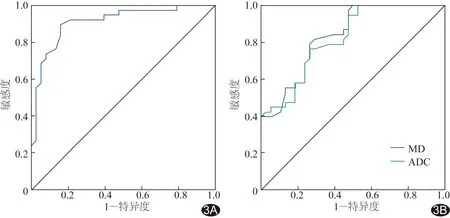
图3 以MK、MD及ADC值诊断直肠腺癌的ROC曲线 A.以MK值进行诊断的AUC为0.911; B.以MD及ADC值进行诊断的AUC分别为0.834及0.820
ADC值与MK值呈负相关(r=-0.460,P<0.05),与MD值呈正相关(r=0.994,P<0.05)。
3 讨论
对直肠肿瘤进行准确分期和分级有助于治疗及改善预后。DWI是一种非侵入性的功能成像技术,可提供肿瘤微环境中水分子扩散的信息;而DKI可提供更多关于病变的有效信息。研究[8]表明DKI可用于评估脑部疾病(如脑卒中、帕金森病等)患者病变水分子非高斯分布特征。本研究对比观察DKI和DWI在直肠腺癌中的应用价值。
ADC值可反映水分子扩散受限状态,组织细胞密度越大,分子扩散越受限,ADC值越低,反之越高。恶性病变细胞分化速度快,同时在大分子物质和细胞膜的限制下水分子扩散受限[9],使ADC值减低。本研究中直肠腺癌组ADC值低于正常对照组(P<0.001),与既往研究[10]结果一致。孙应实等[11]研究证实直肠癌DWI的最佳b值为1 000 s/mm2,此时可较好地克服灌注、T2穿透效应的影响。但测量ADC值是基于水分子的扩散符合高斯分布,而人体由不同组织构成,各组织的细胞类型、细胞密度及血供情况均有差异,水分子的扩散呈非高斯分布[12]。DKI为单次激发的平面回波序列,采用7个不同b值、3个互相垂直的扫描方向;MK值由各方向的平均表观峰度系数(apparent kurtosis coefficient, AKC)计算所得;MK值越大,代表目标组织内结构越复杂,故可用于衡量组织结构的复杂性[13]。恶性病变间质血管丰富,由此推测恶性病变MK值应高于正常组织,本研究结果证实了这一点。MD值类似于DWI单指数模型的ADC值,反映人体内水分子的扩散状态;恶性病变细胞排列紧密,限制水分子的扩散,其MD值减低,故推测恶性病变的MD值应低于正常组织,本研究同样证实了上述推断。本研究2组ADC值、MD值和MK值差异均有统计学意义,表明3个参数均为诊断直肠腺癌的有效参数,且可从微观结构水平反映病变组织结构的变化。
表1 2组各参数值的比较(±s,n=38)
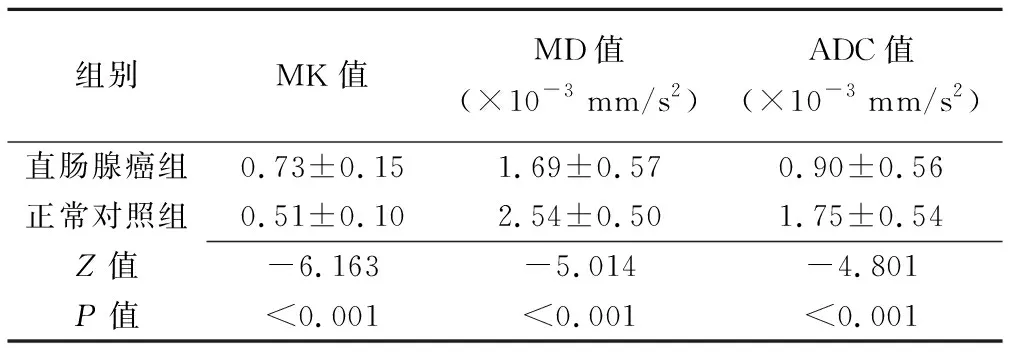
表1 2组各参数值的比较(±s,n=38)
组别MK值MD值(×10-3 mm/s2)ADC值(×10-3 mm/s2)直肠腺癌组0.73±0.151.69±0.570.90±0.56正常对照组0.51±0.102.54±0.501.75±0.54Z值-6.163-5.014-4.801P值<0.001<0.001<0.001

表2 MK、MD、ADC诊断直肠腺癌的效能
本研究ROC分析显示,MK值的AUC最大,ADC值的AUC最小;MK值的敏感度和特异度均高于MD值和ADC值,提示DKI对诊断直肠腺癌具有更高效能。目前术前诊断直肠癌主要以DWI与T2WI结合为主[14],DKI亦能获得类似扩散图像,直肠肿瘤在高b值图像上表现为明显高信号,而正常肠壁、粪石及周围正常结构受抑制呈低信号,且b值越高受抑制越明显;在b值为2 000 s/mm2的图像上仅可见肿瘤呈明显高信号。因此,DKI序列亦可突出显示肿瘤病变,且具有较高信噪比,可较常规MRI更直观地显示肿瘤,弥补常规扫描序列对诊断直肠癌的不足[15]。
DKI和DWI均为磁共振功能成像技术,水分子扩散受限程度对MK值、MD值、ADC值均有影响。本研究结果表明ADC值与MD值呈正相关,与MK值呈负相关。由于恶性肿瘤细胞增殖速度快,细胞外容积迅速减小,导致ADC值减小,MD值也减小;而肿瘤细胞排列结构越复杂,水分子的扩散越呈非高斯分布,使MK值增大。
本研究的局限性:①未按病理分化等级对直肠腺癌进行细分,而不同分化等级可能影响DKI模型参数和ADC值;②病例数较少。
综上所述,DKI可通过同时定量测量MK、MD值提供关于肿瘤微环境扩散特性的有效信息,且具有较高诊断效能。
