经导管肾交感神经消融术治疗慢性心力衰竭的有效性和安全性:Meta分析
2019-06-24勾白冰
勾白冰,黄 晶,钱 俊,熊 波
(重庆医科大学附属第二医院心血管内科,重庆 400010)
心力衰竭是由心脏结构和/或功能异常导致心室充盈不足和/或射血能力降低引发的复杂的临床综合征。2017年我国450万人罹患心力衰竭,发病率和病死率均随年龄增长而显著升高[1]。虽然诸多新技术及新型药物的应用使得慢性心力衰竭的临床诊疗取得一定进展,但联合应用多种药物进行内科治疗仍是目前的主要治疗方式,对患者依从性要求较高。既往大量研究[2-5]已证实了经导管肾交感神经消融术(renal denervation, RDN)治疗顽固性高血压的有效性及安全性。目前RDN治疗心力衰竭是临床研究热点之一,但对其有效性及安全性争议较大。本研究以Meta分析观察经导管RDN治疗慢性心力衰竭的有效性及安全性。
1 资料与方法
1.1 文献检索 检索 Cochrane、Library、PubMed、EMBASE、中国知网及万方数据库,英文检索词:“heart failure”“renal sympathetic denervation”“renal denervation”,中文检索词:“心力衰竭”“肾去交感”“消融”“肾去交感消融术”。检索时间为各数据库建库至2018年12月。纳入文献语种仅限于汉语和英语。
1.2 纳入标准及排除标准 纳入标准:①研究对象明确诊断为慢性心力衰竭,左心室射血分数(left ventricular ejection fractions, LVEF)<50%;②接受经导管RDN治疗;③具有完整的基线数据及评估左心室功能的相关数据;④术后随访时间≥1个月。排除标准:①非收缩功能不全性心力衰竭;②无肾脏疾病及肾功能不全;③数据资料不完整或无法提取全文;④综述、评论性文献、Meta分析、病例报道文献;⑤样本量<5。
1.3 数据提取及文献质量评价 由2名研究人员独立检索文献并提取资料,交叉核对数据。对所纳入的随机对照试验(randomized controlled trial, RCT)、队列研究(cohort studies, CS)及自身对照试验分别采用Cochrane偏倚风险评估工具、Newcastle-Ottawa Scale文献质量评价表及Thomas量表进行质量评价,遇有分歧时经协商统一意见。
1.4 结局指标 主要结局指标:①LVEF;②左心室收缩末期内径(left ventricular end-diastolic dimension, LVDD);③脑钠肽(brain natriuretic peptide, BNP)。次要结局指标:①心率;②收缩压及舒张压;③6 min步行试验结果。
1.5 统计学分析 采用Rev Man 5.3统计分析软件对各结局指标进行Meta分析。以Q检验对所纳入试验进行异质性分析,以I2值进行定量评估,I2<50%时认为各研究具有同质性,采用固定效应模型分析数据;I2≥50%则认为各研究存在异质性,采用随机效应模型进行分析。纳入指标均为连续型变量,对测量单位相同的结局指标以加权均数差(weighted mean difference, WMD)及其95%CI表示效应量,对测量单位不同的结局指标以标准化均数差(standardized mean difference, SMD)及其95%CI表示效应量。对RCT和CS采用“RDN组”和“药物治疗组”的结局指标变化进行Meta分析,自身对照试验采用“治疗前”和“治疗后”的结局指标变化进行Meta分析。P<0.05为差异有统计学意义。
2 结果
2.1 文献检索及筛选 根据检索策略及资料收集方法,共检索获得文献859篇,排除重复文献后剩余470篇。由2名研究人员独立阅读题目及摘要,根据预先确定的纳入和排除标准进行初步筛选,排除394篇文献;对其余76篇文献深入阅读全文后排除68篇,最终纳入8篇文献[6-13],见图1。

图1 文献检索流程图
2.2 纳入文献的基本特征及质量评价 8篇文献[6-13]中,3篇为RCT[10,12-13],1篇为CS[11],4篇为自身对照试验[6-9];共纳入230例患者。纳入文献的基本特征及质量评价见表1。
2.3 Meta分析
2.3.1 主要结局指标 在RCT/CS[10-13]和自身对照试验[6-9]中,LVEF的异质性均较高,I2=71%、90%,故采用随机效应模型。Meta分析显示,在RCT/CS[10-13]中,RDN组LVEF与药物治疗组相比显著升高[WMD=7.17,95%CI(3.77,10.56),P<0.01];但在自身对照试验[6-9]中,RDN治疗后LVEF值与治疗前相比差异无统计学意义[WMD=-1.11,95%CI(6.56,-8.77),P=0.78]。见图2。
LVDD在3篇RCT/CS[10,12-13]和2篇自身对照试验[6-7]中均存在高度同质性,I2均=0,故采用固定效应模型。Meta分析显示,在RCT/CS[10,12-13]中,RDN组LVDD与药物治疗组相比显著降低[WMD=-4.42,95%CI (-0.59,0.26),P<0.01];在自身对照试验[6-7]中,RDN治疗后LVDD与治疗前相比差别无统计学意义[WMD=-4.45,95%CI(-0.99,0.09),P=0.10]。见图3。
由于4篇RCT/CS[10-13]和3篇自身对照试验[7-9]中BNP测量使用的单位不同,故采用SMD作为效应量,且BNP在RCT/CS[10-13]及自身对照试验[7-9]中,同质性均较高,I2=25%、44%,故采用固定效应模型合并效应量。Meta分析显示,在RCT/CS[10-13]中,RDN组BNP与药物治疗组相比明显降低[SMD=-1.48,95%CI (-2.38,-1.12),P<0.01];在自身对照试验[7-9]中,RDN治疗后BNP与治疗前相比显著升高[SMD=-0.47,95%CI(-0.83,0.11),P=0.01)]。见图4。

图2 RCT/CS中RDN组与药物治疗组、自身对照试验中RDN治疗前与治疗后LVEF值差异森林图

第一作者发表年研究类型样本量(男/女,例)疗效判定指标随访时间(月)消融导管年龄NYHA心功能分级缺血性病因患者占比(%)质量评价Davies JE[6]2013自身对照试验7(5/2)LVEF、LVDD、心率、6 min步行试验6simplicity(Medtonic)69±7Ⅲ/Ⅳ70适中Gao JQ[7]2017自身对照试验14(12/2)LVEF、LVDD、BNP、心率、收缩压、舒张压、6 min步行试验6Stockert EP Shuttle(Johnso&Jhonson)70±6Ⅲ/Ⅳ57适中Hopper I[8]2017自身对照试验39(34/5)LVEF、BNP、心率、收缩压、舒张压、6 min步行试验12Symplicity Flex(Medtronic)65±11Ⅱ/Ⅳ62强王本文[9]2014自身对照试验10(8/2)LVEF、BNP、心率、收缩压、舒张压1—62±10Ⅲ/Ⅳ30适中Chen W [10]2017RCTRDN组30(22/8)LVEF、LVDD、BNP、心率、收缩压、舒张压6Celsius Thermocoo(Biosense Webster)49±8Ⅲ/Ⅳ20低风险药物治疗组30(24/6)51±8Ⅲ/Ⅳ17Dai Q[11]2015CSRDN组10(8/2)LVEF、BNP6—63±10Ⅲ/Ⅳ207分药物治疗组10(7/3)64±5Ⅲ/Ⅳ17Gao JQ [12]2018RCTRDN组30(25/5)LVEF、LVDD、BNP、6 min步行试验6Ablation instrument [39D-72X](Johnson Medical Instrument)59.0±12.1Ⅱ/Ⅲ58.3低风险药物治疗组30(22/8)61.3±11.1Ⅱ/Ⅲ58.3杨伟[13]2013RCTRDN组10(9/1)LVEF、LVDD、BNP、心率、收缩压、舒张压、6 min步行试验12—67.5±13.4Ⅲ/Ⅳ50低风险药物治疗组10(6/4)64.3±11.1Ⅲ/Ⅳ40
注:NYHA:纽约心脏病学会(New York Heart Disease Assocation);—:未提及

图3 RCT/CS中RDN组与药物治疗组、自身对照试验中RDN治疗前与治疗后LVDD差异森林图
2.3.2 次要结局指标 心率在2篇RCT/CS[10,13]中异质性较高I2=54%,故采用随机效应模型,RDN组心率与药物治疗组相比显著降低[WMD=-9.96,95%CI(-17.08,-2.12),P=0.01];而在4篇自身对照试验[6-9]中同质性较高,I2=0,故采用固定效应模型,RDN治疗后心率与治疗前相比显著降低[WMD=-2.57,95%CI(-4.75,-0.39),P=0.02)]。见图5。
收缩压在2篇RCT/CS[10,13]和3篇自身对照试验[7-9]中同质性均较高,I2均=0,故采用固定效应模型。在RCT/CS[10,13]中,RDN组收缩压与药物治疗组相比显著升高[WMD=12.89,95%CI(1.15,24.17),P=0.27];在自身对照试验[7-9]中,收缩压在RDN治疗前及治疗后差异无统计学意义[WMD=-3.50,95%CI(-9.76,2.76),P=0.27]。舒张压在在2篇RCT/CS[10,13]中具有较高的异质性,I2=66%,故采用随机效应模型;RDN组与药物治疗组间舒张压差异无统计学意义[WMD=1.05,95%CI(-6.08,8.18),P=0.77]。且舒张压在3篇自身对照实验[7-9]中存在较高同质性,I2=26%,故采用固定效应模型;RDN治疗前与治疗后舒张压差异无统计学意义[WMD=-3.18,95%CI(-6.94,0.58),P=0.10]。
6 min步行试验在2篇RCT/CS[12-13]和3篇自身对照试验[6-8]中均存在高度异质性,I2=99%、93%,故采用随机效应模型。在RCT/CS[12-13]中,RDN组与药物治疗组间6 min步行试验结果差异无统计学意义[(WMD=203.33,95%CI(-47.43,454.09),P=0.11];在自身对照试验[6-8]中,RDN治疗后与治疗前6 min步行试验结果差异亦无统计学意义[WMD=70.68,95%CI (-23.21,164.57),P=0.14]。
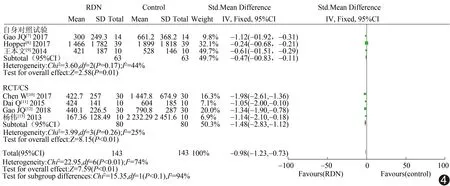
图4 RCT/CS中RDN组与药物治疗组、自身对照试验中RDN治疗前与治疗后BNP差异森林图

图5 RCT/CS中RDN组与药物治疗组、自身对照试验中RDN治疗前与治疗后心率差异森林图
3 讨论
交感神经及肾素-血管紧张素系统(renin-angiotensin system and sympathetic nerve, RAAS)过度激活在心力衰竭的发生发展过程中扮演着重要角色。研究[14]表明,心功能下降早期,血容量相对不足可刺激中枢神经系统,引起机体儿茶酚胺急剧增加,表现为交感神经过度激活;而高浓度去甲肾上腺素可导致心肌细胞凋亡重塑[15]。此外,心输出量降低所致肾灌注不足也可激活RAAS系统,导致机体水钠潴留,促进心肌重构。交感神经系统与RAAS系统相互作用,最终使心力衰竭不可逆转[16]。RDN通过破坏肾动脉周围的交感神经来降低中枢交感神经系统与肾脏间的信号传递,可在一定程度上抑制全身交感神经系统过度激活,进而达到改善心功能的目的。
近年来,多项动物实验[17-20]证实,RDN用于治疗小鼠慢性心力衰竭,可明显改善其心脏收缩功能。2013年Davies等[6]将RDN用于临床治疗慢性心力衰竭。此后RDN治疗心力衰竭的临床研究相继开展,但各研究[6-13]报道的治疗效果不一。本研究发现在RCT/CS中RDN组反映心功能的指标LVEF、LVDD均较药物治疗组明显改善,且无论在RCT/CS还是在自身对照试验中,与药物治疗组及RDN治疗前相比,BNP在RDN组及RDN治疗后均有明显改善,反映交感神经兴奋的指标心率也明显降低,且均未出现由于心率降低而引起的严重的不良反应和并发症,表明RDN治疗慢性收缩功能不全心力衰竭不仅能改善心功能,也具有较高的安全性。
本研究的局限性:①由于RDN治疗心力衰竭的临床试验较少,为获得更完整的结局指标,纳入的研究类型较多;②纳入文献较少,可能存在较高偏倚;③未纳入不能获取全文的文献,可能存在选择偏倚;④纳入文献的随访期限并不完全相同。
总之,经导管RDN可改善慢性心力衰竭患者心功能及心室重构,但需要设计更为严谨、更大样本的多中心临床研究加以验证。
