由甲酸-贝壳溶液湿法纺制优质丝素蛋白长丝
2019-06-21李晓茹
李晓茹
(青岛大学纺织服装学院,山东青岛 266000)
长期以来,丝素蛋白(SF)纤维具有优异的强度,断裂伸长率,环境稳定性和生物相容性,已在纺织、生物技术和生物医学领域得到应用[1-2]。天然SF是一种线性水不溶性聚合物蛋白。它必须在加工成不同形式之前溶解。溶解是SF再加工的重要组成部分,才能将SF加工成薄膜、凝胶、多孔支架材料。目前有多种溶解体系应用于SF的溶解。因此探讨合适的溶解方法并获得性能优异的再生丝素蛋白材料成为丝蛋白领域的研究重点之一。近年来,对丝素蛋白溶解方法的研究一直是一个热点,已有广泛报道。最初,国内外学者关注浓酸和碱,如浓磷酸[3]溶解SF,但严重损害蛋白结构。 2004年,飞利浦[4]首先研究并比较了SF在不同离子溶液的溶解性能。使用离子液体溶解SF成为一个新的研究热点。在这种情况下,最常用的溶解SF的方法是n(CaCl2):n(C2H5OH):n(H2O)(摩尔比为1:2:8)三元溶剂溶解法和9.3 mol / L 溴化锂(LiBr)的组合水溶液法。使用上述溶解方法会对SF的多层结构造成较大的破坏,导致再生SF材料的性能难以满足实际应用要求。探索合适的溶解方法,获得再生SF材料的优异性能是蛋白质研究的重点之一。目前常用的溶剂包括9.0M~9.5M溴化锂(LiBr)[5],甲醇中的硝酸钙[6],氯化钙和乙醇水溶液的混合物[7]等。一种吸引人的策略是将壳废物溶解在甲酸(FA)中以在室温下制备离子液体,以溶解丝纤维以制备纺丝液。贝壳是碳酸钙的主要成分。蛤壳废物主要含有少量生物大分子的CaCO3(~95%)[8-9]。随着现代科学技术的不断进步,海洋生物壳资源的开发受到高度重视。被遗弃的贝壳难以自然分解,这已成为世界范围内的环境问题和低利用率。鉴于目前贝类资源利用不足,环境污染严重的现状,本研究以废弃贝壳为钙源,设计低能耗实验条件,开展SF柔性长丝的制备。在我们的工作中,使用几种分析技术,如扫描电子显微镜(SEM),傅立叶变换红外(FTIR)光谱,X射线衍射(XRD),机械强力等来表征SF长丝的结构和性能。
1 实验部分
1.1 SF纺丝溶液的制备
脱胶是对蚕茧进行热化学处理,去除丝胶蛋白的过程。根据已发表的论文[10-11]对茧丝进行脱胶。首先,将贝壳(Shells)溶解在甲酸(FA)溶液中搅拌3小时,制备FA-Shells溶液。 然后,将具有不同比例的脱胶蚕丝溶解在FA- Shells溶液中, 搅拌4小时后,制备SF-FA-Shells纺丝液。
1.2 柔性SF长丝
本实验中使用简单的湿纺设备如图1。纺丝溶液通过压力泵挤入喷丝头。纺丝溶液进入凝固浴,并形成初级长丝。通过逐步拉伸方法到卷取装置处,再利用卷绕装置将SF长丝收集。在纺丝过程中,纺丝参数如下:纺丝压力= 0.1MPa,流速= 10mL / h,卷绕速率= 8rpm,拉伸比= 2,用去离子水作为凝固浴。
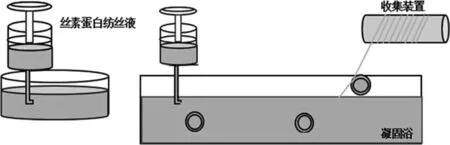
图1 湿纺设备示意图
1.3 测试部分
1.3.1 扫描电镜成像
通过扫描电子显微镜(SEM)分析SF长丝的形态。其中加速电压约10kV,通过使用图像J分析软件分析SEM图像获得所有长丝样品的平均直径。
1.3.2 X射线衍射
在Cu-Kα单色辐射下,使用Rigaku D / Max-2550PC仪器在40kV、30mA下通过X射线衍射(XRD)分析SF的结晶度。通过采用与透射模式有关的敏感检测器,在0.02°的间隔,波长为1.5406的范围内,在3°~60°的2θ范围内扫描所有样品。
1.3.3 红外光谱
将导电处理前后的样品剪成碎片,利用溴化钾压片法分别制成红外分析样品,然后放人IRPres-tige-21红外光谱仪(Shimaduco.LTD,日本)中测定并记录红外光谱图像。
1.3.4 力学性能测试
使用自动拉伸试验机(型号3365电子强度测试仪,Instron,USA)测量SF长丝。将这些样品在标准大气条件(20℃、65%RH)下保持24小时。在测试过程中,夹具之间的距离和测试速度设定为20 mm和10 mm min-1,预张力为0.2 cN。将平均20次测量报告为每个样品的平均值±标准偏差。
2 测试结果与分析
丝素蛋白纤维包括75wt% 丝素蛋白和25 wt%丝胶蛋白,是纺织工业中最重要的材料之一[12]。 湿法纺丝技术很受欢迎,易于操作[13]。 我们通过调整各种纺丝参数来找到再生丝素蛋白纤维的最佳可纺性和可加工性[14-15]。
2.1 SF长丝的可纺性
在FA-Shells溶液下湿法纺出的SF长丝的宏观形态和电镜形态(图2)。首先,用去离子水探测可纺的SF纺丝溶液。结果发现,能够湿纺的SF的浓度在8%至14%(w / w)的范围内,且具有良好的可纺性,纺丝溶液相对稳定(图3)。当纺丝溶液的浓度为C<8%(w / w)时,纺丝过程比较容易,但是纺出的柔性长丝断断续续,不成形。当纺丝溶液的浓度为8%

图2 在FA-Shells溶液下湿法纺出的SF长丝的宏观形态和电镜形态

C<8%
C>14%


图4 采用不同SF-FA-Shells溶液的湿法纺丝法制备的SF长丝的形态:SF含量为(a)8.0wt%、(b)10.0wt%、(c)12.0wt%和(d) 14.0重量%。
2.2 在不同凝固浴下纺制的SF长丝的表征
2.2.1 红外光谱
SF长丝的IR光谱(图5)在1634cm-1(酰胺I),1520cm(酰胺II),1227cm(酰胺III)和530cm(酰胺V)的特征峰具有β折叠取向。 和无规卷曲构象结构。 酰胺II(C = O伸缩振动),酰胺II(N-H变形振动和C-N伸缩振动)酰胺II还含有由分子链段之间的N-H,C = O组成的氢键引起的带。 随着凝固浴中醇的浓度增加,纤维中的吸收峰朝向天然丝素蛋白纤维e逐渐增强。 纤维结构转变的主要原因主要是由于丝素蛋白的疏水区域和原始水分子的水合作用被破坏,导致分子链之间产生新的酰胺键。 在酰胺特征峰上产生显着的吸收峰。
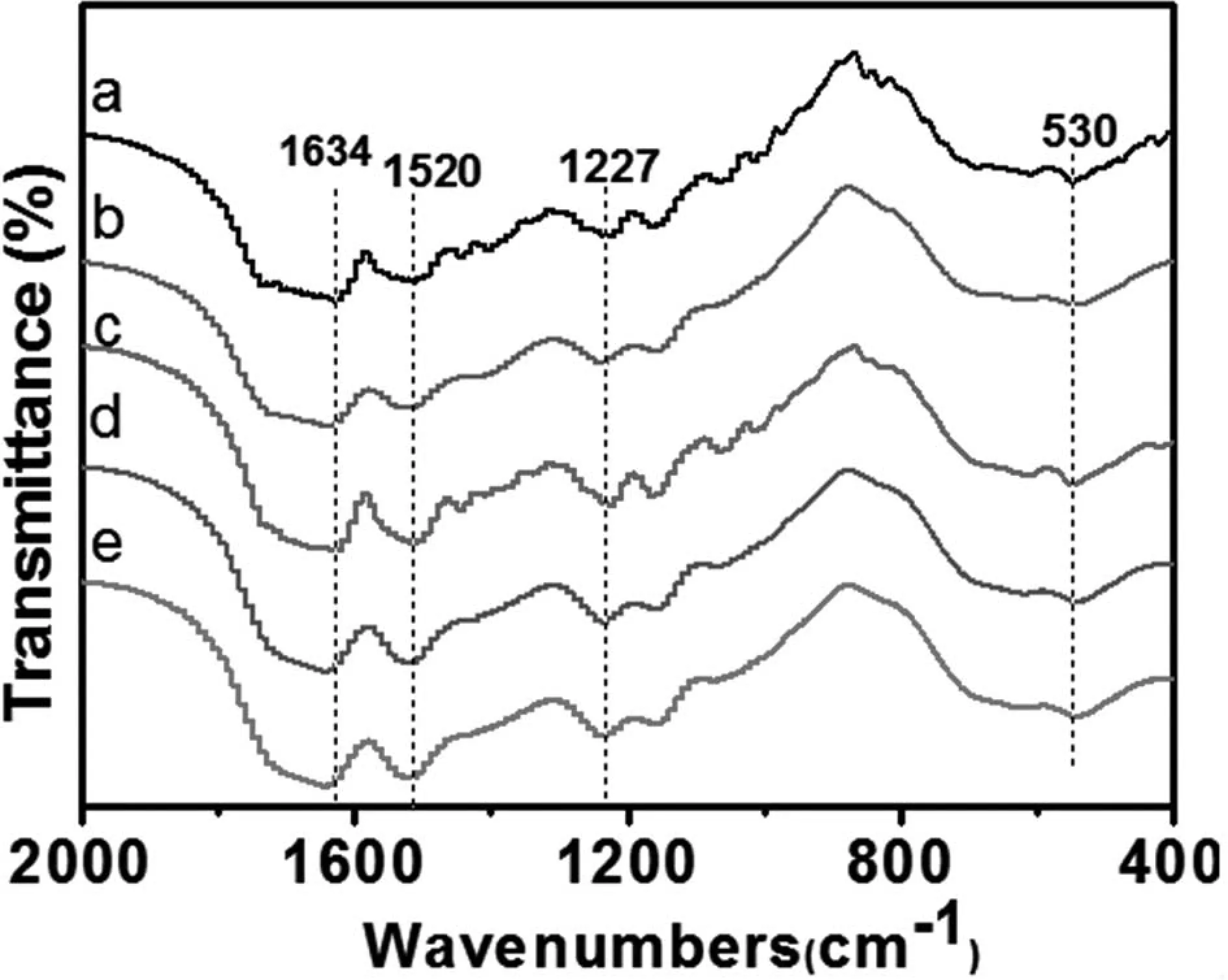
图5 在不同凝固浴中SF长丝的红外光谱
(a.100%H2O;b.75%H2O;c.50%H2O;d.25%H2O;e.SF)
2.2.2 XRD图
图6显示了15.96°、18.9°、20.26°、26.05°、29.3°的共同峰,X-射线衍射测试是研究纤维聚集态结构的有力工具,越来越多研究者采用XRD研究丝蛋白纤维的聚集态结构[19-20]。再生SF长丝d分子链形态取向与天然蚕丝e的越来越接近,主要原因归因于酒精溶液诱导丝蛋白中无规卷曲或α-螺旋结构向β-折叠结构转变,使得再生丝素蛋白纤维分子链的规整性不断增加,这一结果与Ha等人的研究及其相似[21]。 因此,凝固浴的选择对丝素蛋白的结构有显着影响。
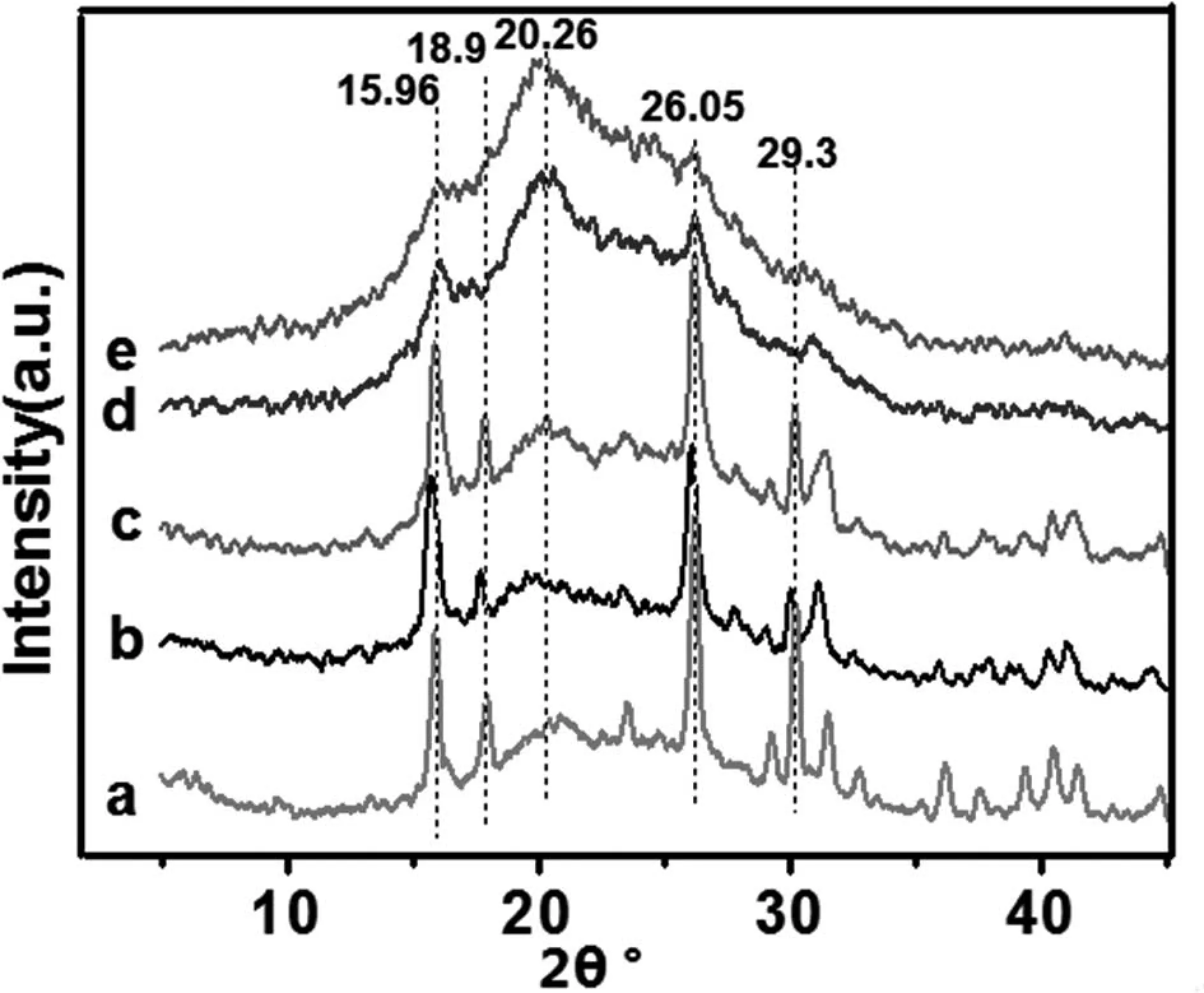
图6 在不同凝固浴的SF长丝的XRD图
(a.100%H2O;b.75%H2O;c.50%H2O;d.25%H2O;e.SF)
2.2.3 机械性能
结果如表1和图7所示。在不同的凝固浴,通过湿法纺制SF长丝, 在去离子水中纺出SF长丝a的直径大于在乙醇溶液中纺出的SF长丝的直径。a的断裂强度为(10.6±1.52)MPa,略小于天然SF e, 而断裂伸长率a明显大于e。以乙醇水溶液做凝固浴纺得的再生纤维较细,且脆。
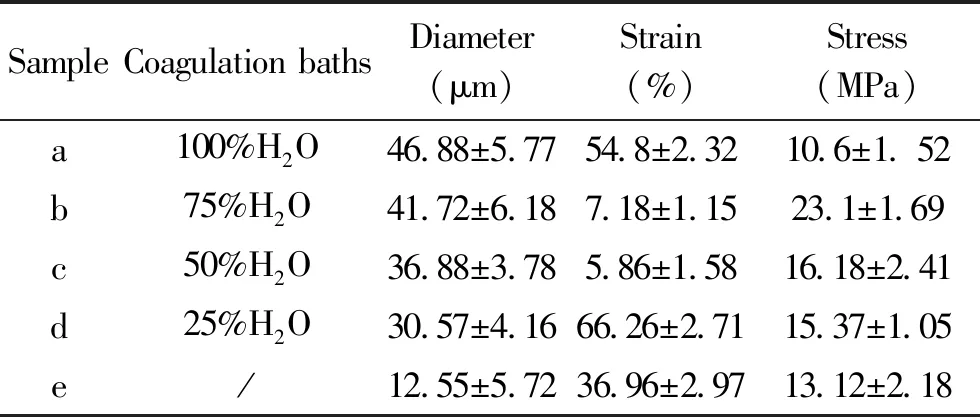
表1 在不同凝固浴下制备的SF长丝的机械性能
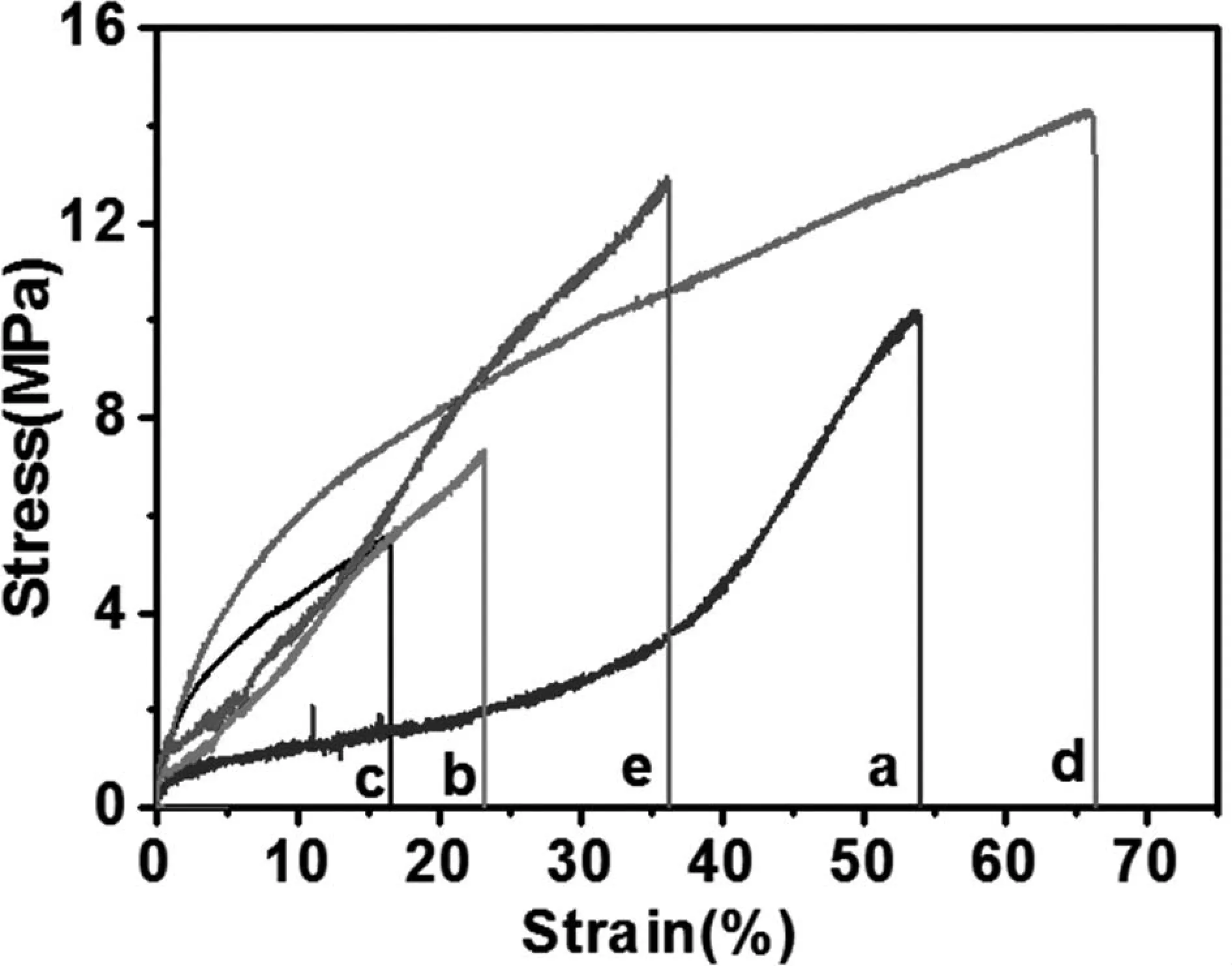
(a.100%H2O;b.75%H2O;c.50%H2O;d.25%H2O;e.SF)
3 结语
在该研究中,在室温下将贝壳溶解在甲酸中,制备离子液体。我们发现通过调节各种纺丝参数,SF长丝的最佳可纺性和可加工性为8.0wt%至14.0wt%。当纺丝溶液的浓度为C = 12%时,长丝表面平整光滑,是湿纺丝溶液最佳纺丝浓度。凝固浴的选择对丝素蛋白的结构有显着影响,酒精溶液诱导丝蛋白中无规卷曲或α-螺旋结构向β-折叠结构转变。 由FA-Shells溶液制备SF长丝,其直径为30.1μm±3.68μm,应力和应变为22.08MPa±7.2 MPa和63.2%±6.56%,结构是Silk I和Silk II的共存。以去离子水作为凝固浴,纺出的SF长丝的直径大于在乙醇溶液中纺出的长丝直径,而断裂强度接近天然SF的断裂强度。因此,本研究中的所有数据表明,再循环贝壳废物可以作为溶解系统重新用于制备基于SF的功能性长丝。SF柔性长丝在纺织、生物和其他新型功能材料中具有潜在的应用。
