肉葡萄球菌电转化条件的优化
2019-06-21张变强唐巧巧柯灵超王德培
张变强,唐巧巧,柯灵超,张 健,王德培,朱 燕,高 强
(1. 工业发酵微生物教育部重点实验室,天津科技大学生物工程学院,天津 300457;2. 天津科技大学后勤管理处,天津 300457)
肉葡萄球菌(Staphylococcus carnosus)是目前葡萄球菌属中被完全确认的一株食品级(generally recognized as safe,GRAS)菌株[1].肉葡萄球菌作为肉制品发酵行业中形成肉制产品独特风味的关键性菌种,很早就在欧洲尤其是德国,用于制造干火腿与干香肠的初始发酵剂[2].此外,与其他革兰氏阳性细菌如芽胞杆菌(Bacillus)和乳酸乳球菌(Lactococcus lactis)等相比,肉葡萄球菌具有生长迅速、营养要求简单、无外毒素、胞外蛋白酶水解活性低且能够将蛋白质分泌至培养基中[2-3]的特点,使其不仅可以在代谢工程方面用来研究肉葡萄球菌及相关属种的代谢途径,而且还可以用于外源蛋白的表达和分泌研究.
然而,作为革兰氏阳性细菌,肉葡萄球菌的细胞壁较厚且致密,感受态细胞接收外源载体困难,常规的热激转化法几乎无法使外源 DNA进入宿主细胞.目前,肉葡萄球菌的外源 DNA转化方法主要有原生质体转化方法和电转化方法.原生质体转化方法操作复杂、花费时间较长且转化效率较低,而电转化法操作简便、理论转化效率高,因而得到广泛的应用[4].电转化法的原理是使用瞬时电压使得细胞膜被极化而产生瞬时孔洞,使 DNA等外源物质快速进入到细胞内[5].电场强度和脉冲持续时间在一定范围内时,细胞的瞬时通透性是可逆的.随着电场强度的增加,细胞膜通透性越高,产生的疏水孔洞也越多,外源 DNA越容易进入到细胞,但随着电场强度的不断增加,细胞的死亡率也会急剧增加[6].所以,在电转化过程中需要平衡转化效率和死亡率的关系,既要提高电场强度,提高转化效率,又要尽可能降低细胞死亡率.如果在电转化过程中添加合适的高渗溶液给予细胞一定的保护,可以提高细胞的存活率,进而提高细胞的电转化效率.Loefblom 等[5]建立了S.carnosus TM300的电转化方法,但是操作繁琐,转化不够稳定,并且未做高渗溶液方面的研究.因此,亟待建立一个更为稳定高效的适合 S.carnosus的电转化方法.
增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)是在野生型 GFP的基础上,采用定点突变技术将Ser65和Phe64分别用Thr和Leu替代而成,通过改造大大增强了荧光亮度和稳定性,因此比GFP更适用于生命科学各个领域的研究[7].
本研究在前期研究[8-9]的基础上,首先优化细菌生长状态、电压、质粒质量浓度,初步确定较优条件,继而对电击缓冲液、复苏培养基组分、复苏培养时间进行优化,以期提高肉葡萄球菌的转化效率,为后续的研究奠定电转化方法学的基础.
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α 由本实验室保存;肉葡萄球菌(Staphylococcus carnosus)TM300、pBT2质粒(氯霉素抗性(Cmr)与氨苄青霉素抗性(Ampr)),由德国图宾根大学微生物遗传学研究所Friedrich Goetz教授馈赠;E.coli-Staphylococci穿梭质粒pBT2-ET-4C-5R-EGFP,由S.carnosus TM300双精氨酸转运(Twin arginine translocation,Tat)信号肽与EGFP组成的融合蛋白,本实验室以pBT2质粒为骨架构建,具体的构建过程参考中国发明专利申请:一种肉葡萄球菌的电转化方法及其应用(申请号:201710958394.5,中华人民共和国国家知识产权局).
1.1.2 培养基和缓冲液
LB 培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,去离子水配制,pH 7.5,1×105Pa灭菌20min;固体培养基需添加琼脂粉20.
B2培养基(g/L):水解酪蛋白 10,酵母提取物25,葡萄糖 5,NaCl 25,K2HPO41,去离子水配制,pH 7.5,0.67×105Pa灭菌 15min.
LBC 复苏培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,0.5mol/L 蔗糖,去离子水配制,pH 7.5,1×105Pa灭菌 20min.
LBS复苏培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,0.5mol/L 山梨醇,去离子水配制,pH 7.5,1×105Pa灭菌 20min.
LBM 复苏培养基(g/L):胰蛋白胨 10,酵母浸出粉 5,NaCl 10,0.3mol/L 甘露醇,去离子水配制,pH 7.5,1×105Pa灭菌 20min.
TSB 固体培养基(g/L):酪蛋白 17,大豆蛋白胨3,葡萄糖 2.5,NaCl 5,K2HPO42.5,pH 7.5,琼脂粉20,去离子水配制,0.67×105Pa灭菌15min.
Glc电击缓冲液:10%甘油,去离子水配制,pH 7.5,1×105Pa灭菌 20min.
GM 电击缓冲液:10%甘油,0.5mol/L甘露醇,去离子水配制,pH 7.5,1×105Pa灭菌20min.
GS电击缓冲液:10%甘油,0.5mol/L山梨醇,去离子水配制,pH 7.5,1×105Pa灭菌20min.
GSM 电击缓冲液:10%甘油,0.5mol/L甘露醇,0.5mol/L山梨醇,去离子水配制,pH 7.5,1×105Pa灭菌20min.
GC电击缓冲液:10%甘油,0.5mol/L蔗糖,去离子水配制,pH 7.5,0.67×105Pa灭菌20min.
12%分离胶(15mL):ddH2O 4.9mL,Tris-HCl(1.5mol/L,pH 8.8)3.8mL,30%丙烯酰胺6.0mL,10% SDS 0.15mL,10%过硫酸铵 0.15mL,TEMED 6µL.
5%浓缩胶缓冲液(5mL):ddH2O 3.4mL,Tris-HCl(1.0mol/L,pH 6.8)0.63mL,30%丙烯酰胺0.83mL,10% SDS 0.05mL,10%过硫酸铵0.05mL,TEMED 5µL.
1.1.3 主要仪器设备
BTX ECM399型指数衰减波电穿孔系统电转化仪、BTX 610型电转杯(间距 2mm),美国 BTX 公司;核酸定量仪,德国 IMPLEN公司;ZWYR-D2403型恒温培养振荡摇床,上海智城分析仪器制造有限公司;DYY-4C型稳压稳流电泳仪、DYCZ-40E型半干转膜仪,北京六一仪器厂.
1.2 方法
1.2.1 质粒的提取与定量检测
使用天根生化科技(北京)有限公司生产的DP103质粒小提试剂盒提取 E.coli DH5α/pBT2-ET-4C-5R-EGFP质粒,并在电转化S.carnosus TM300之前使用核酸定量仪测定质粒浓度.
1.2.2 S.carnosus TM300感受态细胞的制备
挑取S.carnosus TM300单菌落接种到装有5mL LB培养基的试管中,37℃、180r/min培养 12~16h.将过夜培养的S.carnosus TM300菌液按照1%的接种比例接种在装有 50mL B2培养基的 250mL三角瓶中,37℃、180r/min培养至对数生长期(A578=0.6)时停止培养.将含有菌液的三角瓶冰浴 15min,分装于 50mL预冷过的离心管中,4℃、5000r/min离心10min,弃去上清液.分别用40mL与20mL冰冷的 GS电击缓冲液充分悬浮菌体,4℃、5000r/min离心 10min,弃去上清液,接着用 10mL冰冷的 GS电击缓冲液洗涤菌体3次.最后用800µL冰冷的GS电击缓冲液重悬,分装于1.5mL灭菌离心管中,每管100µL,-80℃保存.
1.2.3 电转化
将 S.carnosus TM300感受态细胞从-80℃取出,冰上解冻 5min.在解冻后的感受态细胞中加入500ng质粒充分混匀,将全部液体转移到2mm电极间距的电转杯中,置于冰上作用30min后,使用电转仪进行电转化,电击电压为2450V,电击后显示的脉冲时间为 6ms.电击后迅速将 1mL LBM 复苏培养基加到电转杯中,将全部液体转到1.5mL离心管中,37℃、180r/min摇床复苏培养4h.吸取100µL培养液涂布于含终质量浓度为10µg/mL Cmr的TSB培养基平板,37℃过夜培养,直至出现转化子,计数转化子并按照式(1)计算转化效率.

1.2.4 引物合成
为了验证转化子,设计引物 egfp-F/egfp-R扩增目的基因 egfp.引物序列为 egfp-F:5'-ATTTGTCCT ACTCAGGAGAGCGTTC-3',egfp-R:5'-GAGTTGCT AGTAACATCTGACCGA-3'.
1.2.5 转化子验证
为了验证电转化得到的转化子,随机选择5个转化子,用含有10µg/mL Cmr的液体LB培养基过夜培养.收集菌体细胞,提取质粒,以转化子质粒为模板,egfp-F/egfp-R为上、下游引物通过 PCR反应扩增目的基因egfp,并用1%琼脂糖凝胶电泳检测[9].
1.2.6 EGFP的表达
分别接种阳性转化菌株 S.carnosus TM300/pBT2-ET-4C-5R-EGFP和阴性对照菌株 S.carnosus TM300于 5mL LB培养液中,37℃、180r/min过夜培养,然后按 1%的接种量将过夜培养物转接至50mL LB培养液中,37℃、180r/min继续培养16h,以表达EGFP.
1.2.7 目的蛋白EGFP的检测
荧光显微镜观察:取5µL按1.2.6节方法培养的菌液,滴在载玻片表面并盖好盖玻片,置于荧光显微镜下观察菌液的荧光产生情况.
分别提取阳性转化菌株与阴性对照菌株发酵液中的蛋白质,使用5%的浓缩胶和12%的分离胶进行聚丙烯酰胺凝胶电泳(SDS-PAGE)检测及免疫印迹(Western blot)测定.
2 结果与分析
2.1 细胞生长时期对转化效率的影响
为了研究S.carnosus TM300的不同生长时期对感受态细胞的制备和后续电转化的影响,在培养细胞的 A578值分别为 0.4、0.6、0.8、1.0、1.2、1.5 时停止培养并收集菌体,按照1.2.2节中的S.carnosus TM300感受态制备方法,获得不同生长时期的感受态细胞(图 1).

图1 S. carnosus TM300的生长曲线Fig. 1 Growth curve of S. carnosus TM300
将穿梭载体 pBT2-ET-4C-5R-EGFP用电转化方法转化至感受态细胞中,复苏培养后涂布于含有10µg/mL氯霉素的 TSB固体培养基平板,计数转化子菌落并计算转化效率(图 2),其中电击缓冲液为GSM,复苏培养基为 LB液体培养基.当 A578=0.6时,转化效率达到最高,为 0.53×103µg-1.结合图 1可知,此时菌体处于指数生长的中前期阶段,细胞生长比较旺盛,电转化效率最佳.
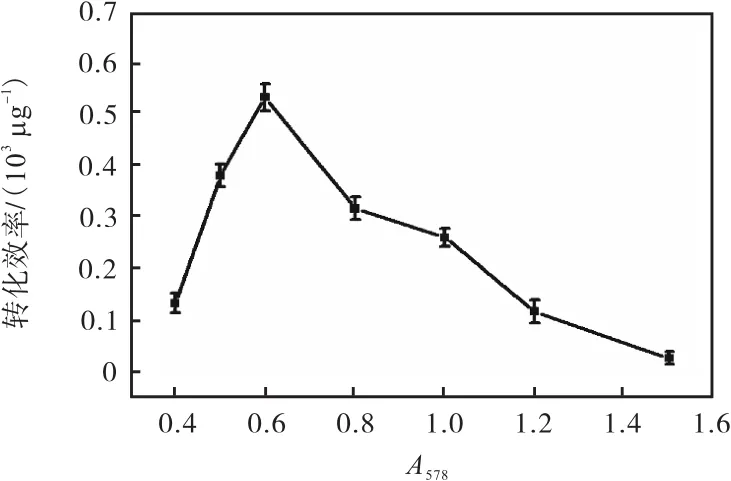
图2 菌体生长A578值对电转化效率的影响Fig. 2 Effect of A578 density on the electroporation efficiency
2.2 不同电击电压对转化效率的影响
在 A578=0.6时收集 S.carnosus TM300菌体用于制备感受态细胞.在电转化步骤中,先将300ng穿梭载体加入感受态细胞,充分混匀后,分别在 1500、1750、2000、2250、2300、2400、2450、2500V 的电压条件下进行电转化.电击完成后向电转杯中加入1mL LB复苏培养基,37℃、180r/min复苏培养3~4h后涂布于含有10µg/mL氯霉素的TSB固体培养基平板,计数转化子菌落,并计算不同电压对应的转化效率,结果如图3所示.
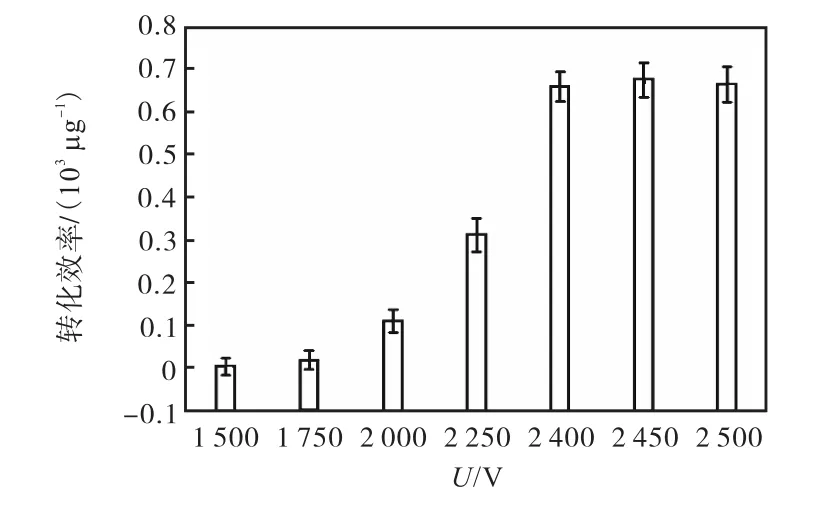
图3 电压对电转化效率的影响Fig. 3 Effect of voltage on the electroporation efficiency
由图3可知:电压在2450V时转化效率达到最高,为 0.67×103µg-1;2500V 时的转化效率略低于2450V时的转化效率;而电压为 1500V与 1750V时,转化效率偏低.因此,S.carnosus TM300最适电转化电压为2450V左右,且电压宜高不宜低.
2.3 质粒质量浓度对转化效率的影响
为了研究质粒质量浓度对S.carnosus TM300电转化效率的影响,本研究选用经过上述优化的感受态细胞,分别取 10、50、100、500、1000、2000ng 穿梭质粒加入到100µL感受态细胞中,在2450V电压下进行电转化.由图4可知:在10~100ng/100µL的质粒质量浓度范围内,转化效率较低;在 500ng/100µL时达到最高,为1.01×103µg-1;但是在质粒质量浓度不断升高时,转化效率反而呈下降趋势;当加入2000ng/100µL质粒时,转化效率下降至 0.046×103µg-1.

图4 质粒质量浓度对电转化效率的影响Fig. 4 Effect of plasmid DNA concentration on the electroporation efficiency
2.4 电击缓冲液对转化效率的影响
在 A578=0.6时收集 S.carnosus TM300菌体制备感受态细胞.制备感受态时用不同的电击缓冲液(Glc电击缓冲液、GM电击缓冲液、GS电击缓冲液、GSM 电击缓冲液、GC电击缓冲液)洗涤细胞,其余实验条件与优化前相同.由图 5可知,用 GS电击缓冲液制备的感受态细胞进行电转化,转化效率最高,转化效率可达 3.89×103µg-1.

图5 电击缓冲液对电转化效率的影响Fig. 5 Effect of electroporation medium on the electroporation efficiency
由图 5结果分析:将甘油作为电击缓冲液使用时,转化效率较低,当在电击缓冲液中加入 0.5mol/L的甘露醇或者山梨醇时,转化效率大幅度提高;当山梨醇、甘露醇以等物质的量加入时,转化效率反而下降,因此,确定电击缓冲液的最佳组成成分为 10%甘油与0.5mol/L山梨醇.
2.5 复苏培养基对转化效率的影响
夏子芳等[11]对乳杆菌的电转化条件进行了优化,发现细胞在电击以后由于受到电压的创伤很容易死亡,如果此时在复苏培养基中加入合适的高渗溶液,可以有效保护细胞,从而提高细胞的存活率,最终提高电转化效率.在 S.carnosus TM300菌体生长到A578=0.6时,收集菌体制备感受态,在电转化步骤加入 500ng穿梭载体进行电转化.电击后立即加入1mL含0.5mol/L不同高渗溶液(蔗糖、甘露醇、山梨醇)的复苏培养基,复苏培养后涂布于含有 10µg/mL氯霉素的 TSB固体培养基平板,37℃过夜培养后计数转化子菌落,计算转化效率.由图 6可知,电击后加入含 0.5mol/L甘露醇的复苏培养基,转化效率最高,达到 4.84×103µg-1.
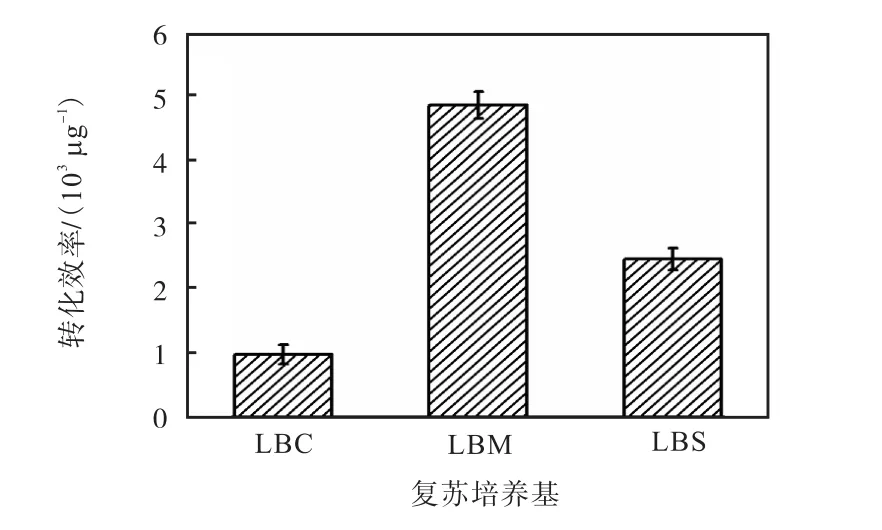
图6 复苏培养基对电转化效率的影响Fig. 6 Effect of different osmotic stabilizers in recovery media on the electroporation efficiency
随后为了研究不同浓度的甘露醇对转化效率的影响,在 LB复苏培养基中分别加入 0.1、0.3、0.5mol/L甘露醇,涂板后观察结果(图7).

图7 复苏培养基中甘露醇浓度对电转化效率的影响Fig. 7 Effect of mannitol concentrations in recovery media on the electroporation efficiency
由图 7可知,当复苏培养基中含有 0.3mol/L甘露醇时,转化效率最高,达到 5.70×103µg-1.由此得出,在复苏培养基中加入0.3mol/L甘露醇时,转化效率最高;甘露醇的浓度过高时,转化效率呈下降趋势.
2.6 复苏时间对转化效率的影响
本研究选用经过上述优化的感受态细胞,加入500ng/100µL 质粒电击后,分别孵育 1、2、3、4、5、6h,然后涂布于含有10µg/mL Cmr的TSB固体培养基平板,转化效率结果如图8所示.
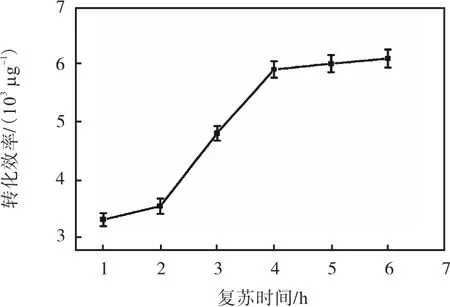
图8 复苏时间对电转化效率的影响Fig. 8 Effect of incubation time on the electroporation efficiency
由图 8可知:细胞复苏时间达到 4h时,转化效率较好,达到 5.95×103µg-1;4h以后转化效率增加不明显,所以综合考虑选择4h为细胞复苏时间.
2.7 肉葡萄球菌转化子的验证
为了验证电转化后得到的转化子是否为阳性转化子,本研究随机挑取 5个转化子,提取转化子质粒,以该质粒为模板,egfp-F/egfp-R为上、下游引物,进行 PCR验证.PCR产物用 1%琼脂糖凝胶电泳检测分析,结果如图9所示.

pBT2-ET-4C-5R-EGFP作为阳性对照,对各转化子质粒的 PCR验证均在 1440bp左右出现目的条带,且与阳性对照结果一致,证明质粒 pBT2-ET-4C-5R-EGFP成功地转化到S.carnosus TM300宿主中.
2.8 荧光显微镜观察
使用NIKON ECLIPSE TE2000-U型荧光显微镜观察转化子菌液,结果如图 10所示.与图 10(a)的S. carnosus TM300阴性对照对比观察可知,图10(b)中构建成功的S. carnosus TM300转化株发出绿色荧光,说明载体pBT2-ET-4C-5R-EGFP编码的EGFP蛋白能够以活性形式得到表达.
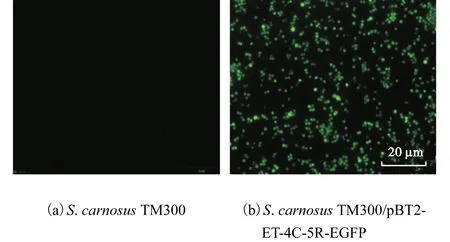
图10 EGFP荧光显微镜观察Fig. 10 Fluorescence observation of EGFP expression
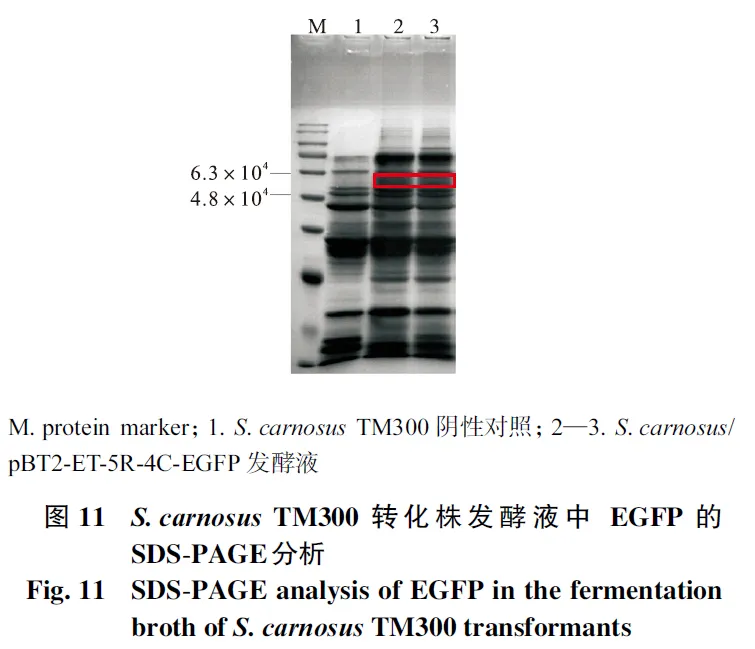
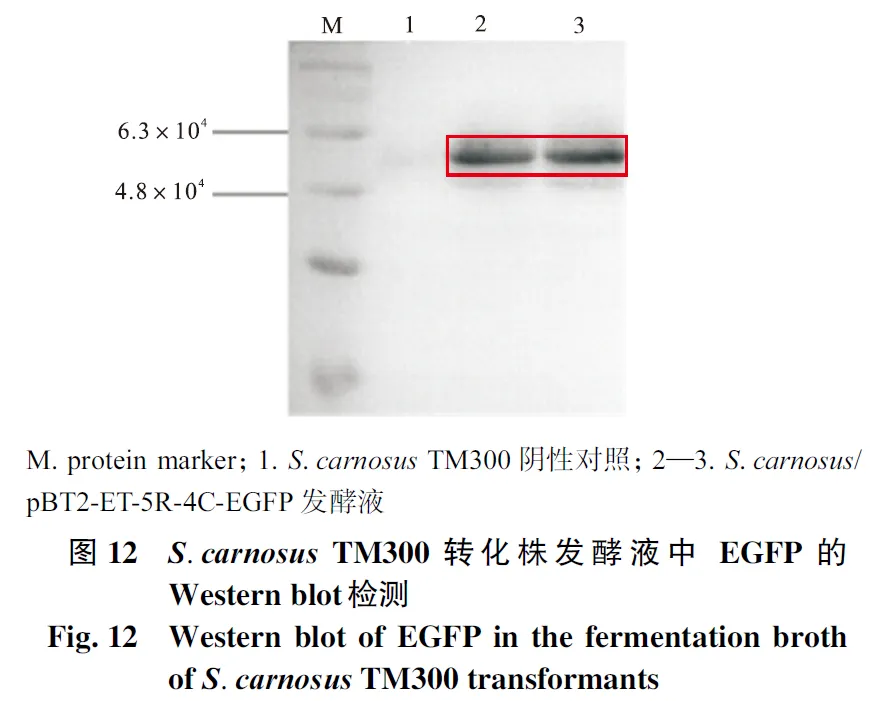
2.9 SDS-PAGE与Western blot分析
分别提取S.carnosus TM300及转化菌株发酵液中的蛋白,进行SDS-PAGE蛋白电泳及Western blot蛋白免疫印迹.如图 11和图 12所示,野生型菌株S. carnosus TM300作为阴性对照,其发酵液中没有出现目的条带,而转化菌株均在 5.4×104左右处有目的条带.表明肉葡萄球菌转化株成功地将表达的EGFP以二聚体形式分泌至细胞外的发酵液环境中.
3 讨 论
电转化法作为一种高效的转化方法,目前广泛应用于外源基因转染等多个领域[10].但在实际操作过程中,电转化的转化效率受到诸多因素的影响,包括细菌生长状态、生长培养基组分、电击缓冲液组分、电击电压、脉冲时间、电场强度、电阻、质粒 DNA 浓度、复苏培养基组分[11]、复苏时间[12]等多个方面.为了提高电转化效率,不同菌株和质粒的电转化都需要对电转化条件作出调整和优化.
本研究对影响S.carnosus TM300电转化效率的有关参数进行了优化,研究发现,S.carnosus TM300在 A578=0.6时有最高的转化效率,达到 0.53×103µg-1.另外,对影响电转化的电压和质粒质量浓度因素进行了优化,研究发现,在电压为2450V时,电转化效率最高,达到0.67×103µg-1.电压过低或过高都会对电转化效率产生显著的影响,其原因可能是电压过低时细胞表面的动作电位处于不应期的时间较长[13],细胞无法产生孔隙,外源 DNA 从而无法进入细胞;电压过高时,细胞在瞬时高压下产生不可逆损伤,导致细胞大量死亡.同时,质粒质量浓度对电转化效率的影响也较大.在本研究中,质粒质量浓度为500 ng/100µL时,电转化效率最高,达到 1.01×103µg-1.质粒质量浓度过高或过低都会导致电转化效率降低,出现这种情况的原因可能是质粒 DNA浓度过低时,DNA分子数量太少,细胞未得到充分利用,转化效率偏低;而当质粒质量浓度过高时,细胞所能够吸收的 DNA分子达到过饱和的状态,反而不利于转化,肖冲等[14]在乳酸菌电转化条件的优化研究中也证实了这一点.研究还发现,洗涤缓冲液对感受态细胞的制备影响较大,用山梨醇、甘露醇、蔗糖等高渗剂配成高渗溶液洗涤菌体细胞,电转化效率有显著提高.其原因可能是一方面高渗溶液能够降低细胞表面的离子强度,另一方面能够给细胞提供一个高于细胞质渗透压的环境而促进细胞收缩,进而增强细胞膜的再密封能力,降低胞内物质的流出速度,最终提高细胞的存活率[15].实验结果表明,使用 10%甘油与0.3mol/L甘露醇配成的高渗溶液洗涤菌体细胞的转化效果最好,转化效率提高至 3.89×103µg-1.此外,电击后在复苏培养基中加入山梨醇、甘露醇等渗透压保护剂时,对 S.carnosus TM300的转化效率也有显著的提高,当加入的甘露醇为0.3mol/L时,转化效率可达 5.70×103µg-1,这与 Xue等[16]对枯草芽胞杆菌电转化的研究结果相类似.另外,电击后的复苏时间对转化效率也具有显著的影响,当复苏时间为 4h时,电转化效率较好,达到 5.95×103µg-1.复苏时间之所以对转化效率有影响,原因可能是电击后细胞表面会产生孔隙,而要闭合孔隙,需要将细胞置于含有特定高渗溶液的复苏培养基中培养一段时间,使细胞孔隙闭合复原,从而有助于提高细胞的存活率,进而提高转化效率[17].对经过上述优化得到的转化株检测发现,EGFP蛋白在 S.carnosus TM300中成功表达,并能够以二聚体形式转运至发酵液中.这可能是聚合界面的疏水性氨基酸残基较多[18],导致 EGFP蛋白聚合所致.
综上所述,通过优化以上电转化参数,S.carnosus TM300的电转化效率达到 5.95×103µg-1,比高强等[7]以前报道的转化效率提高了 5倍,且目的蛋白EGFP成功分泌至发酵液中.优化后的电转化方法可以用于肉葡萄球菌的基因高效转化,为今后肉葡萄球菌的基因工程改造以及合成生物学等研究奠定了有力的电转化方法学基础.
