限食对家蚕寿命和繁殖性能及部分生理指标的影响
2019-06-20谭志承唐顺明沈兴家
谭志承 薛 鹏 许 瑾 唐顺明 沈兴家
(1江苏科技大学生物技术学院,江苏省蚕桑生物学与生物技术重点实验室,江苏镇江 212018;2中国农业科学院蚕业研究所,农业农村部蚕桑遗传改良重点实验室,江苏镇江 212018)
“饮食有节,方能百岁,饮食自倍,肠胃乃伤”,自古以来,饮食限制一直作为一种既能延长寿命又能改善生活质量的方法[1]。饮食限制又称热量限制(calorie restriction,CR),是指在保证生物体不发生营养不良的条件下限制食量,达到延长寿命的效果,并且能有效地防止生物功能恶化,防治和延缓与老龄相关疾病的发生[2]。1935年,MCCAY等[3]提出了著名的“麦卡效应”,即减少大鼠正常食量的30%~50%能显著延长大鼠寿命。迄今为止,研究者先后在酵母、果蝇和灵长类动物等多种生物体中观察到CR不同程度诱导寿命延长的现象[4]。CR的这种作用,可降低癌症、神经退行性疾病、自身免疫性疾病、心血管疾病和2型糖尿病等与年龄相关疾病的发生。随着全球人口老龄化问题的日益严重,关于CR机制的探索也成为了生命科学中长久不衰的研究热点。研究者们分别从能量代谢、氧化应激、炎症和自噬等生理生化水平进行探索研究[5],发现饮食限制的生物机体氧自由基生成与氧化损伤减少,血糖水平、非酶糖基化、代谢速率降低,代谢潜力保持[6]。到目前为止,长寿分子水平的研究已有突破性的认识,长寿相关基因的研究结果逐步揭示了生理功能、代谢途径等对长寿的重要影响[7]。胰岛素受体底物1-B基因(chico)是胰岛素/胰岛素样生长因子通路(IGF-1)表达调控的一员,此信号通路被证明是第1个得以验证在不同物种中调控寿命的分子信号通路;组蛋白去乙酰酶基因(rpd3)所在的组蛋白去乙酰酶(sirtuins)通路能介导饮食限制下的寿命延长[8];脂代谢激素2基因(Akh2)调控糖代谢能直接参与营养和能量代谢,从而影响生物体的寿命[9-10]。家蚕(Bombyxmori)是世界上最重要的大规模人工饲养的经济昆虫,也是重要的鳞翅目模式生物,它的生命周期短、子代多、遗传背景清楚,是研究延长寿命机制的良好模型动物。KELLOGG等[11]最早开展了家蚕限食与寿命关系的研究,通过节律性地控制给桑次数使幼虫的寿命延长。1984年,王德厚[12]报道了不同程度的限食对家蚕寿命的影响,发现在一定范围内,给食量越少,家蚕寿命越长;在不同发育阶段限食,都能使幼虫寿命延长,连续限食者延寿幅度更大。2010年,孔祥宾[13]调查证明,限食和家蚕胰岛素信号系统基因的表达密切相关。同时,有研究者指出限食处理对家蚕幼虫丝氨酸蛋白酶基因(SPs)与丝氨酸蛋白酶抑制剂基因(serpins)表达敏感性有所不同,暗示限食对家蚕不同组织的影响有差异[14]。但是对限食为何能延长家蚕寿命,相关的长寿基因是如何调控寿命长短,至今尚不清楚。
本试验选取家蚕二化性品系秋丰为材料,研究食量限制对家蚕的体质量、寿命、生理生化指标、寿命相关基因表达水平和生育繁殖能力的影响,为人类健康饮食研究提供参考和借鉴。
1 材料与方法
1.1 试验材料
1.1.1 供试家蚕品系 本试验所用家蚕品系为秋丰,二化性,斑纹限性(雌蚕为普斑,雄蚕为素蚕),由中国农业科学院蚕业研究所育成并保存提供。
1.1.2 主要试剂 总RNA提取试剂(RNAiso Plus)、反转录试剂盒、荧光定量SYBR@Premix Ex TaqTM试剂盒,均为宝日医生物技术(北京)有限公司产品;超氧化物歧化酶、可溶性蛋白[含聚氰基丙烯酸正丁酯(BCA,试剂盒中试剂A和试剂B共同配制而成的工作液)和蛋白标准溶液]、海藻糖、丙二醛检测试剂盒,均为苏州科铭生物技术有限公司产品;过氧化氢酶检测试剂盒,为南京建成生物工程研究所产品。
1.1.3 主要仪器设备 LightCycler©96实时荧光定量PCR仪,为Roche公司(美国)产品;UV-2600紫外分光光度计,为岛津仪器(苏州)有限公司产品。
1.2 试验方法
1.2.1 家蚕限食模型的建立与限食对食下量、体质量和寿命的影响调查 秋丰越年蚕种(解除滞育)或浸酸处理后的蚕种,25 ℃室内自然光照催青。孵化后单蛾或双蛾混合收蚁,25±1 ℃室内自然光照下新鲜桑叶饲养,从2龄开始将幼虫随机分为2组,一组自由采食(ad libitum feeding,简称AL组),每日给桑2次,保持24 h自由进食时间;另一组限制给食(detary restriction,简称DR组),每日给桑1次,保持16 h自由进食时间,即停食8 h,给食量以AL组食量的60%为宜。自4龄起按照斑纹将2组幼虫雌雄分开饲养,每组雌雄蚕各3个重复,每个重复30头蚕。后续研究均以此为模型。调查每日食下量、体质量、龄期经过等。
食下量调查:按“食下量=每日给桑量-幼虫未食完的余桑量”公式计算食下量。其中,余桑量为折算成的鲜桑叶量。每次喂食前留取10 g鲜桑叶,至下次喂食前称量,作为余桑量折算成鲜桑叶量的指标[13]。
体质量调查:2龄、3龄幼虫体质量在蜕皮完成眠起时称量;4~5龄幼虫每天称量体质量;化蛹第3天称量体质量。
龄期经过调查:幼虫期每个龄期经过为上一龄期蜕皮完成至下一龄期蜕皮完成;蛹期经过为熟蚕结茧至羽化为成虫;成虫期经过为羽化至成虫死亡。本文家蚕寿命为幼虫期经过、蛹期经过和成虫期经过时间之和,即从幼虫孵化到成虫死亡的时间。
繁殖能力调查:采用雌蛾交尾后造卵数(产出卵和未产出卵之和),雄蛾一次交尾、二次交尾是否正常来初步评估家蚕繁殖能力。
1.2.2 家蚕寿命相关基因的表达分析 分别取AL组和DR组家蚕5龄3 d的雌和雄幼虫头部、中肠、表皮、血淋巴、精巢/卵巢、丝腺、马氏管和脂肪体,提取总RNA。采用相对定量方法(qPCR),每组3次重复,分析不同给食条件下Bmchico(GeneID:101745072)、Bmrpd3(Gene ID:101744526)、BmAkh2(GeneID:100174839)基因的表达水平变化(表1)[13]。
表1 qRT-PCR引物

引物引物序列 (5′-3′)BmchicoF:TACCGAACCTCTGCTACCCATR:CCGTCGTAGTCTGCCTTCCGABmrpd3F:ATGCTGTAAATATACCCCTTCGTR:TCGTAAGTCCAACAGCGAGABmAkh2F:TACTTGTGTTGATTCTGTCCGR:TCTTCAGAGGAGCATCCATCGActin3F:CGGCTACTCGTTCACTACCR:CCGTCGGGAAGTTCGTAAG
1.2.3 家蚕部分生理生化指标的检测 分别取AL组和DR组家蚕5龄期雌雄幼虫,酒精擦拭后尾足取血淋巴,将血淋巴收集在预先加入苯基硫脲的1.5 mL离心管中,用于检测分析血淋巴超氧化物歧化酶(SOD)、过氧化氢酶(catalase)、丙二醛(MDA)、可溶性蛋白(soluble protein)和海藻糖(trehalose)等生理生化指标。各生理生化指标均按照试剂盒说明书操作测定。
参见可溶性蛋白含量测定试剂盒,取稀释200倍的待测样品20 μL和配制好的BCA工作液(试剂 A 和 B 按照 50∶1的比例混合)1 000 μL混匀作为测定管,分别取蒸馏水20 μL和工作液1 000 μL混匀作为空白管,取蛋白标准溶液20 μL和工作液1 000 μL混匀作为标准管,于60 ℃水浴保温30 min后测定562 nm 处吸光度值,按照“可溶性蛋白含量(mg/mL)=0.5×(A测定管-A空白管)÷(A标准管-A空白管)”计算待测样品可溶性蛋白含量。
1.3 数据处理与分析
本文所有统计数据均使用GraphPad Prism软件(v7.04)。所有数值均表示为平均值或平均值±标准误。本试验显著性差异分析均采用Holm-Sidak,比较2组模型相同日龄相同性别的差异,显著性水平P<0.05表示2组之间的比较具有显著性差异,显著性水平P<0.01表示2组之间的比较具有极显著性差异。
2 结果与分析
2.1 限食对家蚕食下量、体质量和寿命的影响
在上述限食模型下,统计了自2龄幼虫限食开始,到5龄结束(上蔟)期间的食下量。结果显示,限食显著减少幼虫食下量。以5龄期为例,DR组食下量约为AL组的61.03%,2组食下量差异达显著水平(P<0.05);而且,雌蚕食下量均高于雄蚕,符合生产实际(图1-A)。
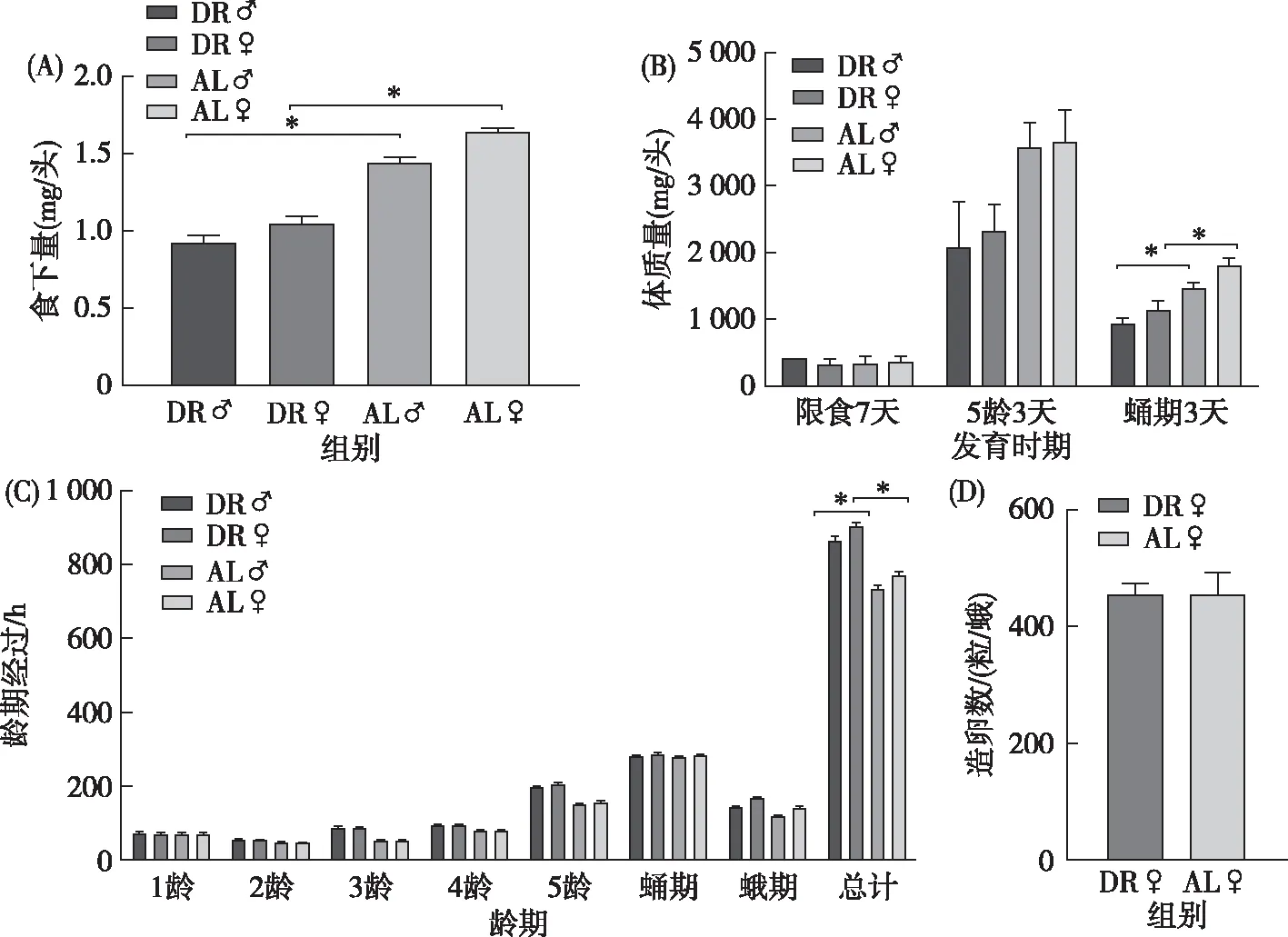
♀分别代表限制给食组雄、雌蚕;♀分别代表自由采食组雄、雌蚕;*表示差异显著(P<0.05),**表示差异极显著(P<0.01);图2-4,表2-6相同。图1 限食模型与自由采食模型家蚕5龄幼虫日均食下量(A)、龄期经过(B)、体质量(C)和雌蛾造卵数(D)比较
从限食开始,DR组每个龄期经过时间均有不同程度的延长,其中在5龄幼虫和成虫期经过延长最明显,综合整个龄期(图1-B)来看,雌蚕DR组比AL组延长了132 h,雄蚕DR组比AL组延长了130 h,差异均达到显著水平(P<0.05),表明限食能够显著延长家蚕的寿命。
随着限食时间的推移,DR组家蚕体质量较AL组有明显的减轻。DR组雌、雄幼虫体质量峰值分别为AL组雌、雄幼虫的75.07%和70.30%,表明DR组家蚕发育周期中,体质量始终达不到AL组幼虫的峰值水平,限食减轻了家蚕的体质量。蛹期3 d的DR组雌、雄蛹平均体质量分别为AL组的63.34%和63.52%(图1-C),2组中雌蚕体质量均大于雄蚕体质量,这与食下量的调查结果一致。
对雌蛾交配后造卵数的调查结果(图1-D)显示,DR组和AL组雌蛾的造卵数量并没有显著性差异(P>0.05),说明适度限食对家蚕生育繁殖没有明显的影响。
2.2 限食影响家蚕寿命相关基因的表达水平
2.2.1Bmchico基因表达水平的变化 家蚕幼虫5龄3 d是蚕丝蛋白大量合成的时期,常用于家蚕生理毒理研究,我们用qRT-PCR技术分析了限食后5龄3 d幼虫各组织中3个长寿相关基因表达量的变化。结果表明,与AL组雌蚕相比,DR组雌蚕Bmchico基因表达水平在中肠和马氏管中上调,在头部、丝腺、卵巢和脂肪体中下调,其中在丝腺和脂肪体中显著下调(图2-A),与限食降低蚕丝蛋白合成一致;DR组雄蚕Bmchico基因在表皮中的表达水平显著下调,在丝腺、精巢、脂肪体、马氏管和血淋巴中的表达水平上调,但差异不显著(图2-B)。同时雌、雄对比发现,Bmchico基因在雌蚕中表达水平较雄蚕高,推测Bmchico基因存在一定的性别特异性。

A.雌蚕,B.雄蚕;图3-4相同。图2 Bmchico在家蚕5龄3 d各组织中的表达水平
2.2.2Bmrpd3基因表达水平的变化 与AL组相比,DR组中雌蚕Bmrpd3在头部和表皮中的表达水平下调但差异不显著;在其余组织中均表现上调,其中在中肠、丝腺、脂肪体和马氏管中显著上调(图3-A)。在DR组雄蚕中该基因在头部、表皮、中肠的表达水平下调,在其余组织中表现为上调(图3-B)。而且在雌、雄家蚕幼虫中Bmrpd3基因的表达水平相近。

图3 Bmrpd3在家蚕5龄3 d各组织中的表达水平

图4 BmAkh2在家蚕5龄3 d各组织中的表达水平
2.2.3BmAkh2基因表达水平的变化 DR组雌蚕BmAkh2在各个组织中的表达水平均表现出不同程度的下调,在丝腺中下调的幅度最大,达到显著水平(图4-A);DR组雄蚕BmAkh2在表皮中的表达水平显示上调,在其余组织中的表达水平显示下调,在丝腺、精巢、马氏管和血淋巴中的表达水平差异显著(图4-B)。BmAkh2基因整体上表达水平较低,在不同组织和不同性别中的表达差异大,显示出一定的性别和组织特异特性。
2.3 限食对家蚕5龄幼虫血淋巴部分生理生化指标的影响
2.3.1 超氧化物歧化酶活性的变化 超氧化物歧化酶对机体的氧化和抗氧化平衡起着重要的作用,从表2可以看出,AL组超氧化物歧化酶的活力从5龄1 d开始上升,在5龄4 d(盛食期)到达极值后开始下降;而DR组超氧化物歧化酶活力变化从5龄1 d开始,一直呈现上升的趋势,在5龄6 d超过AL组家蚕。
表2 超氧化物歧化酶在5龄家蚕血淋巴中的活力

时间/d样本数/个超氧化物歧化酶活力/(U/mL)AL♂AL♀DR♂DR♀5龄1 d313.32±1.8714.13±2.6412.71±1.8014.69±0.995龄2 d316.08±2.3716.41±1.5614.96±2.7013.39±1.215龄3 d318.64±4.5318.39±4.4116.83±0.8616.64±2.455龄4 d320.90±1.3219.24±1.6119.60±1.6818.75±0.155龄5 d320.37±0.6619.16±3.0217.24±1.14∗18.65±3.585龄6 d317.40±1.1115.07±2.6619.37±2.4420.45±3.525龄7 d321.74±2.5022.37±1.645龄8 d323.99±4.0124.02±2.62日均-17.79±1.9817.07±2.6518.31±2.1418.62±2.02
日均为5龄期酶活总量除以5龄期天数;表中数据为平均值±标准误;表3-6相同。
2.3.2 过氧化氢酶活性的变化 过氧化氢酶是反映生物体氧化水平的指标之一,AL组5龄期血淋巴中过氧化氢酶活力随着时间的推移持续下降,而DR组活力呈现先下降后上升的趋势,至5龄6 d到达峰值,末期再次降低(表3)。而且DR组过氧化氢酶活力均高于AL组同性别的家蚕,在同一模型中过氧化氢酶活力雌蚕均高于雄蚕,表明该酶活力存在性别差异。
表3 过氧化氢酶在5龄家蚕血淋巴中的活力

时间/d样本数/个过氧化氢酶活力/(U/mL)AL♂AL♀DR♂DR♀5龄1 d332.96±3.8834.47±2.8139.09±1.6742.65±4.665龄2 d331.08±3.7934.74±3.9429.64±1.7435.18±2.875龄3 d332.18±2.1937.71±2.9529.98±1.7831.41±1.405龄4 d326.28±1.9329.32±4.3935.88±1.21∗33.22±1.645龄5 d328.67±1.8332.49±3.1636.41±1.12∗39.58±1.905龄6 d326.78±1.0334.68±3.8836.46±1.64∗45.23±1.615龄7 d327.82±1.4825.82±1.715龄8 d334.11±2.9336.21±1.95日均-29.66±2.4433.90±3.5233.67±1.7036.16±2.22
2.3.3 丙二醛含量的变化 丙二醛是脂质氧化的终产物,能直接反映机体脂质氧化水平。在AL组家蚕血淋巴中丙二醛浓度为0.50~0.92 nmol/mL,说明正常蚕体也存在较弱的脂质氧化作用,在5龄期随发育进程呈现逐步下降的趋势。与AL组家蚕相比,DR组家蚕血淋巴中丙二醛平均含量更低,同样随发育进程逐步下降(表4),但2组间差异未到达显著水平。
表4 丙二醛在5龄家蚕血淋巴中的含量
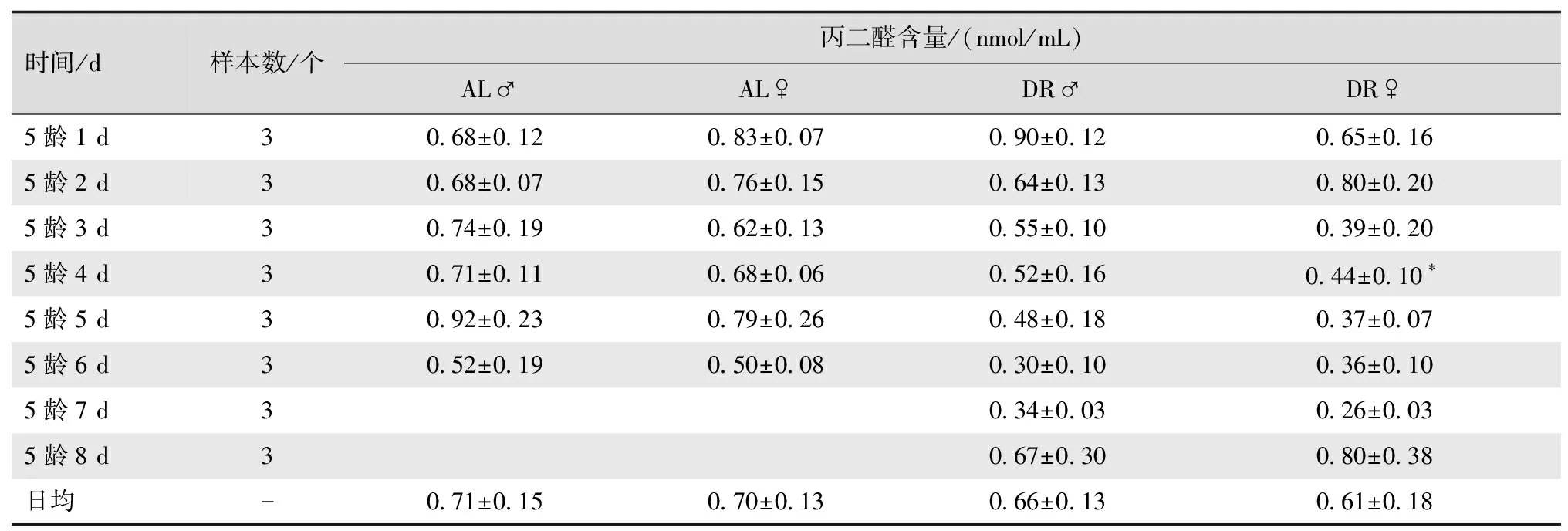
时间/d样本数/个丙二醛含量/(nmol/mL)AL♂AL♀DR♂DR♀5龄1 d30.68±0.120.83±0.070.90±0.120.65±0.165龄2 d30.68±0.070.76±0.150.64±0.130.80±0.205龄3 d30.74±0.190.62±0.130.55±0.100.39±0.205龄4 d30.71±0.110.68±0.060.52±0.160.44±0.10∗5龄5 d30.92±0.230.79±0.260.48±0.180.37±0.075龄6 d30.52±0.190.50±0.080.30±0.100.36±0.105龄7 d30.34±0.030.26±0.035龄8 d30.67±0.300.80±0.38日均-0.71±0.150.70±0.130.66±0.130.61±0.18
2.3.4 可溶性蛋白含量的变化 可溶性蛋白包含昆虫发育过程中的各种关键蛋白质,其性质和数量随着发育阶段改变,从侧面反映着昆虫的发育状态。经过长期限食,AL组雄蚕血淋巴中可溶性蛋白平均含量达到119.33 mg/mL,DR组雄蚕为124.50 mg/mL,相差不大;而AL组和DR组雌蚕血淋巴中可溶性蛋白平均含量相差约10 mg/mL(表5),说明限食对可溶性蛋白含量影响在雌蚕中表现得更为显著。
表5 可溶性蛋白在5龄家蚕血淋巴中的含量

时间/d样本数/个可溶性蛋白含量/(mg/mL)AL♂AL♀DR♂DR♀5龄1 d3112.56±6.97104.56±1.97160.27±2.28 ∗152.87±1.64 ∗5龄2 d3102.27±2.82134.27±2.82116.47±2.28∗134.14±4.145龄3 d3112.71±1.31122.48±2.82118.99±1.79∗120.54±5.655龄4 d3110.99±1.79150.81±8.48116.12±3.94120.71±1.31∗5龄5 d3132.71±1.31150.84±5.45112.27±2.28∗116.56±1.97∗5龄6 d3148.12±3.94182.26±4.08118.84±2.45∗122.84±2.45∗5龄7 d3124.42±2.62130.89±1.795龄8 d3132.56±1.97148.76±1.97日均-119.33±3.02140.33±4.33124.50±2.45130.25±2.62
2.3.5 海藻糖含量的变化 海藻糖是家蚕的血糖,也是家蚕生理活动的主要能源物质。在血淋巴海藻糖测定中发现,DR组和AL组家蚕均呈现先上升后下降的变化趋势,5龄3 d达到峰值(AL组:10.90 mg/mL;DR组:7.62 mg/mL)。但DR组整体海藻糖平均含量更低,并在5龄6 d出现了含量上升的现象(表6)。
表6 海藻糖在5龄家蚕血淋巴中的含量

时间/d样本数/个海藻糖含量/(mg/mL)AL♂AL♀DR♂DR♀5龄1 d36.52+1.656.51±1.675.33±0.435.12±0.975龄2 d38.53±0.646.92±1.335.93±0.506.42±0.055龄3 d310.84±0.4610.95±0.46 7.32±0.16∗7.92±0.35∗5龄4 d38.76±0.717.95±1.944.77±0.24∗5.06±1.46∗5龄5 d37.49±1.466.18±0.824.64±0.89∗4.71±0.545龄6 d37.38±0.645.94±0.616.69±1.296.68±1.61

续表6
3 讨论
3.1 家蚕限食模型
动物限食模型的利用,解决了医学和健康性试验人体的困难以及伦理问题。家蚕作为鳞翅目昆虫模式生物,子代多、生命周期短、遗传背景清楚、繁殖能力强,是研究寿命较好的实验动物。为了探究限食延长寿命的机制,我们以家蚕为试验材料,限食组给食量为自由采食组的61.03%,符合其他动物模型限食标准(60%)[15]。通过定时限食,家蚕的寿命得到显著延长。根据啮齿类动物常用的体质量、血糖水平和寿命长短等指标判断[16],我们的家蚕限食模型建立成功。限食可延长家蚕的寿命,其中延长最明显的是5龄期和成虫期,分别占总延长时间的36.64%和18.32%。而且家蚕限食后未观察到如啮齿类动物由于长期禁食生殖力下降的现象[1],雌蚕的造卵数没有明显变化,雄蛾交尾正常,说明适度限食对家蚕生育繁殖没有明显的影响。
3.2 限食对家蚕寿命相关基因表达的影响
一直以来,人们都在寻找延缓衰老的有效途径,研究方向由原来的宏观水平到细胞、基因水平,再到基因功能,希望通过抑制或调控长寿相关基因来延缓衰老,达到健康长寿的目的[17]。我们从家蚕中选取了3个黑腹果蝇中调控寿命相关的同源基因,分析了它们在家蚕不同组织中的表达情况。chico基因编码胰岛素受体底物1-B,该底物在胰岛素/胰岛素样生长因子(IGF-1)信号通路扮演重要角色,而胰岛素/胰岛素样生长因子信号通路是经典的寿命调节相关通路[18],该信号通路广泛存在于脊椎动物和非脊椎动物中,在进化上高度保守并与各种正常生理活动及多种疾病发生密切相关[19-20]。CLANCY等[18]在果蝇中对chico基因进行了诱变,发现果蝇平均寿命在突变纯合子中延长了48%,在突变杂合子中延长了36%,在本试验中,与AL组家蚕相比,DR组Bmchico在雌蚕丝腺、脂肪体和雄蚕表皮中的表达水平都显著下调,这与chico基因在果蝇中的研究结果一致,表明限食通过诱导chico基因的表达水平下调来实现延长寿命的效果,而在其他组织中Bmchico的表达水平下调不明显甚至有些组织中还出现上调,也说明饮食限制通过chico来调节寿命的程度和方式在不同物种间有所不同。
rpd3是一类保守的组蛋白去乙酰酶,大量的试验证明,在果蝇中rpd3基因的突变会导致果蝇寿命的延长[21]。同时,rpd3作为一类组蛋白去乙酰化酶在表观遗传调控方面也起着至关重要的作用[22]。据报道,刘易斯-卡茨医学院揭示表观遗传学随年龄而变化的速度与物种的寿命相关,而限食减缓了这一变化进程,甲基化程度与寿命之间存在负相关关系。换句话说,表观遗传变化越大,发生的速度越快,物种的寿命就越短[23]。在本试验中,在2组家蚕的各个组织中我们都观察到不同程度的表达差异,我们推测因为生物体衰老并不是同时发生的,各个组织中的衰老程度都会有所不同,表观遗传在各个组织中的变化速度不同,造成rpd3在不同组织中的表达情况有所差异,暗示着限食能延长寿命,也可能是生物体表观遗传调节的结果。
已有研究发现脂质代谢在饮食限食延长寿命中起关键作用。昆虫脂代谢激素(Akh2)是一种代谢性神经肽,主要以其在需要能量的活动(如飞行和运动)中动员能量底物,它介导了昆虫体内糖类和脂类代谢调控[24]。在DR组家蚕脂肪体中,BmAkh2的表达水平普遍下调,这与果蝇中的试验结果一致,表明,Akh2表达水平下降导致调动其能源的速度越慢,家蚕的存活时间就越长,同时限食诱导脂质代谢的改变也可能为我们治疗肥胖症等疾病带来新的曙光[19]。
3.3 限食对家蚕主要生理生化指标的影响
生物机体氧化和抗氧化的动态平衡与其健康、衰老和疾病的发生有着密不可分的关系。超氧化物歧化酶和过氧化氢酶作为抗氧化防御系统中的重要组成部分,能有效地清除机体中的氧自由基防止其累积对细胞造成氧化伤害。通过限制食量,我们发现超氧化物歧化酶和过氧化氢酶活力在DR组家蚕血淋巴中均有上升的趋势,其最高水平均超过AL组家蚕水平,同时脂质氧化产物丙二醛含量下降。表明限食降低了蚕体脂质氧化水平,加速了自由基的清除,使机体抗氧化应激能力提高,从而延缓细胞的衰老,延长生物体的寿命[25-26]。可溶性蛋白是重要的渗透调节物质和营养物质,是代谢系统运作的各种关键酶的主要来源,DR组雌蚕血淋巴可溶性蛋白含量较AL组雌蚕血淋巴低预示着限食可能导致生物体较低的代谢率,并将大部分营养和能量代谢用来繁殖后代。同时海藻糖作为家蚕的主要能源物质,大部分时候在血淋巴中稳定存在,而在DR组家蚕中,海藻糖平均含量较AL组家蚕低且含量水平发生变化,暗示着限食可能改善了家蚕血糖的调节方式,这种调节方式很可能为人类2型糖尿病提供新的干预治疗方法。
限制饮食对于生物体寿命的延长显示出明显的效果,大量报道指出限制饮食也是预防和治疗各种与老年相关疾病的有效手段[2]。然而限制饮食并不是每个人都能接受的长寿方案,我们利用家蚕作为模型,研究限食对寿命、繁殖和生理生化指标的影响,结果表明限食不仅可以延长家蚕的寿命,不影响繁殖,而且主要生理生化指标得到改善或提高,给未来长寿机制研究提供了新的线索和借鉴。
