加压训练和传统增肌训练对优秀男子手球运动员部分激素及生物活性因子的影响
2019-06-20赵之光程金娜魏文哲王明波
赵之光,程金娜,魏文哲,孙 科,王明波
在竞技体育中以增肌为目的运动多采用65%~85%1RM抗阻训练、短距离高强度间歇跑训练、大负荷离心训练等方式,这些运动锻炼方式对运动员的心血管系统、肌肉和关节的负担较大,容易产生疲劳和伤病,甚至有运动员因伤病而提早结束其运动生涯。另外,在足球、篮球、排球等需要持续多日的联赛以及需要多日才能完成的各种比赛中,由于担心传统增肌训练出现的肌肉微损伤影响运动员的竞技状态,在比赛期间一般不采用常规的增肌训练,就算是进行常规的增肌训练,也会因为采用的运动刺激较小导致肌肉维持效果一般。一个赛季或一场大赛结束后,运动员常出现肌肉量大幅下降的现象,要恢复到赛前水平往往需要花费大量时间进行再次的增肌训练。
加压训练(KATTSU)又称血流限制训练,作为近年来非常受关注的一种增肌训练方式(魏佳 等,2019a),已有研究和实践证实,这种限制血液循环的加压训练,可以用很小的负荷(20%~40% 1RM)刺激肌肉增长、改善肌肉功能,且不会引起肌肉损伤(吴旸 等,2019;Nakajima et al.,2006),但这些研究主要以普通人或低运动水平的学生为实验对象。在竞技体育中优秀运动员一般采用传统的增肌训练进行增肌或维持肌肉力量,通过多年的传统增肌训练,运动员的肌肉量已处较高水平。而小负荷血流限制(加压)训练——这种不会引起肌肉损伤的增肌训练方式是否适合专业运动员?加压训练这种小负荷训练方式能否引起与肌肉合成和分解相关的激素和生物活性因子的变化?与传统增肌训练相比,加压训练是否存在优势?能否有效地满足运动队的训练需求?这些问题都需要进行更多的研究和探讨,其中与肌肉合成和分解相关的激素和生物活性因子在加压时的变化值得关注和研究。
本研究以专业运动员为研究对象,对比加压训练与传统增肌训练,对运动员与肌肉合成和分解相关的部分激素和生物活性因子的不同影响。
1 研究对象及方法
1.1 研究对象及分组
本研究以北京男子手球队一线18名运动员为研究对象,运动等级为一级运动员及以上,按照年龄随机分为实验组和对照组,每组各9名运动员(表1)。

表1 运动员基本信息Table 1 Basic Information of Athletes
1.2 研究方法
在以增肌和提高基础力量为主的冬训期,实验对象经过2周的动作学习和适应性训练后,开始正式实验,实验组采用下肢加压训练方式,对照组采用传统增肌训练方式。分别在第1次训练的训练日晨起(PRE)、训练后即刻(POST-0,)、次日清晨(POST-1d),以及训练2周后最后1次训练日晨起(POST-14d)采集肘部静脉血样,将组内和组间POST-0、POST-1d和POST-14d这3个时间点的测试值与PRE测试值进行对比分析。
实验组使用日本Kaatsu Master加压训练装置,在训练前佩戴宽5 cm的加压带,着装压为40 mmHg,训练压为200 mmHg。在下肢加压状态下完成深蹲、硬拉、负重弓步蹲和推雪橇车练习。采用20%~30% 1RM进行深蹲和硬拉练习,采用固定重量的形式进行剪蹲(20 kg)和推雪橇车(40 kg)练习。每个动作练习4组,每组30~40次,每组接近力竭,组间间歇1~2 min。推雪橇车练习形式为全力推车前行20 m,快速返回起点,练习4组,组间歇1~2 min。
对照组采用相同训练内容,即深蹲、硬拉、弓步蹲和推雪橇车前行练习,采用70%~80% 1RM,每组10~12次,组间间歇1~2 min。
实验持续2周,每周3次,每次2~2.5 h。依据运动员能力的增长,及时调整训练负荷。两组实验对象技战术训练、饮食、休息时间等条件基本一致。
1.3 样本采集及处理
血液样本采集:抽取肘静脉血,待血液自然凝固后采用3 000 rpm离心15 min,分离血清,置于-40℃冰箱内保存待测。
1.4 指标测试方法
生长激素(human growth hormone,HGH)、白介素-6(interleukin 6,IL-6)、睾酮(testosterone)、皮质醇(cortisol)、胰岛素(insulin)采用美国Beckman coulter ACCESS 2和配套试剂盒进行测试,一氧化氮合成酶(NO synthetase,NOS)采用南京建成NO合成酶试剂盒、胰岛素样生长因子-1(insulin-like growth factors,IGF-1)、肌肉生长抑制素(myostatin,MSTN)采用江莱生物试剂盒,普朗医疗DNM-9602G酶免仪测试。
1.5 统计处理
采用SPSS 20.0统计软件进行统计分析,数据采用平均值±标准差(M±SD)表示,分析组内各指标变化差异性采用配对样本 t 检验,组间各指标变化采用独立样本 t 检验(组间比较:POST-0、POST-1d、POST-14d分别与PRE进行比较)。P<0.01表示有非常显著性,P<0.05认为有显著性差异。
2 实验结果
2.1 单次加压训练前后和多次加压训练后HGH的变化
由表2和图1可知,实验组和对照组4组数据的标准差较大,说明运动员HGH浓度受训练和个体因素影响较大。与PRE相比,实验组在POST-0显著增加,增加幅度为962.2%(P<0.01),对照组也出现了显著上升568.2%(P<0.01);实验组在POST-1d增加14.3%,而对照组变化幅度仅为0.3%;在POST-14d这一时间点,实验组和对照组分别出现少量增加,增加幅度分别为16.6%和8.7%,两组对比 t检验P>0.05。
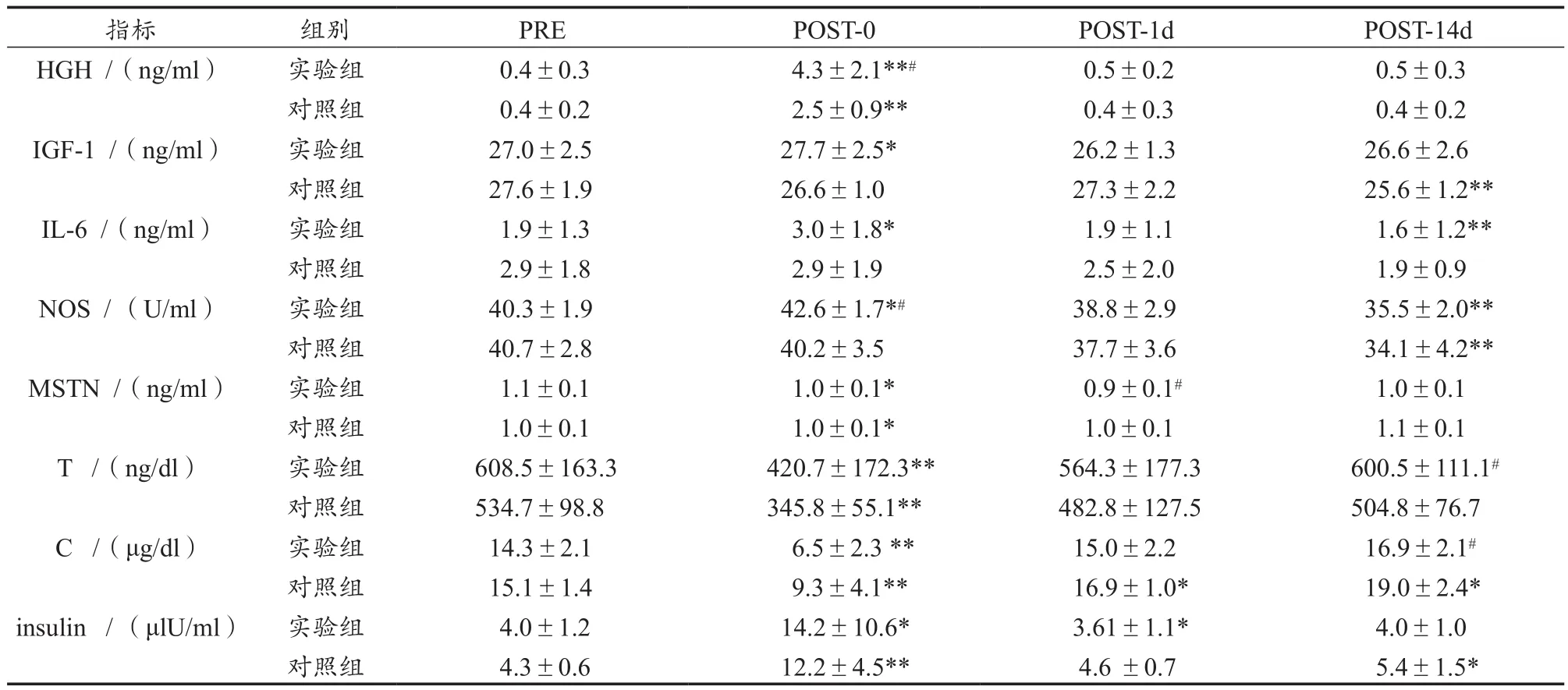
表2 加压训练与传统增肌训练后激素等指标测试值Table 2 Hormone Concentration after KAATSU Training and Traditional Muscle Hypertrophy Training
由此可以看出,与传统训练相比,单次加压训练和传统增肌训练后即刻都会导致HGH的大量分泌,但加压训练的效果要更加明显。从长期效果来看,多次加压训练与传统训练相比,差别不大。
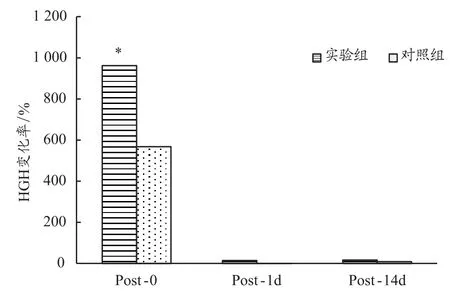
图1 与PRE相比各个时间点HGH变化率Figure 1. The Rate of Change of HGH at Each Time Point Compared with PRE
2.2 单次加压训练前后和多次加压后IGF-1变化
由表2和图2可知,与PRE相比,实验组在POST-0、POST-1d先升高2.6%(P<0.05)后下降-2.7%,而对照组则表现出连续下降-3.8%、-1.2%,两组对比 t 检验均为P>0.05,表明与传统训练相比,单次加压训练会促进运动员机体IGF-1浓度的增加,但与传统方式对比没有显著差异。在POST-14d这一时间点,实验组下降-1.6%,对照组下降-7.2%(P<0.01),两组对比 t 检验P>0.05,这表明,多次加压训练与传统训练相比,多次加压训练能让运动员的IGF-1浓度维持在更好的水平。
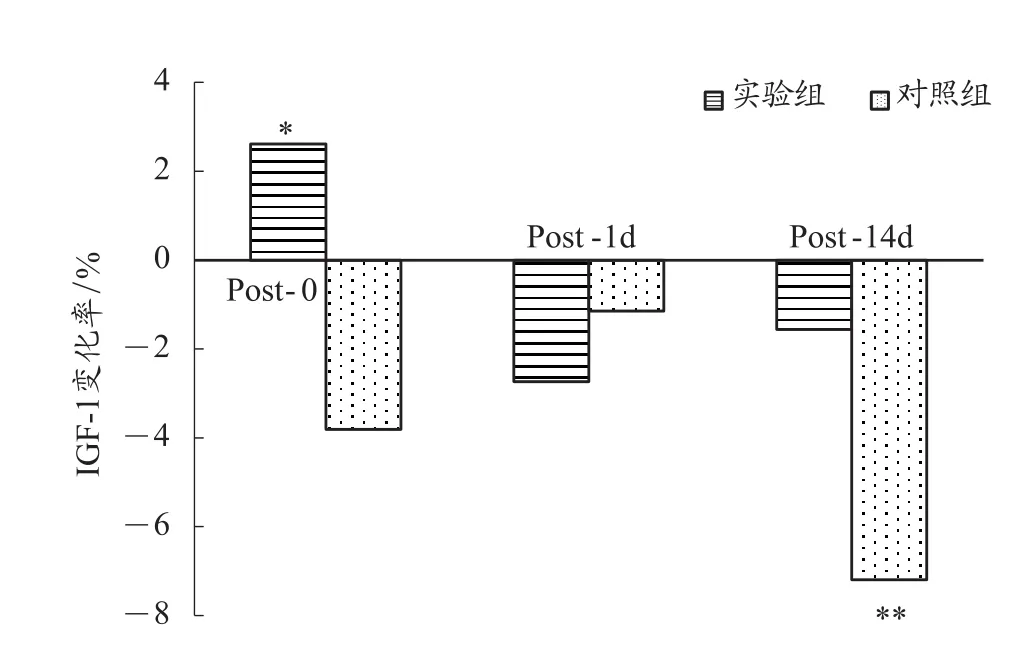
图2 与训练前相比各个时间点IGF-1变化率Figure 2. The Change of IGF-1 at Each Time Point Compared with Previous
2.3 单次加压训练前后和多次加压后IL-6变化
由表2和图3可知,与PRE相比,实验组IL-6浓度变化在POST-0、POST-1d,先升高54.8%(P<0.05)后下降-2.1%,而对照组则表现出缓慢下降趋势,分别下降-0.1%、-14.4%,两组对比 t 检验均为P>0.05。在POST-14d这一时间点,实验组和对照组IL-6水平都略有下降,分别为-16.8%(P<0.01)和35.6%,组间对比 t 检验P>0.05。这表明,单次和多次加压训练与传统训练相比,对运动员机体的IL-6浓度变化的影响没有显著性差异,但是从变化幅度来看,单次加压可显著促进IL-6浓度的增加。
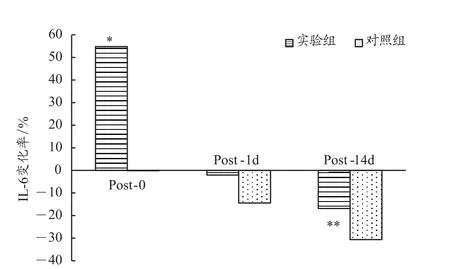
图3 与训练前相比各个时间点IL-6变化率Figure 3. The Change Rate of IL-6 at Each Time Point Compared with Previous
2.4 单次加压训练前后和多次加压后NOS变化
由表2和图4可知,与PRE相比,实验组NOS浓度变化在POST-0上升了-5.7%(P<0.05)、POST-1d略有下降-3.7%,而对照组则显示持续下降,分别为-1.3%、-7.4%,两组对比 t 检验在POST-0出现显著性差异(P<0.05)。这表明,与传统训练相比,单次加压训练在训练后即刻对运动员机体NOS浓度有较明显影响。在POST-14d这一时间点,实验组和对照组NOS水平都显著下降,分别为-11.8%(P<0.01)、-16.3%(P<0.01),两组对比 t 检验P>0.05。这表明,多次加压训练与传统训练相比,对该运动队队员机体NOS浓度变化的影响没有显著性差异。
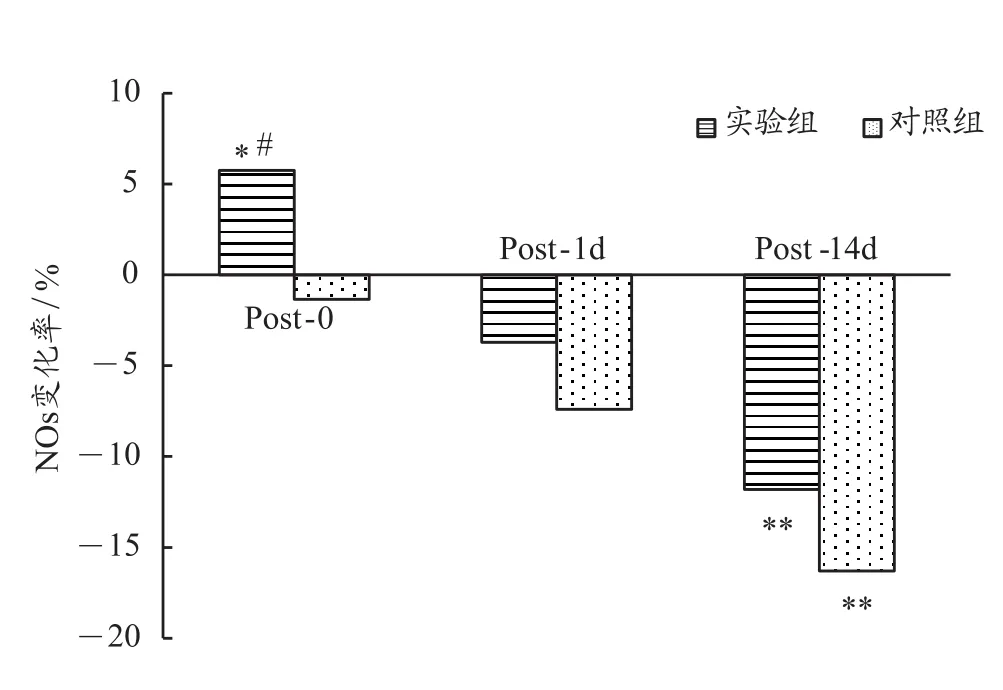
图4 与训练前相比各个时间点NOS变化率Figure 4. The Change Rate of NOS at Each Time Point Compared with Previous
2.5 单次加压训练前后和多次加压后MSTN变化
由表2和图5可知,与PRE相比,实验组MSTN在POST-0、POST-1d呈现略有下降趋势,分别下降-3.3%和-10.7%(P<0.05),而对照组下降了-4.0%和-2.8%,组间 t 检验POST-1d的生长抑素浓度出现显著性变化。这表明,与传统训练相比,单次加压训练对运动员机体MSTN分泌的抑制的影响更显著。在POST-14d这一时间点,实验组下降-2.4%,而对照组上升了2.7%,但组间无显著性差异。这表明,多次加压训练与传统训练相比,对运动员机体MSTN浓度的影响没有显著性差异。
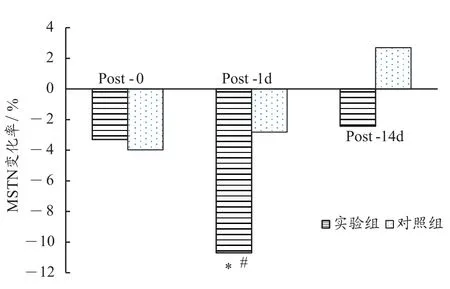
图5 与训练前相比各个时间点MSTN变化率Figure 5. The Change Rate of MSTN at Each Time Point Compared with Previous
2.6 单次加压训练前后和多次加压后血清睾酮的变化
由表2和图6可见,与PRE相比,实验组和对照组的睾酮浓度在POST-0出现非常显著下降,下降率分别为-30.9%和-35.3%,在POST-1d仍下降了-7.3%和-9.7%。这表明,单次急性加压训练与传统训练相比,对运动员机体睾酮变化的影响没有显著差异。在POST-14d,实验组下降了-1.3%,对照组下降了-5.6%,两组间相比具有显著性差异。这表明,与传统增肌训练相比,长时间加压训练,对优秀运动员睾酮分泌的影响较小,加压训练对运动员的训练有利。
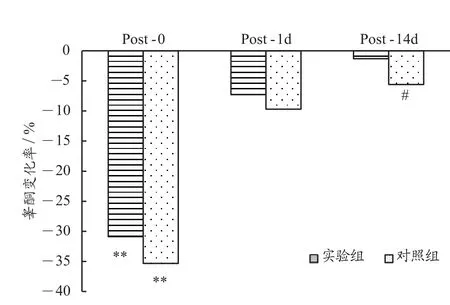
图6 与PRE相比各个时间点睾酮变化率Figure 6. The Rate of Change of T at Each Time Point Compared with PRE
2.7 单次加压训练前后和多次加压后皮质醇的变化
由表2和图7可见,与PRE相比,实验组和对照组的皮质醇值在POST-0分别下降了-54.6%(P<0.01)和-38.9%(P<0.01),实验组和对照组的皮质醇值在POST-1d分别增加了4.6%和11.4%(P<0.05)。这表明,单次加压训练与传统训练相比,对该运动队队员机体皮质醇变化的稍有影响。在POST-14d这一时间点,实验组上升了18.3%,对照组上升了25.3%(P<0.05),两组对比 t 检验P<0.05。这表明,多次加压训练与传统训练相比,加压训练对运动员机体的皮质醇浓度水平有一定的影响。
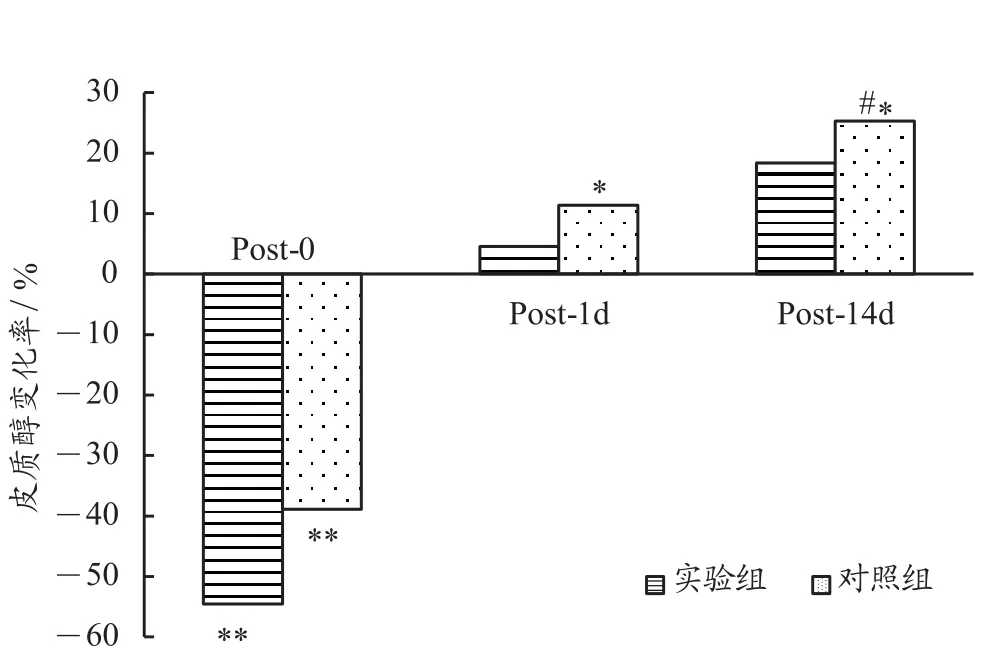
图7 与PRE相比各个时间点皮质醇变化率Figure 7. The Rate of Change of C at Each Time Point Compared with PRE
2.8 单次加压训练前后和多次加压后胰岛素的变化
由表2和图8可知,与PRE相比,实验组和对照组的胰岛素浓度在POST-0显著上升,幅度分别为256.2%(P<0.01)和185.2%(P<0.01),实验组在POST-1d下降-9.3%(P<0.01),对照组上升7.0%。在POST-14d这一时间点,实验组上升0.3%,对照组上升27.4%(P<0.05),但都属于人体正常参考范围。
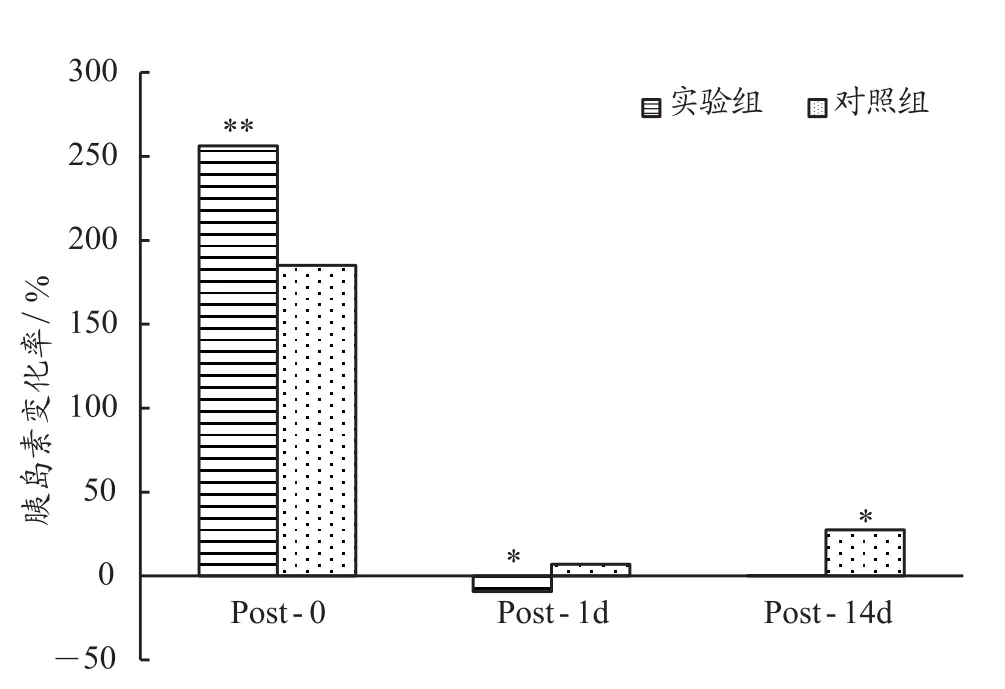
图8 与PRE相比各个时间点胰岛素变化率Figure 8. The Rate of Change of Ins at Each Time Point Compared with PRE
3 讨论与分析
3.1 传统增肌训练和加压训练能促进肌肉增长的原理
肌肉细胞具有很强的适应能力,当肌肉总是承受较大的负荷时,为了完成任务,肌肉会适应性的增粗,这是肌肉增长的适应性原理。肌肉的增粗是通过“肌肉卫星细胞”的增殖实现的。这涉及了肌卫星细胞的激活、增殖与分化。
由图9可知,除了肌组织缺氧、乳酸堆积、PH值降低、肌肉微损伤和快肌参与外,HGH、IGF-1、IL-6等激素的增加是引起NOS分泌增加的主要因素。NOS分泌增加会引起NO增多。NO可通过调控肝细胞生长因子(hepatocyte growth factor,HGF)和MSTN来激活肌肉卫星细胞(Goldspink,1999),使肌肉卫星细胞从休止期(G0)进入分裂周期(G1),开始启动这些卫星细胞的分裂增殖。这些附着于肌纤维的表面的“肌肉卫星细胞”分裂增生后,在睾酮、胰岛素等促进合成代谢的激素环境和足够的相应氨基酸补充下,肌纤维开始数量增多、体积增大。而传统增肌训练主要是通过训练引起的肌肉微损伤途径激活一系列增肌过程。
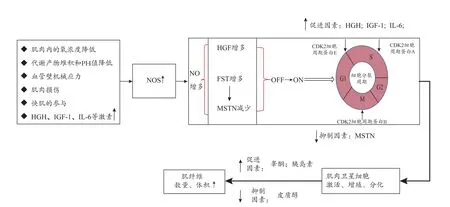
图9 肌肉增长的促进和抑制因素Figure 9. The Promoting and Inhibiting Factors of Muscle Growth
加压训练可以引起局部的乳酸和代谢产物的堆积,并形成一个局部缺氧环境,从而启动NOS的合成和分泌,促进肌卫星细胞的激活、增殖与分化,达到预防肌肉萎缩和促进肌肉增长的作用(魏佳 等,2019b)。在肌卫星细胞激活方面,小负荷加压训练可引起局部乳酸等代谢产物的大量堆积,局部PH值升高,肌肉内环境发生改变,促进NOS的分泌增加,从而引起肌纤维产生NO,NO可通过扩张血管有效维持肌肉局部的适宜环境,同时释放HGF,HGF通过下调MSTN表达来激活肌卫星细胞,有效防治肌肉萎缩。在肌卫星细胞增殖与分化方面,加压训练增加血中HGH、IGF-1等物质的浓度,促进了肌卫星细胞的增殖和分化,IGF-1表达上调是促进肌肉力量和肌肉肥大的主要生理学机制(Abe et al.,2005)。
3.2 加压训练和传统增肌训练HGH变化情况
HGH是影响人体生长发育的重要激素,能够促进蛋白质的合成和骨骼的生长,属于合成代谢类激素。有研究(Yudai et al. 2000)表明,高强度运动(80% 1RM)能显著提高机体HGH浓度100倍,而联合加压训练则能够升高至290倍。Takano等(2005)的研究显示,短期低强度抗阻运动联合加压训练,HGH浓度在运动后逐渐升高,半小时达到顶峰,表明加压训练能够明显提高机体HGH水平,与本研究结果一致。本研究中实验组和对照组HGH浓度在训练后显著增长,虽然增加倍率尚未达到国外报道的水平,但也出现了5~10倍的增长,其中实验组(加压训练)的增长幅度(9.6倍)显著高于对照组(传统增肌训练,5.7倍),提示,加压训练对血清HGH的影响要明显优于传统训练方式。但也有研究(Manini et al.,2012)显示,急性低负荷血流限制训练对HGH的刺激反应同传统训练方式一样。HGH即刻升高的潜在机制可能是肌肉内氧含量降低,肌肉组织代谢需求反馈至下丘脑,刺激垂体释放HGH。另有研究表明,在HGH增加的同时,乳酸也在同步增加,因此可能是肌肉乳酸积累引起了代谢性酸中毒,将信号反馈给下丘脑刺激垂体释放HGH,除此之外,HGH的升高可能也与睾酮的升高存在关联,另外HGH促生长的生物学作用主要由分泌的类IGF-1介导完成,因此,胰岛素样生长因子浓度的同步升高也直接影响HGH(Marx et al.,2002;Takano et al.,2005)。上述实验结果与本研究结果一致,加压训练刺激机体内合成代谢类激素的变化可能存在相同的通路,该机制还有待研究。
3.3 加压训练与传统增肌训练IGF-1的变化情况
IGF-1是一类与胰岛素结构相似的多肽类激素,与人体生长发育和物质代谢密切相关,主要由肝细胞合成,与HGH作用相辅相成,它们能够促进HGH分泌,并介导HGH对细胞的促生长作用,而HGH又可以刺激IGF-1在血液中的循环释放过程,是一类促合成代谢类激素。有报道认为,力量训练没有改变血清IGF-1的浓度(Kraemer et al.,1992,1995;Nicklas et al.,1995),也有研究表明(Abe et al.,2004;Takano et al.,2005)短期低强度抗阻训练联合加压能显著提高血清IGF-1浓度。本研究结果显示加压训练与传统增肌训练在急性训练和长期训练期后的IGF-1浓度都没有出现显著性差异,这与Manini等(2012)的研究结果一致。但两组训练前后的变化趋势图显示,加压组IGF-1浓度在训练后即刻的浓度是显著上升(上升幅度为2.6%,P<0.05),且训练两周后传统增肌训练组则出现明显下降趋势(下降幅度为-7.2%,P<0.01)。该结果表明,与传统训练方式相比,加压训练对IGF-1浓度的提升还是有一定的影响。
循环HGH能刺激肌肉内IGF-1的合成和分泌,且HGH的促生长作用也可通过IGF-1介导,因此,加压训练刺激IGF-1和HGH的变化可能互为正反馈作用,有研究表明,急性运动开始后10 min内,IGF-1水平就可迅速增加13%~26%;升高程度与运动强度有关,但并不依赖于HGH的升高程度(Cappon et al.,1994)。Bang等(1990)研究了男女健康人各3名,运动时间为30 min,当运动到第10 min时,血清IGF-1水平提高26%,而后再进行20 min运动,血清IGF-1浓度已回复到安静状态。所以加压组的升高趋势时间可能在训练中期或刺激较大的某一时刻,训练课结束也可能是血清IGF-1峰值下降区,所以加压训练对IGF-1浓度的影响还需进一步探究。
3.4 加压训练与传统增肌训练IL-6变化情况
IL-6是具有分化和促进生长作用的多种生物活性的细胞因子,是炎症免疫反应的重要介质。近期研究表明,伴随着肌肉损伤,IL-6可能会刺激肌肉的再生过程,协助肌肉的生长和肥大。此外,持续长时间运动时,肌纤维(以及肌肉卫星细胞)本身会分泌IL-6,从而带来全身性的抗炎以及脂肪分解作用。一般情况下,剧烈运动会引起IL-6水平显著提高。Nielsen等(1996)证实,在剧烈运动6 min后,血浆中IL-6水平将提高2倍。Ostrowski等(1998a/b)使用跑台运动模型发现,在运动开始后的第30 min,血浆中的IL-6水平显著提高;而在运动结束后2.5 h,IL-6水平达到峰值。但也有研究表明,IL-6在运动后即刻水平最高,随后缓慢下降。
本研究显示,单次训练课结束后,实验组(加压训练)运动员机体内的IL-6浓度明显升高(升高幅度54.8%,P<0.05),而对照组(传统增肌训练)出现了小幅度的下降;2周训练结束后与传统增肌训练相比,实验组的下降幅度较低。虽然两组的IL-6浓度变化没有显著性差异,但加压训练对肌肉的炎性刺激在一定程度上要大于传统训练方式。
Ostrowski等(1998a/b)曾发现,运动中血浆IL-6的最高值与血浆中乳酸相关。因此,在单次加压训练过程中,局部肌组织缺血缺氧刺激乳酸升高可能也是刺激IL-6急性升高的机制。运动期间IL-6的主要功能之一是响应肌糖原状态并促进葡萄糖代谢(Pedersen et al.,2008),若运动过程中碳水化合物底物消耗过量,血流限制后肌肉不能及时供应新的能源物质,IL-6响应代谢作用降低,其浓度则会自然积累,急性升高。加压训练造成的低氧缺血状态给肌细胞内环境造成了一定压力,酸性代谢废物的积累和能量底物的消耗可能是诱导IL-6急性升高的主要因素。随着训练课次和时间的积累,机体产生对训练的适应可能是加压训练和传统增肌训练都出现IL-6下降的原因。
3.5 加压训练与传统增肌训练NOS变化情况
NOS为NO合成的关键酶,通过检测NOS可间接反映NO水平。肌组织缺氧、乳酸堆积、PH值降低、肌肉微损伤、快肌纤维的参与及HGH、IGF-1、IL-6等激素的增加都可以激活NOS,使细胞释放NO(Charge,2004)。NO可通过调控HGF和MSTN激活肌肉卫星细胞(Goldspink,1999),使肌肉卫星细胞从休止期(G0)进入分裂周期(G1),开始启动卫星细胞的分裂增殖。在运动训练对机体内NO含量和NOS活性的影响方面,其结论较为一致,多数研究认为,长期运动可提高血管内皮和骨骼肌产生NO的能力,这可能与NOS mRNA表达上调有关。关于短期急性运动对体内NOS活性的研究,其结论存在争议。Patil(1993)和Howard(1992)的研究表明,机体在急性运动时,NO分泌增多。但Cleim(1994)的研究让有系统训练的耐力性运动员进行最大强度的力竭性运动时,发现血清中NO含量下降。可见,NO、NOS与短期急性运动及力竭性运动之间的关系还有待考证。
本研究结果显示,加压训练后NOS在训练后即刻上升,而传统训练则导致其下降,训练后次日晨和训练2周后两组均下降,其中,传统增肌训练在2周后的下降幅度较大(-16.3%,P<0.01),该结果表明,加压训练相较于传统训练方式,对NOS的刺激反应较大,在一定程度上可以提高NOS的浓度,促进NO生成,而且这种变化趋势基本和IL-6的变化趋势基本一致(图5、6)。
Aimasheva等(1998)的研究显示,对动物体内增加NO-合成酶阻断剂,会削弱其对剧烈运动的抵抗力,表明在一定程度上,NOS会调节机体的运动适应性,提高机体对高强度训练的耐受能力。由此可见,加压训练对NOS的刺激会提高机体度运动强度的适应性。
3.6 加压训练和传统增肌训练MSTN变化情况
MSTN即生长分化因子8,是转化生长因子超家族成员之一。MSTN通过影响细胞周期实现抑制成肌细胞增殖。在培养的成肌细胞中,MSTN能使细胞周期在G1和G2期之间停止,阻滞向S期的转变,从而抑制成肌细胞的增殖。MSTN除了能调控成肌细胞增殖外,还能负调节肌细胞分化。MSTN可通过下调MyoD、MyoG及其下游靶基因肌酸激酶基因的表达而抑制成肌细胞的分化,因此,MSTN属于分解或抑制代谢类激素。
有关加压训练影响机体内MSTN浓度变化的研究甚少,但一般情况下,急性运动或长期的抗阻力量训练会降低MSTN浓度。Kabak等(2018)的研究表明,搏击运动员在进行急性高强度间歇训练后即刻鸢尾素浓度升高,MSTN浓度降低,两者在运动后3 h恢复到基线水平。另外,在重复抗阻运动和力量训练后,肌组织内MSTN mRNA表达下调(Hulmi et al.,2007),这与运动引起的肌组织肥大增生有关。动物实验表明,运动引起血清或肌组织内MSTN下降可能与胰岛素抵抗有关,一般在缺乏运动导致的胰岛素抵抗情况下会生成MSTN。
本研究中加压训练后次日晨的血清中MSTN降低了-10.7%(P<0.05),而传统训练则仅降低了-2.8%(组间对比P<0.05),表明,单次加压训练在一定程度上能明显降低血清中MSTN浓度,且这种效果要强于传统增肌训练方式。而持续训练2周后,加压训练导致MSTN下降(-2.4%)的效应仍然存在,但幅度明显小于单次加压训练后,说明,随着加压训练的适应,这种训练导致的MSTN下降效应正在减弱,为保证效果,需要及时调整训练。
3.7 加压训练和传统增肌训练睾酮和皮质醇变化情况
3.7.1 睾酮的变化情况
睾酮是一种类固醇激素,来源于胆固醇,已被证明可以提高肌肉蛋白合成,对肌肉组织有显著的合成代谢作用,还能通过抑制泛素途径或抗皮质醇反应等减少肌蛋白分解。Ahtiainen等(2003)的研究表明,运动诱发的睾酮水平升高与肌肉横截面面积之间存在显著相关性。国内外针对运动影响睾酮浓度变化的研究较多,研究表面,一般情况下,急性高强度训练会造成机体内睾酮浓度升高,长时间高强度训练造成机体睾酮浓度变化不一。这与运动负荷和不同类型个体的恢复情况有关。
本研究中加压训练和传统增肌训练后即刻睾酮浓度与晨起相比显著下降。这与Reeves等(2005)的研究结果一致,由于训练时间安排在下午,因此,该结果可能与睾酮的昼夜分泌规律的关系较大,也可能与运动训练(训练持续时长2.5 h)造成的机体疲劳有关,在类似于马拉松式的高强度长时间训练中,机体内睾酮浓度也会出现明显下降。本研究中,实验组和对照组的反应变化无显著性差异,这与Gabriel等(1992)的研究结果相似,但训练2周后下降趋势减缓,且实验组更明显,说明,多次强度负荷是20%~30% 1RM的加压训练与传统增肌中70%~80% 1RM的高强度相比,加压训练对机体的疲劳刺激相对较低。另外,该结果也可能与血流限制造成的缺氧缺血环境使得乳酸和儿茶酚胺浓度增加有关(Loenneke et al.,2010)。
研究表明,乳酸能增加环磷酸腺苷(cyclic adenosine monophosphate,cAMP)浓度,从而刺激间质细胞分泌睾酮,而儿茶酚胺的增加则可通过刺激β-2肾上腺素能受体来刺激间质细胞产生睾酮(Anakwe et al.,1984)。
3.7.2 皮质醇的变化情况
皮质醇是肾上腺皮质分泌的一种糖皮质激素,运动应激时能大量分泌以促进体内分解代谢,如促进糖原分解供能、升高血糖等,从而提高运动能力;但在运动后持续保持高水平则会造成体内能量储备过分消耗,不利于机体的恢复。周期性训练初期,随着训练负荷加大,安静状态下皮质醇通常上升,其生物学意义是提高机体的应激水平,有利于运动肌糖原分解供能,经过一段时间训练后,安静皮质醇又可以恢复到原来水平。这种规律性变化,是机体对训练应激逐步适应的结果。如果进一步加大训练负荷,还会出现先皮质醇先升高后下降的过程。
本研究结果显示,皮质醇浓度在加压训练和传统增肌训练后即刻显著下降,这主要与血清皮质醇的昼夜变化节律有关,而在训练后次日晨起,血清皮质醇则表现出升高趋势,传统增肌训练的增加幅度更加显著,且随着训练周期的延长,传统增肌训练方式引起的血清皮质醇升高趋势也在加大,这与运动应激引起的血清皮质醇变化趋势情况一致。尤其在训练后次日晨对照组比实验组的升高趋势要高,这种变化差异有显著性意义,说明,加压训练对血清皮质醇的反应情况低于对照组。
本研究结果与Reeves等(2005)相似,该研究比较了低负荷加压训练和传统抗阻训练,发现训练后皮质醇浓度没有显著性变化,认为加压训练不会对血清皮质醇不会造成过高反应。这造成这一结果可能与加压训练的负荷强度低有关。传统增肌训练负荷过高会引起血清皮质醇的显著变化,而加压训练负荷相对于传统增肌训练负荷较低,对血清皮质醇的反应也可能降低,且随着训练课次的增加,这种效应更加明显。说明,加压训练有利于降低应激反应,降低机体的疲劳程度,但关于对血清皮质醇反应变化的具体机制有待进一步考证。
3.8 加压训练和传统增肌训练胰岛素变化情况
胰岛素是由胰岛β细胞分泌的唯一能降低血糖的多肽激素,它能转化葡萄糖为糖原和脂肪,或抑制糖的异化和分解,在一定程度上还可促进蛋白质合成,调节人体能量代谢过程。一般情况下,急性运动后人体血清胰岛素明显下降,随着负荷量和运动时间的增加胰岛素下降趋势更明显(朱亚林 等,1996)。其主要机制是运动消耗急需葡萄糖的及时供能,加快肌肉组织对葡萄糖的吸收速,体内葡萄糖浓度下降,血糖浓度的降低会刺激胰高血糖素的升高,胰岛素浓度下降(Roy et al.,2006)。
本研究结果显示,训练后即刻两组胰岛素均显著升高,猜测这可能与训练后即刻的采血点有关,若在训练后稍有恢复时刻采血,此时血糖浓度略有稳定,就会造成胰岛素明显的升高现象。除此之外,运动员补充的含糖饮料也会使机体内血糖浓度稳定,从而导致体内胰岛素升高。从整体上看,加压训练和传统增肌训练对胰岛素的影响基本一致。
3.9 加压训练后相关激素和生物活性因子变化与增肌关系
从本实验结果来看,加压训练后NOS的增加,MSTN表达的下调,可最终引起肌卫星细胞的激活,加压训练引起血液中HGH和IGF-1浓度的增加,可促进肌肉卫星细胞的增殖和分化,最终促进肌肉的肥大。与传统增肌训练相比,这种小负荷加压引起的激素和生物活性因子的变化更加明显。
4 结论
对于竞技水平较高的运动员来说,加压训练与传统增肌训练相比能更加有效地促进与肌肉合成相关的NOs、HGH等激素和生物活性因子的良性变化,且由于负荷相对较小,加压训练更有利于竞技状态的保持。加压训练值得在高水平运动员中推广和应用。此外,为达到更好的训练效果,加压训练同样需要随着机体的适应而调整个体的训练压力和训练负荷。
