鼻咽癌放疗早期涎腺DWI变化及其与放疗后口干程度相关性
2019-06-19范明新戚元刚张晴
范明新, 戚元刚, 张晴
在鼻咽癌的治疗中,放射治疗扮演着重要的角色。Ⅰ、Ⅱ期鼻咽癌患者放疗后5年生存率超过70%[1]。随着生存期的延长,患者对生活质量提出了更高的要求。口干是头颈部肿瘤放疗后最常见且最突出的晚期反应之一。由于放疗照射野包括部分或全部涎腺,患者放疗后涎腺功能会有不同程度的损伤,表现为口腔干燥、味觉障碍、龋齿、吞咽困难和咳嗽等症状。随后其症状迁延并呈进行性加重而无有效控制方法,致睡眠障碍、心情压抑、烦躁易怒,严重影响患者的生活质量[2,3]。放疗所致涎腺功能降低是剂量和体积依从性的。虽然对头颈部肿瘤涎腺的三维放射剂量分布与涎腺功能之间的关系相继有研究报道,但剂量-体积-功能之间的关系目前仍未十分明确。目前有研究认为26~35 Gy是涎腺受损的临界剂量[4,5]。近年来,随着调强放疗(intensity-modulated radiotherapy,IMRT) 应用的普及,放疗剂量分布更加适形于靶区,涎腺的受照剂量减少,但严重口干症仍时有发生[6,7]。因此,对放疗后口干的早期预测具有重要的临床意义。
磁共振检查具有方便快捷、多参数成像、无辐射危害等优势。近年来,弥散加权成像(DWI)、动态增强扫描、涎管成像等检查方法,已初步应用于放疗后涎腺功能评价的研究中[8-10]。研究表明放疗后涎腺静息状态下表观扩散系数(ADC)、酸刺激后ADC变化情况均可较好的反映放疗后涎腺功能损伤程度[11]。然而,放疗后早期涎腺ADC的变化情况及其是否对放疗后口干具有预测价值目前尚未见报道。本研究主要目的放疗后早期如2周涎腺ADC的变化趋势及其对放疗后6个月口干程度的相关性。
材料与方法
1.研究对象
2014年6月-2015年12月,26例经病理确诊的初治鼻咽癌患者均按计划完成预期的IMRT。男17例,女9例,中位年龄51岁(37~63岁)。26例均为鳞癌,其中高分化3例,中分化3例,低分化12例,未分化8例。临床TNM分期Ⅱ期3例,Ⅲ期16例,Ⅳ期7例。所有患者治疗前均无口干症状或其他涎腺疾病。
2.放射治疗
全部患者首诊是均接受根治性调强放射治疗。患者取仰卧体位,采用热塑面罩固定头颈部。然后在CT模拟定位机下从头顶向下螺旋平扫和增强扫描至锁骨头下5 mm,层厚3 mm。放射治疗应用同步推量调强放射治疗(intensity-modulated radiotherapy with simultaneous integrated boost,IMRT-SIB)。
大体肿瘤体积(gross target volume,GTV)包括根据增强CT或MRI确定的鼻咽部原发肿瘤和阳性淋巴结。临床靶区体积1(clinical target volume,CTV)高危淋巴结引流区为GTV外扩5 mm,包括:鼻咽、蝶窦下部、翼腭窝、颅底、鼻腔上颌窦后1/3、咽旁间隙、口咽及颈部淋巴引流区Ⅱ、Ⅲ和Ⅴa 区淋巴结。临床靶体积2(CTV2)低危淋巴结引流区为环甲膜以下的下颈部。在接近脑干、脊髓方向勾画时外放边界可相应缩小至3 mm。计划靶区(planning target volume,PTV)由CTVs外扩5 mm且在调强治疗计划系统按不确定因素自动生成。
PGTV、PCTV1、PCTV2的分割剂量分别为2.2 Gy/次、2.0 Gy/次、1.8 Gy/次,均为30次。处方剂量:PGTV 66 Gy,PCTV1 60 Gy,PCTV2 54 Gy。30次放疗结束后行大孔径CT复位,根据肿瘤及淋巴结退缩情况,行局部加量放疗,2.0 Gy/次,总照射剂量66~74 Gy。
放射治疗设定危及器官包括腮腺、脑干、脊髓、视神经、晶状体、颞颌关节、下颌骨等。剂量限定:腮腺25~30 Gy,脑干45~50 Gy、脊髓35~40 Gy,视神经、视交叉和垂体40~50 Gy,颞叶40~55 Gy,晶体6~9 Gy,颞颌关节40~50 Gy,下颌骨45~50 Gy。对双侧颌下腺照射剂量无限制。
3.MR DWI 检查
所有患者于放疗前、放疗开始后2周各行MRI检查1次。使用3.0T 磁共振仪(Philips Achieva 3.0T,荷兰)和16通道头颈联合线圈进行磁共振成像。每次检查先行常规MRI检查,然后行MR DWI成像检查。常规MRI检查包括轴面T1WI、T2WI和冠状面或矢状面T2WI。DWI检查釆用自旋回波-平面回波成像(spin-echo echo planar imaging,SE-EPI)序列,扩散敏感梯度加在X、Y、Z 3个方向上,使扩散各向异性的影响最小化。扫描范围包括两侧腮腺及颌下腺。DWI扫描参数:TR 5563 ms,TE 46 ms,层厚4 mm,间隔1 mm,矩阵136×109,视野22 cm×22 cm,激励次数NSA 2次,扩散敏感因子(b)值取0,200,500,800 s/mm2,扫描时间87 s。由于ADC图分辨率较差,在勾划感兴趣区(ROI)时容易产生错位,为了减小这种误差,我们在DWI扫描前先行T2WI定位扫描一次,定位扫描范围、层厚、层间隔均与DWI保持一致,使其图像可叠加融合在ADC图上,从而对腺体的定位和测量更为精确。所有患者先在静息状态下对腮腺、颌下腺行T2WI定位扫描及DWI扫描,然后给患者口服维生素C片(100 mg×6片),嘱患者含于口腔内直至其完全溶解,且不能阻嚼,并尽可能减少吞咽运动,于酸刺激状态下重复对腮腺行DWI扫描10次,每次间隔13 s。
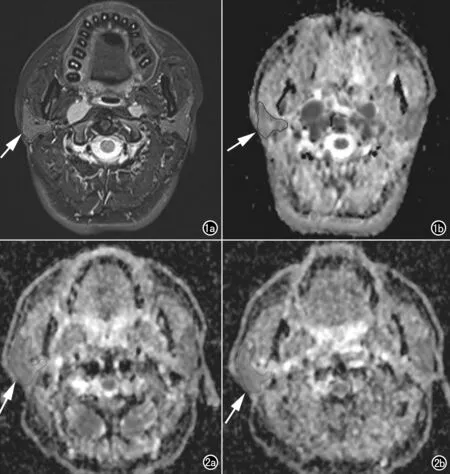
图1 涎腺ADC值测量过程。a) 60岁,男,鼻咽癌患者放疗前T2WI图像,先手动勾画腮腺感兴趣区(箭); b) 对应的ADC图感兴趣区(箭)会自动复制到相应的ADC图上进行计算。 图2 a) 53岁,男,鼻咽癌患者放疗前静息状态下ADC图; b) 放疗后2周,放疗前静息状态下腮腺平均ADC值0.89×10-3mm2/s,放疗后2周升至1.24×10-3mm2/s。
采用Philips公司Extended MR Workspace 2.6.3.4工作站集成软件对DWI进行后处理。选择包含腮腺或颌下腺最大截面的3个层面在T2WI定位图上手动勾划ROI,尽量包含所有腺体,但勾划涎腺时须除外如下颌后静脉、颈外动脉等大血管区域,并将存在严重伪影的图像舍弃。这些ROI将通过软件自动叠加在酸刺激前后所有DWI及ADC图上,使对涎腺边缘的描绘更为精确,且保证在酸刺激前后所有ADC图上的ROI相同。每个腺体的ADC值取所选3个平面的平均值(图1、2)。测量双侧腮腺、颌下腺静息状态下平均ADC值(ADCR)、酸刺激后的ADC升高值(ADCI)及升高率(ADCIR)。ADCI定义为涎腺酸刺激后ADC最大值与静息值之间的差值;ADCIR为涎腺酸刺激后ADCI与静息值之间的比值。计算放疗后2周上述测量值与放疗前测量值之间的差值(ΔADCR、ΔADCI、ΔADCIR)并分析其余放疗后6个月时口干程度的相关性。
4.对涎腺功能的主观评价
于放疗前、放疗后6个月,根据RTOG/EORTC放射损伤分级标准,将患者的临床症状分为5级。0级:无变化;1级:轻微口干/对刺激有反应;2级:中度口干/对刺激反应差;3级:明显口干/对刺激无反应;4级:纤维化。
5.统计方法
采用SPSS 16.0统计软件。所有数值采用均数±标准差表示。用威斯康星配对符号秩和检验比较涎腺静息状态下、酸刺激后以及放疗前、放疗后2周涎腺各ADC值之间的差异;釆用Spearman等级相关分析,观察性别、年龄、涎腺剂量及放疗后2周与放疗前各ADC测量值之间的差值(ΔADCR、ΔADCI、ΔADCIR)与放疗后半年口干程度的相关性。均为双侧检验,当P<0.05时,差异有统计学意义。
结 果
对于静息状态下腮腺及颌下腺ADCR值(×10-3mm2/s),放疗后2周较放疗前明显升高(1.35±0.21 vs 0.92±0.05,P<0.01;1.39±0.13 vs 1.24±0.70,P<0.01,图2)。放疗前及放疗开始后2周,酸刺激后均可观察到腮腺ADC值先升高,然后波动性下降,峰值均出现在酸刺激后6 min之内。酸刺激后腮腺ADCI(×10-3mm2/s)及ADCIR(%),放疗后2周较放疗前均显著降低(0.27±0.71 vs 0.38±0.08,P<0.01;20.45±6.17 vs 41.19±9.50,P<0.01)。放疗前及放疗后2周,酸刺激后颌下腺ADC值亦见轻微升高,但是放疗后2周,酸刺激后颌下腺ADCI(×10-3mm2/s)及ADCIR(%),较放疗前无显著性差异(0.16±0.05 vs 0.15±0.04,P=0.49;11.27±3.37 vs 12.06±3.16,P=0.41,表1)。
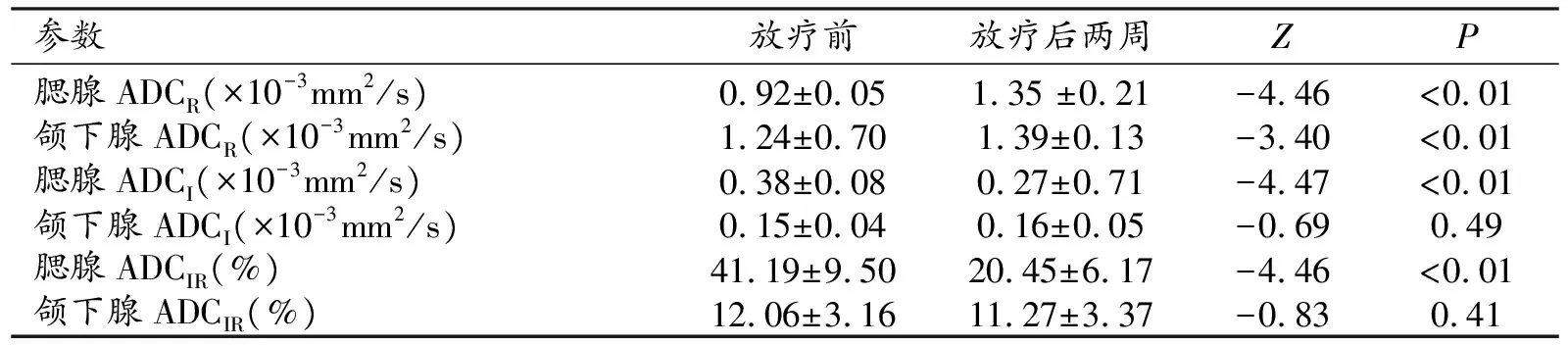
表1 放疗后两周与放疗前各参数比较
根据RTOG/EORTC放射损伤分级标准,所有患者放疗前口干评级均为0级;放疗后6个月,1例患者口干0级,12例1级,11例2级,2例3级。经相关性分析,腮腺ΔADCR、ΔADCI和ΔADCIR与放疗后6个月口干程度具有显著相关性(r=0.55,P<0.01;r=-0.61,P<0.01;r=-0.72,P<0.01);颌下腺ΔADCR值、性别、年龄、腮腺及颌下腺放疗剂量均与放疗后6个月口干程度无显著相关性(r=-0.17,-0.31,0.02,0.01和0.22,均P>0.05)。
讨 论
本研究我们观察鼻咽癌患者放疗过程中早期涎腺ADC的变化趋势及其与放疗后6个月口干程度的相关性。初步结果表明放疗开始后早期静息状态下腮腺、颌下腺ADC值较放疗前明显升高。酸刺激后腮腺ADC升高值及升高率较放疗前显著降低,放疗开始后2周酸刺激后腮腺ADC升高值及升高率与放疗前的差值均与放疗后6个月口干程度具有显著相关性。
在头颈部肿瘤尤其是鼻咽癌的治疗中,放射治疗扮演着重要的角色。鼻咽癌患者Ⅰ、Ⅱ、Ⅲ和Ⅳ期放疗后5年生存率分别>90%、>70%、50%及30%[1]。随着生存期的延长,患者对生活质量提出了更高的要求。研究显示放射治疗后长期生存的鼻咽癌患者中有84.5%表现出不同程度的放疗后不良反应,最常见的包括口干、皮肤纤维化、张口困难、放射性骨坏死、颅神经损伤、内分泌紊乱等,其中值得注意的是放疗后几乎100%的患者有不同程度口干症状[12,13]。由于腮腺解剖位置紧邻咽旁间隙,而咽旁间隙又是鼻咽癌淋巴结转移的好发部位,因此在放疗过程中腮腺不可避免的受到较高剂量射线的照射成为鼻咽癌放疗最重要危及器官之一[14]。IMRT技术的出现及发展,明显降低了头颈部肿瘤患者放疗后口干的发生率,但较严重口干症状仍时有发生[6,7]。放疗引起的急性唾液腺损伤与晚期功能障碍,主要表现为唾液腺组织结构的改变及唾液分泌功能的减退,唾液腺结构及功能的改变可引起口腔干燥、龋齿、营养障碍等一系列并发症,改变患者睡眠、饮食和说话习惯,影响患者全身营养状况,严重地降低了患者的生活质量[2]。因此,对放疗后口干的早期预测具有重要的临床意义。
放疗所致涎腺功能降低是剂量依从性的。随着涎腺受照剂量增加,损伤进行性加重,并最终导致不可逆的改变。目前有研究认为26~35 Gy是涎腺受损的临界剂量,但各个研究结果并不一致[4,5]。研究[15]显示放疗诱导的晚期涎腺损伤可能还与受照剂量的空间分布相关。虽然对头颈部肿瘤涎腺的三维放射剂量分布与涎腺功能之间的关系相继有研究报道,但剂量-体积-功能之间的关系目前仍未十分明确。另外,Bussels等[16]研究表明患者之间存在较大的个体差异,即使低剂量的照射(10~15 Gy)也可能引发严重的涎腺功能损害。因此,仅观察放射剂量对放疗后涎腺功能的影响可能是不充分的。
研究表明放疗后涎腺静息状态下ADC、酸刺激后ADC变化情况均可较好的反映放疗后涎腺功能损伤程度[11]。然而,放疗开始后早期涎腺ADC的变化是否对放疗结束后口干程度具有预测价值目前尚未见报道。本研究我们主要观察放疗后早期如2周涎腺ADC的变化趋势及其对放疗后6个月口干情况的预测价值。
初步结果表明放疗前静息状态下腮腺、颌下腺ADC值分别为(0.92±0.05) 和(1.24±0.07)×10-3mm2/s,与部分研究结果[17,18]并不一致。我们认为MR机器的型号、ROI的勾画、扫描参数以及b值的选择可能影响这些参数的测量结果。本研究我们选择一系列大小不等的b值,以兼顾弥散作用和灌注作用对测量结果的影响[19]。放疗后2周静息腮腺、颌下腺ADC值较放疗前明显升高,这与多数研究结果具有相同的趋势[11,20],作者推测其原因可能是放疗导致涎腺组织中浆液性细胞丢失,细胞构成比降低,而细胞外间隙相对增加[21]。Kato等[22]观察原发性口干患者,酸刺激后腮腺ADC升高率较对照组显著降低。本研究酸刺激后腮腺ADC升高值及升高率较放疗前显著降低,与上述结果一致。Zhang等[20]研究口干与放疗后颌下腺静息ADC及酸刺激后腮腺最大值等因素相关。我们观察的是两次DWI检查各涎腺ADC之间的差值,我们认为这些差值应该更能反映放疗对涎腺功能的影响。酸刺激后腮腺ADC升高值、升高率与放疗后口干分级具有显著相关性。
本研究不足之处:①我们仅仅观察了放疗后2周各涎腺ADC变化值与放疗结束后半年口干程度的相关性。研究表明[23]调强放疗结束后涎腺功能随时间有一个动态变化的过程。放疗后最初几个月,口干症状较放疗前明显进展。但是6个月后,口干症状开始逐步好转。因此,我们主要观察了放疗后早期各涎腺ADC变化情况及其与放疗结束后半年的相关性,但与其他各时间段口干程度的相关性尚需进一步研究。②由于DWI检查时间、空间分辨率低,尽管重复进行多次DWI检查,各ADC参数测量仍不甚精确。③本研究样本量偏小。
我们的初步结果表明放疗后早期静息状态下腮腺、颌下腺ADC值较放疗前明显升高。酸刺激后腮腺ADC升高值及升高率较放疗前显著降低,放疗后2周酸刺激后腮腺ADC升高值及升高率与放疗前的差值均与放疗后6个月口干程度具有显著相关性。放疗开始后早期涎腺ADC的变化情况或许可以作为放疗后口干程度的预测因子,值得进一步研究。
