Fe、Cr掺杂TiO2光催化分解水制氢综合性实验设计
2019-06-18杨修洁胡若娜吴萍萍殷长龙
杨修洁, 胡若娜, 张 鹏, 吴萍萍, 殷长龙
(中国石油大学(华东) 化学工程学院, 山东 青岛 266580)

化石能源的大量使用及其对环境造成的危害,成为国际社会关注的热点问题之一。氢气可由水分解制得,燃烧产物也仅为水,故氢能被视为最清洁的可再生能源,一直吸引着研究人员的兴趣。实现太阳能分解水制氢,不仅是能源利用的一个巨大突破,并且可以缓解如今严峻的环境污染问题[8-10]。1972年,Fujishima和Honda首次发现了TiO2的光催化效应,由此揭开了半导体光催化技术的序幕[11]。TiO2是一种常见的n型半导体,有着无毒无害、化学稳定性高、成本低、可重复利用等特点[12-15]。由于TiO2的带隙宽度大于1.23 eV,且其价带顶的电势高于O2/H2O氧化还原电势,导带底的电势低于H+/H2的氧化还原电势,所以TiO2能光催化水分解制氢。但由于TiO2的带隙过高,对光的吸收主要集中于紫外光的范围内,限制了其对可见光的利用率。金属负载[16]、离子掺杂[17]、构建异质结[18]等方法是提高TiO2的光催化性能的主要方法。
本实验主要研究过渡金属Fe、Cr的掺杂对TiO2光催化分解水制氢的影响。通过比较TiO2、Fe-TiO2、Cr-TiO23种光催化剂在相同条件下的光催化产氢量探索过渡金属掺杂对TiO2光催化剂的光催化性能影响。本实验涉及到化学、环境、材料、仪器分析等多门学科方面的知识,可以提升学生的化学学科实验操作能力、对数据和图表的分析计算处理的能力、以及所学知识的综合运用能力,以培养学生的自主学习能力和创新思维。
1 实验部分
1.1 实验目的
(1) 掌握高温固相合成方法;
(2) 掌握光催化分解水的原理和方法;
(3) 掌握内标法进行定性定量检测的方法。
1.2 实验仪器与试剂
药品:钛酸四异丙酯,冰醋酸,九水合硝酸铁(Fe(NO3)3·9H2O),九水合硝酸铬(Cr(NO3)3·9H2O)均为分析纯。
仪器:电子天平,烘箱,马弗炉,磁力搅拌器,超声波清洗机,X-射线粉末衍射(Bruker D8, Cu Kα激发源),气相色谱(Shimadzu GC-14B 气相色谱工作站),紫外-可见漫反射光谱仪,光反应装置(由300 W氙灯、石英冷阱、搅拌器等,详见1.4中的图1)。
气体:氩气,甲烷(99.99%)。
1.3 光催化剂的制备
采用溶胶-凝胶法制备Fe掺杂的TiO2光催化剂。
(1) 将2.5 mL钛酸四异丙酯加入到4.3 mL冰醋酸中,在冰浴中剧烈搅拌30 min以形成溶胶;然后,在充分搅拌条件下向溶胶体系中缓慢滴加170 mg九水合硝酸铁的水溶液(53 mL);将所得混合物在0 ℃下超声处理20 min,再搅拌2 h,混合物在室温黑暗条件下放置1 d;
(2) 将混合物置于烘箱内,在76 ℃下凝胶化12 h;
(3) 将凝胶置于烘箱中,于120 ℃下干燥3 h。将干燥的凝胶用研钵研磨成细粉,并在550 ℃下煅烧3 h,即得Fe掺杂的TiO2,记为Fe -TiO2。
安排平行小组,采用相同方法制备未掺杂和Cr掺杂的TiO2,分别记为TiO2、Cr -TiO2。
(4) 利用所制备的光催化剂进行光催化分解水性能测试,3组学生平行进行实验。
1.4 光催化分解水产氢实验
实验所用的光催化反应装置如图1所示,由光源(300 W氙灯)、石英灯罩、滤光片、八位样品固定托盘、磁力搅拌器等组成。光催化分解水产氢实验在密闭的Pyrex试管中进行,以300 W氙灯作为光源,并使用滤光片除去小于400 nm的紫外光。
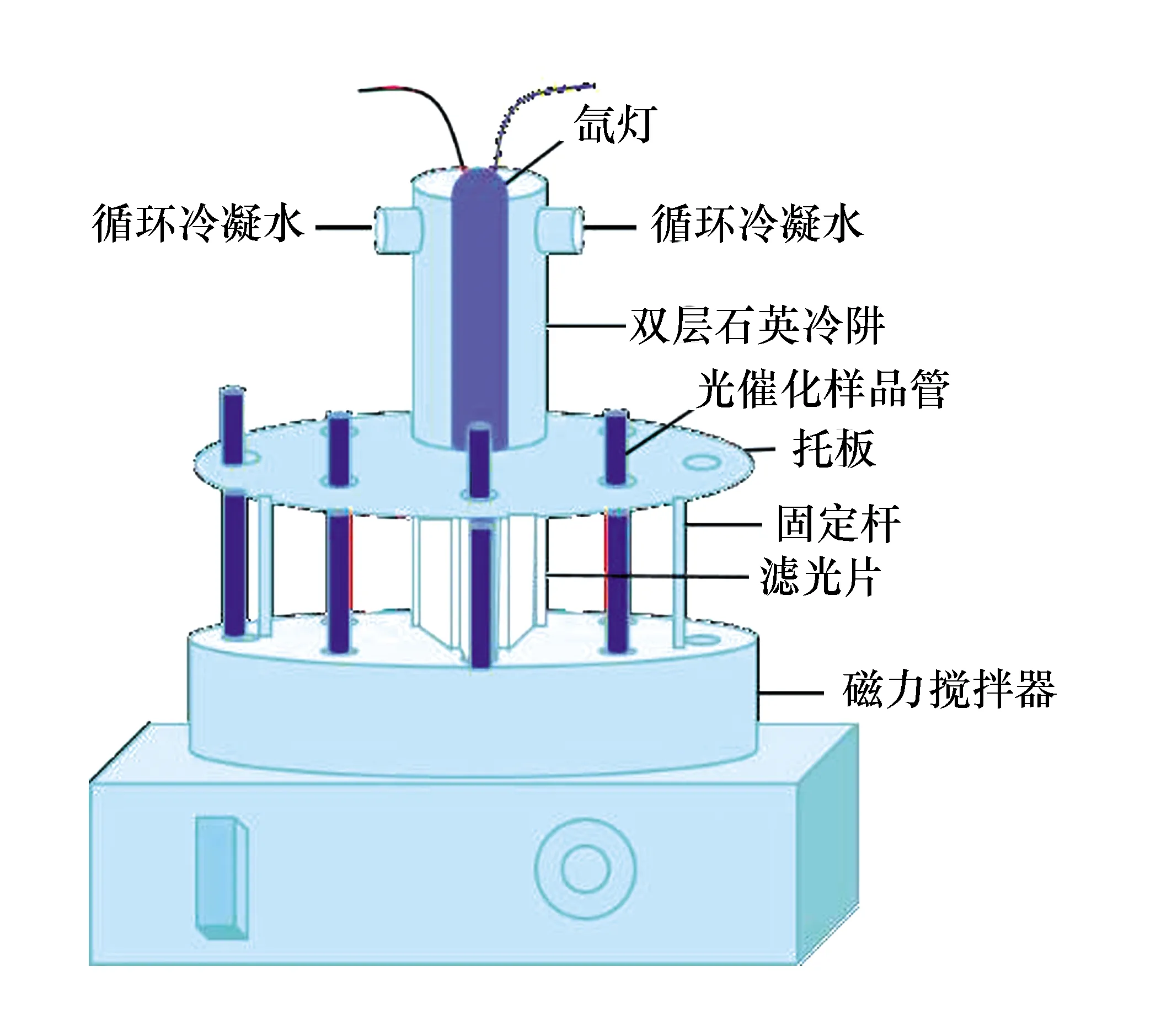
图1 光催化反应装置示意图
称取10 mg光催化剂加入10 mL甲醇(作为电子牺牲体)和40 mL水(比例为1∶4)的混合溶剂中,采用氩气对体系进行鼓泡除气20 min,然后向体系中注入500 μL甲烷标准气体并密封;将该密闭体系转移至光源下,采用磁力搅拌器进行充分搅拌,光照一定时间后,使用气相色谱内标法对体系的产氢量进行定性和定量分析。
1.5 体系产氢量的气相色谱分析法
由于体系氢气产量小于10 mL,实验采用气相色谱内标法对体系的产氢进行定性和定量分析,选择甲烷作为内标物。检测过程中,采用氩气作为载气,热导检测器作为氢气检测器,进样口、分析柱和检测器温度分别设定为 90 ℃和100 ℃,热导检测器工作池电流为 70 mA。在此检测条件下,氢气的保留时间为0.3~0.5 min,甲烷的保留时间为4.3~4.5 min,如图2所示。
由于氢气和甲烷两种气体在热导检测器上的响应不同,定量分析首先需要测定氢气/甲烷的响应因子。取氢气标准气体进行定量进样,记录色谱图。以体积VH2为横坐标,峰面积SH2为纵坐标绘制标准曲线,如图3(a)所示,对应的方程为:
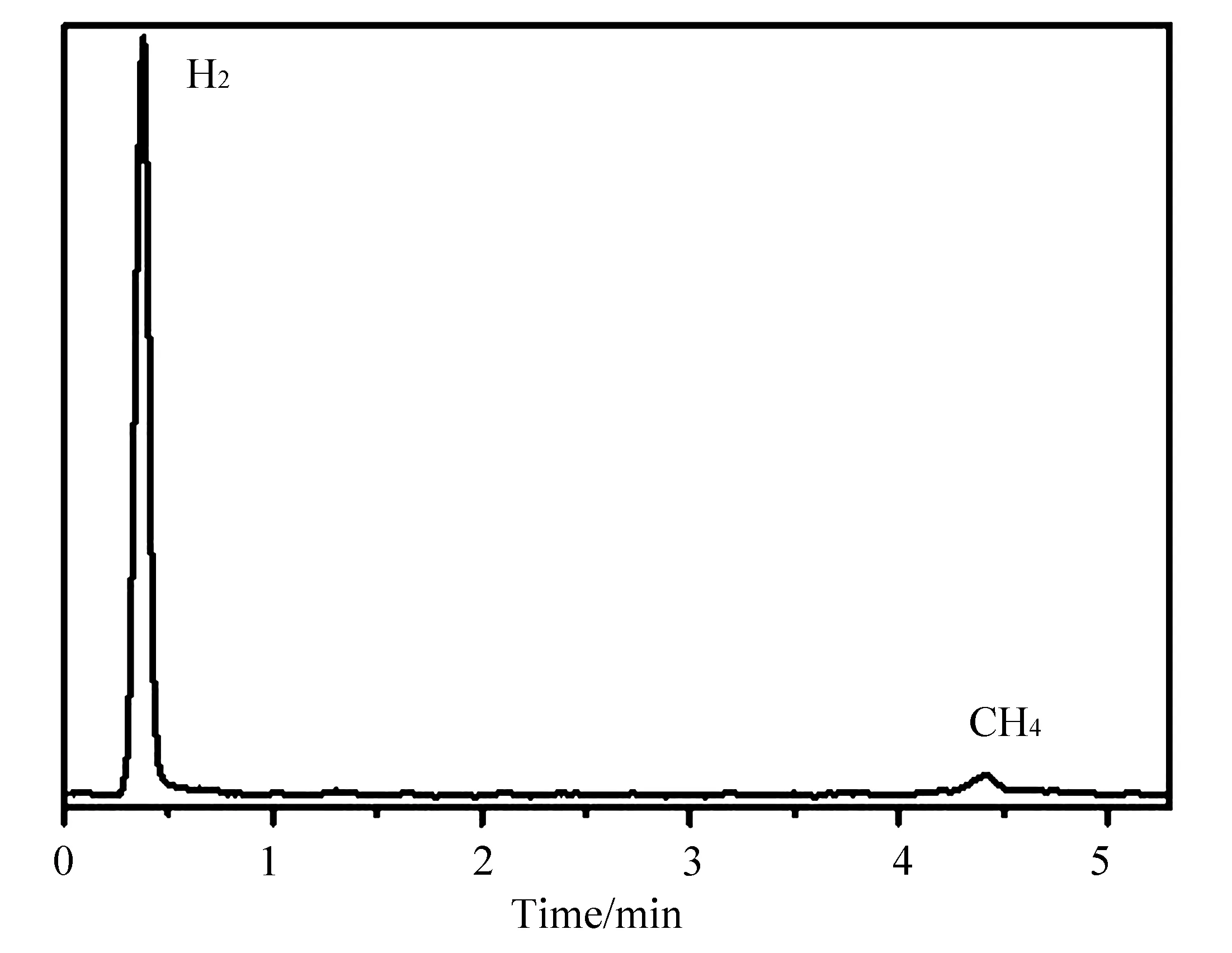
图2 气相色谱法定性分析氢气和甲烷
SH2=433 062+10 015×VH2
(1)
R2=0.999 1,标准曲线可用,斜率即KH2为10 015;同样方法得到甲烷CH2峰面积与体积的关系曲线,如图3(b)所示,对应的方程为:
SCH4=3 317×VCH4
(2)
R2=0.999 4,标准曲线可用,斜率即KCH4为3 317。氢气/甲烷的响应因子:
(3)

图3 氢气(a)和甲烷(b)的峰面积与体积的关系图

(4)
计算得到。第二次检测时,考虑到第一次检测时体系中两种气体的损失,体系实际的氢气产量应为:
(5)
其中VCH41和VH21分别为第一次检测时甲烷和氢气的实际抽取量,对应的计算公式分别为:
(6)
(7)
以此类推,可计算得出第n次时间间隔时体系的实际氢气产量。(注:公式4—7中所涉及上标代表第几次检测)
2 结果与讨论
2.1 XRD表征
图4是Cr-TiO2、Fe-TiO2和Cr-TiO2的XRD图谱。根据特征衍射峰的位置可知制备的TiO2、Fe-TiO2和Cr-TiO23种样品均为锐钛矿相二氧化钛。并且Fe、Cr两种金属掺杂之后,XRD的峰位置和峰强度较未掺杂的TiO2均无明显变化,证明该两种金属掺杂均没有对TiO2的结晶造成明显影响。原因可能是由于金属以填充的方式掺杂到TiO2晶格中,也可能是金属替换了晶格中的Ti原子进行掺杂,所以没有造成晶格的改变。

图4 Cr-TiO2、Fe-TiO2和TiO2的XRD图
2.2 UV-Vis漫反射光谱
对TiO2、Fe-TiO2和Cr-TiO2样品进行紫外可见(UV-Vis)漫反射测试,如图5所示。TiO2在400~600 nm区域没有明显的吸收,只具有紫外光响应性,而Cr-TiO2和Fe-TiO2在350~420 nm的吸收得到明显增强,吸收边明显红移至可见光区,同时在400~550 nm出现明显的吸收峰,可能是由于Fe3+、Cr3+自身的d-d跃迁以及Fe3+、Cr3+的占据d轨道向导带发生跃迁,容易在TiO2禁带中加入一个能级,减小其价带电子激发所需要的能量。

图5 TiO2、Cr-TiO2和Fe-TiO2的紫外可见漫反射光谱图
通过UV-Vis漫反射光谱可以求得其带隙,如图5右上角所示,纵坐标为(AhV)2,横坐标为hV,通过公式
(8)
即可求出带隙(Eg)宽度。 未掺杂TiO2的带隙宽度为3.33 eV,经过Fe、Cr掺杂后TiO2的带隙宽度分别为3.02 eV和3.03 eV。
2.3 光催化产氢活性研究
以合成的TiO2、Fe-TiO2和Cr-TiO2作为光催化剂,光照4 h的产氢量如图6所示。由图6可知,TiO2体系的产氢量最少,为96 μmol·g-1,这可能与其带隙较宽、在可见光区吸收很弱有关。Fe-TiO2体系和Cr-TiO2体系的产氢量分别可以达到895 μmol·g-1和1250 μmol·g-1,相比于未掺杂的TiO2分别提高了9倍和13倍。

图6 光照4 h后TiO2、Fe-TiO2和Cr-TiO2光催化体系的产氢量
3 实验教学模式与内容拓展
(1) 本实验将本科实验教学与学术前沿结合起来,学生以光催化分解水产氢、半导体制备与改性为主题自选关键词进行文献调研,在查阅资料的同时自主对实验所涵盖的知识进行归纳和总结,锻炼学生的文献调研、文献检索和文献阅读能力,了解相关研究领域的学术前沿知识。
(2) 通过X-射线衍射仪、紫外-可见漫反射仪、气相色谱仪等大型仪器的使用,发挥大型精密仪器在本科实验教学中的作用。实验中所涉及的仪器普通高等院校基本都已配备,同时仪器的操作难度系数较低,经过简单培训学生就能独立操作,可以增强学生对大型仪器的了解和动手操作能力。
(3) 本综合实验特别强化了学生对气相色谱定性分析、内标法定量分析的掌握和应用。同时,所得实验数据需要通过origin软件进行处理,强化了学生的数据处理和分析能力。
(4) 本实验可开设为综合开放式实验模式。在上述实验结束后,结合学生文献调研的结果,引导学生从其他角度,如不同掺杂量、不同掺杂方法(碱热法、水热法、溶剂热法、直接氧化法等)、不同金属掺杂等方面对实验内容进行拓展性研究,培养学生实验创新能力。在对实验进行拓展时,学生以团队的形式分工进行实验,针对实验设计展开交流讨论,改进实验方案,从而提升学生的交流能力和团队协作能力。
(5) 以团队的形式对实验结果进行归纳总结,整理成论文,锻炼提高了学生的学术论文写作能力,系统地培养了学生的科研素养,为学生开展大学生创新实验项目、毕业设计以及研究生阶段的学习奠定较好的基础。
