类器官研究进展及应用
2019-06-18董研博郑梦竹刘良发李山虎
董研博,王 健,郑梦竹,刘良发,李山虎
(1.首都医科大学附属北京友谊医院耳鼻咽喉头颈外科,北京 100050;2.军事科学院军事医学研究院生物工程研究所细胞工程实验室,北京 100850)
现有的生物医学研究模型主要是细胞系模型和动物模型。细胞系模型简易、经济,最常用,但是单层细胞的生长模式缺乏细胞-细胞、细胞-细胞基质间的相互作用,体外培养的过程中会丢失细胞的异质性和其在体内的特征,从而无法模拟体内复杂的三维环境及组织细胞功能和相关的信号通路[1]。动物模型可以近似地概括人体生理学,但往往受限于成像观察、混杂变量、出入量有限、可用性限制及动物和人在生物学上的差异[2]。
近年来兴起的类器官模型弥补了以上缺点。类器官是指由具有干细胞潜能的细胞进行体外三维培养后形成的细胞团,其具有自我更新和自我组装的能力,并表现出与来源组织相似的结构和功能[3-4]。与传统的细胞系模型不同,类器官不仅能够长期传代培养,且具有稳定的表型和遗传学特性。
20世纪八十年代,研究者发现哺乳动物的细胞具有分化成自身组织的能力[5-6]。在此基础上,2009年Sato等[7]将来源于小鼠肠道的成体干细胞培养在含有表皮生长因子(epidermal growth factor,EGF)、Noggin、R-spondin的三维基质凝胶(Matrigel)培养体系中,培育出了类似小肠的显微结构,即隐窝-绒毛样复合体,成功建立肠类器官培养系统。之后,他们又利用该体系对前期筛选出的单个富含亮氨酸重复序列G 蛋白偶联受体5+(leucine-rich repeatcontaining G protein-coupled receptor 5+,Lgr5+)肠干细胞进行培养,发现也能形成具有上述特殊结构的类器官,并且仍有Lgr5+肠干细胞的存在[8]。可见,该体系下构建的类器官能够很好地模拟体内小肠的形态结构和功能,且维持了干细胞的存在。后来,他们将这个方法扩展到结肠和肿瘤类器官的培养上[9],开启了类器官的研究。目前,国内外学者已成功培育出了具有三维立体结构的结肠、食管、胰、肝、前列腺和乳腺等结构的类器官和相应的肿瘤类器官。
类器官的三维培养需要利用生物工程的方法来引导细胞分裂和分化。细胞因子和细胞外基质组成干细胞培养微环境,是类器官更新和分化的物质基础。通过人为调控培养系统的成分,由细胞自主的分化为特定结构,完成类器官自组装过程。Lancaster 等[10]认为自组装过程的原理在于:①同种细胞表面含有相同的黏附蛋白,易于互相黏附;②细胞分化受空间限制,由深面至浅面形成了干细胞-分化细胞-上皮细胞的层次结构[3]。这一过程较为复杂,由多种细胞因子及信号通路共同参与,但是类器官自组装过程的详细机迄今仍不清楚。
类器官模型不仅维持了细胞间的相互作用和细胞与外基质的相互作用,更能代表体内生理条件,而且含有干细胞,能够无限增殖,很好地保持了细胞异质性,适合大规模的生物医学研究,同时还可以对该模型进行基因编辑操作。本文将对类器官的类型及其在生物医学领域的应用进行综述。
1 源自不同组织和细胞的类器官模型
1.1 正常成体组织类器官
成体干细胞具有自我更新和多向分化的潜能,在组织自我更新或损伤修复的过程中,模拟出干细胞培养微环境,可以控制成体干细胞增殖分化形成类器官。研究者们发现Wnt 信号通路在上皮类型成体干细胞的调控中起主要作用[11]。Lgr5 是Wnt信号通路靶基因编码的蛋白,其与R-spondin结合可以扩大Wnt信号通路的优势。Wnt3a和R-spondin等Wnt 信号通路的激活因子是成体干细胞培养中的关键成分。
目前,研究者们已从消化系统的组织中培养出多种类器官。舌轮廓乳头含有表达Lgr5+的细胞,经培养后生长出了味蕾类器官,用钙成像技术检测发现其对味觉刺激有反应[12]。Barker 和Stange等[13-14]利用R-spondin 培养体系,分别将幽门腺Lgr5+干细胞和胃体区域表达于小鼠胚胎的肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily expressed on the mouse embryo,Troy+)Troy+主细胞培养成了胃类器官模型。小肠隐窝的底部存在Lgr5+细胞[8],也培养出了结肠类器官[9]。这2 种类器官均可传代数年,并且保持基因型和表型的稳定[15]。另外,学者们也成功培育了来自于成人肝和胰的类器官。在急性损伤后,胆囊导管和胰腺小叶形成和重建的通路被激活,在胆管和胰腺导管附近均出现Lgr5+细胞[16-17]。Huch等[16]通过对小鼠肝类器官培养体系进行条件优化,利用来源于人的胆管细胞成功获得人的胆囊类器官。该种类器官可以表达胆管细胞的标志物,在长期培养的过程中能够维持基因组的稳定性,也可以被诱导分化为具有功能的肝细胞系。随后他们又在相似的培养条件下,用人胰腺导管组织培育出具有出芽囊状结构的类器官模型。将这种类器官移植到肾被膜下,可以形成具有功能的胰腺组织[17]。除消化系统的组织外,还有学者利用人前列腺组织成功培养出前列腺类器官,经外显子测序表明,该培养体系能很好地维持遗传稳定性[18]。
由于Lgr5蛋白表达量不高,学者们也探索出了一些其他的干细胞标志物。小鼠舌类器官包含多层角化上皮,产生角质层的细胞中检测出成体干细胞志记物B细胞特异性莫洛尼鼠白血病病毒整合位点1(B cell-specific Moloney murine leukemia virus integration site 1,Bmi 1)的表达[19]。Nanduri 等[20]对腮腺CD24hi/CD29hi干细胞进行三维培养,得到了具有导管和腺叶结构的腮腺类器官。
1.2 ESC和iPSC类器官
胚胎干细胞(embryonic stem cells,ESC)是来源于胚泡内细胞团的一类细胞,具有多胚层分化能力,体外培养时能够无限增殖和多向分化[21]。诱导性多能干细胞(induced pluripotent stem cells,iPSC)与ESC 一样,也有多向分化能力;不同的是,iPSC是将体细胞重编程而形成的。重编程的主要方法有细胞融合[22]、核移植[23]或多潜能因子过表达[24]。刺激ESC和iPSC的特殊信号通路可诱导其向不同的胚层进行分化。
内胚层来源类器官包括胃[25]、甲状腺[26]、肝[27]、小肠[28]和肺[29]等。以胃类器官为例,Noguchi 等[25]利用小鼠ESC 培养出了具有成体小鼠胃窦和胃体细胞特征的类器官。通过诱导Barx1表达和同时调控音猬因子(Sonic Hedgehog,SHH)和Wnt信号通路,建立了能分泌胃蛋白酶和胃酸、具有蠕动功能的胃类器官。外胚层来源的类器官包括脑[30]、垂体[31]、内耳[32]和视网膜[33]等。2013 年,Lancaster 等[30]通过加入不同生长因子的方法将人ESC和iPSC在神经培养基三维培养出了与9~10 周胚胎大脑类似的“类大脑”,其具备人类大脑发育初期的一些主要区域,也出现了背侧皮质腹侧前脑等可辨认的特征。2015年,Kirwan等[34]应用人iPSC 体外构建了人大脑皮质神经网络,能够模拟人体内皮质网络的发育和功能,这表明可以在体外通过构建大脑类器官来进行人类前脑神经网络生理学机制的研究。
首个中胚层来源类器官是肾类器官。在人iPSCs 中调控糖原合成激酶3β(glycogen synthase kinase 3β,GSK3β)和成纤维细胞生长因子(fibroblast growth factor,FGF)信号通路,将其诱导分化至中胚层状态,然后发育为肾类器官。该类器官具有人胚胎肾单位的形态和分段,如中肾导管、肾小管和肾小球[35],这为研究人类肾起源发育与疾病提供了一个极佳的三维模型,具有重大的临床意义。
1.3 肿瘤组织类器官
肿瘤组织类器官是利用肿瘤原发灶或转移灶培养而来的体外模型[36-37]。目前,学者们已成功培养出了多种肿瘤组织类器官,包括来源于食管[38]、胃[39]、肝[40]、胰[44]、结肠[37]、乳腺[42]和子宫内膜[43]的原发肿瘤及结肠[37]、前列腺[36]和乳腺[42]恶性肿瘤的转移病灶。肿瘤类器官,是在三维培养条件下,利用含有特殊细胞因子的培养基,将分离后的肿瘤细胞培育成类球体集落,该培养产物可长期培养、传代,表现出具有与其来源肿瘤相同的基因表达谱、突变位点、肿瘤标志物、组织形态学和临床病理类型,在裸鼠移植后可成瘤,有侵袭、转移等与原肿瘤相似的临床特性。以Li 等[38]建立的食道腺癌类器官为例,细胞来源于食道腺癌患者的手术切除标本。采用三维培养系统,以基底膜提取物(basement membrane extract,BME)作为细胞外基质,加入Wnt3a、R-spondin-1、Noggin、EGF、FGF10、SB202190、A83-01、B27 和烟酰胺等因子进行培养。31例尝试建模样品中有10例成功,其中9例可传代>6个月,传代过程中没有遗传物质的改变。研究者总结建模成功率低的可能原因包括初始肿瘤细胞量少、微生物污染、成纤维细胞快速生长和生长停滞。组织学方面,该研究对类器官进行了免疫组化染色,评估了上皮特异性标记物的表达,发现泛细胞角蛋白(pan-cytokeratin)表达,无波形蛋白(vimentin)表达,表明类器官来源于上皮细胞。另外,10 例类器官中有8 例发现p53 基因的突变,还发现了PIK3CA,CDKN2A 和KCNQ3 等食管腺癌特异的突变位点,其缺失、过表达或野生型的状态均与原肿瘤一致。基因组学方面,该研究对食管腺癌类器官进行了全基因组测序,发现类器官与原始肿瘤一样为“多克隆”。各类器官之间存在基因异质性,包括不同的单核苷酸位点变异、基因插入与缺失和染色体结构变异。经检验,其基因突变与原肿瘤基本一致,证实了此类器官模型对原肿瘤基因组的稳定继承。mRNA 测序也表明食管腺癌类器官与原肿瘤有一致的基因表达谱。不过该研究未进行体内培养,如肿瘤类器官的裸鼠移植试验,未证实其体内成瘤、侵袭和转移等特性。即使如此,该研究仍具有巨大的研究意义,在肿瘤的发生发展、药物筛选及个体化治疗等方面具有广阔的研究前景。有关其他类型肿瘤类器官的特点归纳见(表1)。
2 类器官的应用
类器官不仅是研究组织及肿瘤发生发展的有效工具,还能用于药物疗效和药物毒理学性质的检测,有助于发展个体化治疗和再生医学,具有广阔的应用前景。
2.1 研究组织及肿瘤的发生发展
类器官研究可以有助于更深入了解胚胎发展和胚层分化的过程。Mondrinos等[44]利用胎肺类器官证明了外源性FGF 和VEGF-A 对于形成内皮网状结构的拮抗作用,还发现SHH通路参与诱导上皮和内皮结构的发生发展。通过调控信号通路,将胃、小肠和胰等结构从ESC 和iPSC 培育成类器官的过程,也阐明了Wnt,骨形态发生蛋白(bone morpho-genetic protein,BMP)和FGF 等信号分子在组织结构形成中的作用[28]。Kirwan 等[34]应用人iPSC 体外培育的人大脑皮质神经网络能够模拟人体内皮质网络的发育和功能,进而可以在体外来进行人类前脑神经网络生理学机制的研究。Takebe等[27]将人多能干细胞来源的肝细胞、人间充质干细胞和人内皮细胞混合后在基质胶中培养,发现3 种细胞自组装成三维的肝芽,将该肝芽移植到丙氧鸟苷诱导肝衰亡的TKNOG 小鼠体内,发现这种肝芽可以连接小鼠肠系膜血管,小鼠也出现了人类特有的药物代谢过程,重现了肝的组织发育过程。类器官具有自我更新能力,可以将有限的标本或稀有的细胞扩增,进行更详细的研究[45]。
Nadauld 等[46]利用短发夹RNA(shRNA)敲低胃癌类器官TGFBR2表达后,观察到该类器官出现了侵袭、成瘤和转移的变化,表明TGFBR2 是一种转移抑制基因。同年,该团队又在野生型小鼠结肠类器官中利用shRNA方法导入了Apc,p53,KrasG12D和Smad4基因的突变,发现该类器官呈现出了侵袭性的腺癌样的组织学结构,并具有了体内成瘤的能力,成功应用“多重打击”的办法建立了结直肠癌模型[47]。Huang 等[41]用 多 能 干 细 胞(pluripotent stem cell,PSC)培养出胰类器官后,利用慢病毒载体导入突变的Kras 和TP53 基因,新的类器官表现出了异常的导管结构和细胞核的多形性改变,与胰腺癌的特点一致。
2.2 药物疗效和个体化治疗
科学家们已经利用众多的单层(single layer)肿瘤细胞系进行了大规模的药物筛选,并发现某些基因变异对药物反应的预测作用[48]。然而,肿瘤细胞系对原肿瘤组织还原性不佳,可能是导致新药临床试验失败率较高的原因。来自患者的肿瘤类器官更好地还原了原始肿瘤的特点,相较于肿瘤细胞系,是更好的药物筛选模型。Vlachogiannis等[49]为了证实类器官能否真实预测患者的疗效,应用来源于胃肠道恶性肿瘤转移灶的肿瘤类器官,对大量临床药物进行了试验,检测了类器官的药物敏感性,并与患者的治疗效果进行了比较。结果显示,阳性预测(预测药物有效)率为88%,阴性预测(预测药物无效)率高达100%。此结果表明,患者来源的类器官模型能够重现患者对药物的反应,可以被用于个体化药物治疗[49]。目前利用类器官生物库进行小范围药物筛选的工作已经逐渐展开,并得到了满意的结果[36,42]。
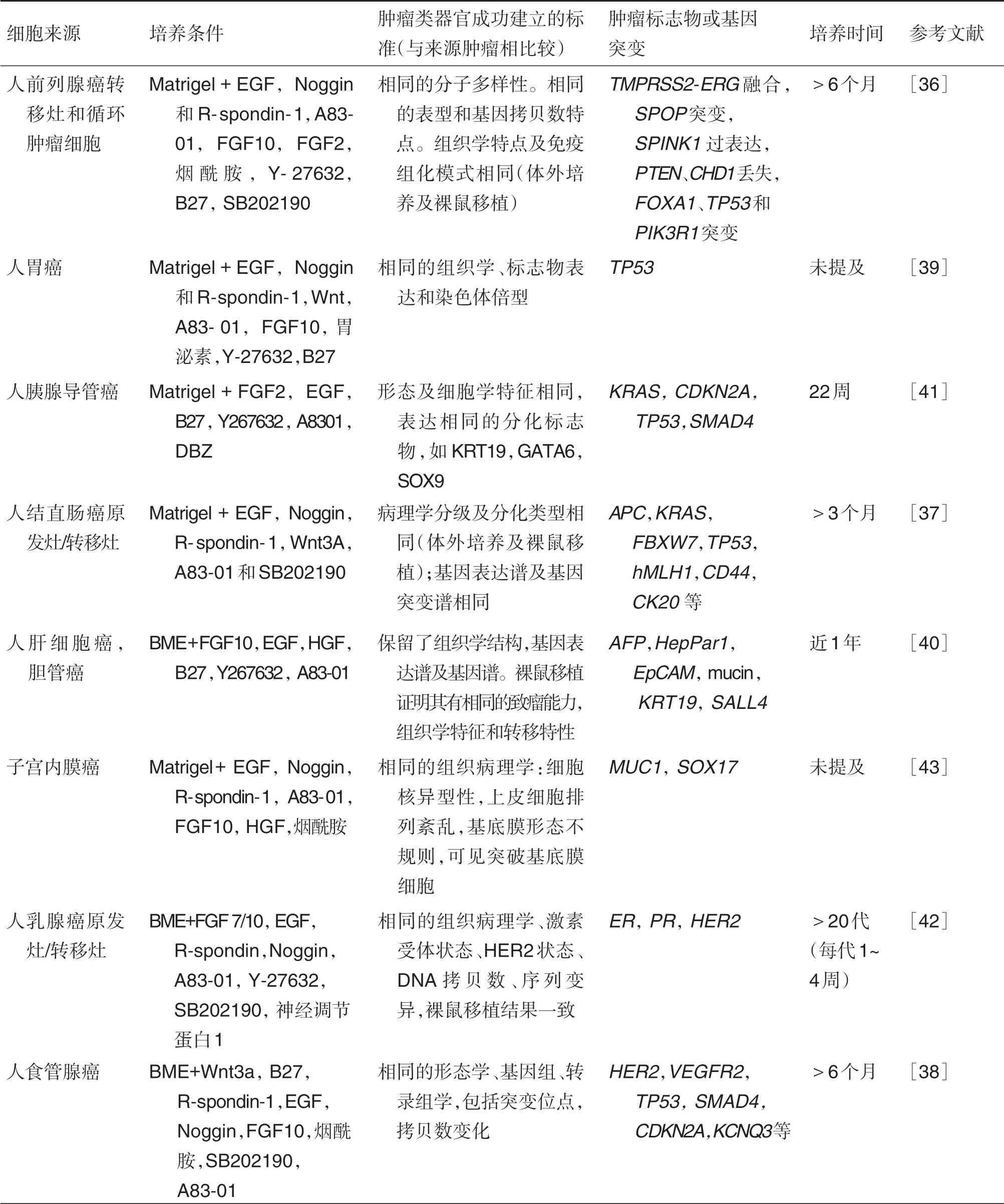
表1 肿瘤类器官研究现状
Verissimo 等[50]应用结直肠癌类器官生物库检测RAS 通路抑制剂的疗效,发现对于RAS 突变的结直肠癌类器官,联合应用以MEK 或HER 家族和ERK为靶向的药物,能够显著抑制肿瘤生长,但是仅能使肿瘤生长停滞而不是发生凋亡,一旦治疗停止,细胞会继续生长。这一工作表明RAS突变结直肠癌的治疗,需要联合应用EGFR通路抑制剂的治疗策略。
Broutier等[40]用人原发性肝癌类器官进行药物筛选,发现了ERK抑制剂对于原发性肝癌的明确疗效。Shenoy等[51]比较了染色质域解螺旋酶DNA结合蛋白1(chromodomain helicase DNA-binding protein 1,CHD1)缺乏和野生型的去势抗性前列腺癌患者来源的类器官,发现CHD1 缺乏型前列腺癌类器官对DNA 损伤剂敏感,用DNA 损伤剂卡铂治疗后疗效显著。
类器官技术对于药物发展的另一项贡献是药物毒性检测。药物的毒性作用常损伤肝、肾和心等器官的功能。Takasato 等[35]利用人肾类器官验证顺铂的肾毒性,表明类器官模型在药物毒性筛选中的重要作用。药物性肝衰竭是药物在临床试验中失败的主要原因[52],药物性肝毒性常由细胞色素P450 酶介导所致。肝类器官经诱导分化后可表达这些酶,浓度接近生理水平[53],可用于药物肝毒性的检测。此外,来源于iPSC 的心脏类器官可用于药物心脏毒性的检测[54]。
2.3 再生医学
单个成人Lgr5+干细胞能在体外成功扩增成结肠类器官,将这种功能性的结肠上皮移植到硫酸葡聚糖诱导的急性结肠炎小鼠模型中可以修复其受损的结肠上皮,提示利用单一成人结肠干细胞体外扩增进行结肠干细胞治疗是可行途径[55]。Sugimoto等[56]将人结肠类器官原位移植至小鼠结肠黏膜下层,观察其在小鼠体内生长。发现移植物能够形成与小鼠结肠隐窝不同的隐窝结构,其中的Lgr5+干细胞也有自我更新和多向分化的表现,表明结肠类器官移植后具有相应的功能。Nakamura等[57]提出体外利用管状支架将肠类器官培育成管型结构,诱导分化后吻合至体内肠道缺损部位。这些方法理论上可行,但是尚需临床试验结果支持。
Huch 等[53]用肝干细胞体外培养出肝类器官,将其移植至急性肝损伤的小鼠模型,发现小鼠体内表达了人白蛋白。Nantasanti等[58]利用犬肝干细胞构建了可分化为功能性肝细胞的肝类器官模型,体内移植后可用于铜贮积病的治疗。可见,无论是直接应用,还是体外培养快速获得移植物,类器官在再生医学领域均可发挥巨大作用。
3 展望
近年来,研究者们为了建立更好的药物筛选平台,建立了基于微流控技术的器官芯片(organ-on-achip)。这是一种模仿完整器官结构和功能的单元芯片,置入微量的化学物质或微生物,可以模拟出相同物质放到真实人体器官中时发生的变化[59]。该系统跟动物模型相比更贴近人体真实反应,然而,仍存在些许瑕疵,如缺少支持细胞和基质,缺少干细胞的自我组装能力等。类器官芯片(organoid-on-achip)有望弥补这些缺陷。两者区别主要在于,器官芯片的制备需要将各种类型的细胞进行人为排列,而类器官芯片有自动分化、组装为功能单位的能力,比前者更能模拟器官的功能单元。有学者提出多类器官芯片的应用,同一个芯片上含有肝、心和肺3 个类器官,可在检测药物对于目的器官疗效的同时,监测系统整体的变化[60]。
类器官可长期培养传代,基因型稳定,而且可以冻存,复苏后可继续稳定培养,这就为生物器官库的建立提供了可能。通过扩建类器官生物库,我们可以获得各种类型的类器官模型和肿瘤模型,在对其进行基因组测序和表达谱分析后,不仅可以进行个体层面上的指导,如疾病易感性、药效预测和再生医学等,还能为大规模实验研究提供足够的数据支持。
类器官作为一个新的研究模型,有很多的优点,但是仍然存在不足。类器官培养的一个重要的内在限制是缺少间充质结构、血管和免疫细胞,因而应该在类器官培养的基础上,对共培养体系进行探索。Workman 等[61]将小肠类器官与来源于人PSC的神经嵴细胞进行共培养,发现在小肠结构中出现了功能性神经细胞的分布,表明共培养系统的可能性。还有学者将外周血淋巴细胞与肿瘤类器官共培养,获得了具有肿瘤杀伤性的T细胞,可用于免疫治疗[62]。
类器官培养的外在不足在于细胞外基质的代替物,如基质胶、基底膜提取物或胎牛血清中含有一些不确定的成分,可能影响药物实验结果。有研究表明,加入血清不利于人胰类器官的长期生长[63]。Gjorevski 等[64]报道了一种合成基质可代替鼠源性细胞外基质代替物,进行小肠类器官的培养。然而,这种合成基质尚需改进,以提高生产效率并适用于其他类器官。还有学者发明了水溶的WNT 拮抗药物,可用于多种类器官的培养[65],成为了WNT条件培养基的无血清替代物。
迄今为止,几乎所有肿瘤类器官都是上皮来源的。仅有一篇文献用原发性成胶质细胞瘤培养类器官[66],属于非上皮来源肿瘤。目前的类器官培养方法能否用于其他非上皮来源的肿瘤尚待探索。
尽管类器官有上述不足,仍然是非常先进的体外培养模型。类器官高效培养使其可以在临床治疗时间窗内进行个体化药物筛选,进而应用于转化医学和个体化治疗。相信随着类器官相关研究的深入和革新,类器官培养会在科学研究中扮演越来越重要的角色。
