α2B-肾上腺素能受体与增强型绿色荧光蛋白标记的活化T细胞核因子2共表达稳转细胞株的构建
2019-06-18李玉蕾周培岚苏瑞斌傅风华
王 震,李玉蕾,周培岚,苏瑞斌,傅风华
(1.烟台大学药学院,山东烟台 264005;2.军事科学院军事医学研究院毒物药物研究所,北京 100850;3.抗毒药物与毒理学国家重点实验室,北京 100850)
α2-肾上腺素能受体(alpha 2-adrenergic receptor,α2-AR)主要分布于突触前膜,通过负反馈调节突触前肾上腺素的释放。α2-AR有3个亚型α2A-AR,α2B-AR和α2C-AR[1],其中α2B-AR 主要分布于外周,如血管平滑肌和肾等,在中脑和丘脑也有少量分布,在血压调控中具有重要作用[2-4]。研究发现,α2-AR通常与Gi/Go型G 蛋白偶联[5-6],受体激活以后可以抑制腺苷酸环化酶(adenylate cyclase,AC)-cAMP-蛋白激酶A(protein kinase A,PKA)信号通路,进而发挥其生理作用[4,7-8]。但也有文献报道,α2-AR 激活以后可以通过不依赖于AC的分子通路提高细胞内Ca2+水平[9]。由于目前尚无靶向α2-AR的亚型选择性激动剂,并且α2-AR 亚型选择性拮抗剂特异性较差,在本实验室前期完成共表达增强型绿色荧光蛋白(enhanced green fluorescent protein,EGFP)标记的PKA催化亚基与α2A-AR 的CHO细胞株(CHOPKAcat-EGFP-α2A-AR 细胞)[10]的构建后,亟需构建一种表达α2B-AR的细胞模型,用于靶向α2-AR的激动剂或者拮抗剂的快速筛选,为新药研发和α2-AR后分子机制的研究提供支持。α2-AR 激活后,细胞内Ca2+浓度升高,胞内Ca2+浓度增高可以激活钙调蛋白(calmodulin,CaM),从而激活活化T细胞核因子(nucleus factor of activated T cells,NFAT)信号通路,使NFATc1(即NFAT2)从细胞质迁移到细胞核,发生核转位[11-13]。以融合表达EGFP和NFAT2的U2OS 细胞(U2OS-EGFP-NFAT2)为工具细胞[14],设计和构建稳定表达α2B-AR 和EGFP-NFAT2的细胞株(U2OS-EGFP-NFAT2-α2B-AR),并选用α2-AR 激动剂盐酸右美托咪啶(dexmedetomidine hydrochloride,DMED)以及拮抗剂盐酸阿替美唑(atipamezole hydrochloride,ATI)作用于细胞,结合NFATc1核转位实验进行受体功能活性的确证。
1 材料与方法
1.1 细胞、试剂、药物和仪器
U2OS-EGFP-NFAT2 细胞由军事科学院军事医学研究院毒物药物研究所王莉莉研究员惠赠;pCMV-SPORT6-α2B-AR 购自北京西美杰科技有限公司,重组质粒构建以及实时定量PCR所需引物由北京奥科鼎盛生物科技有限公司合成;具有潮霉素B(hygromycin B,Hygro)抗性的PCDNA3.1 质粒(pcDNA3.1-Hygro)由军事科学院军事医学研究院放射与辐射医学研究所从玉文研究员惠赠;Hind Ⅲ、XhoⅠ限制性内切酶、Taq DNA聚合酶、T4 DNA连接酶、RNA 酶抑制剂、M-MLV 逆转录酶、2×Power SYBR Green PCR Master Mix、胎牛血清(fetal bovine serum,FBS)、Hygro、Lipofectamine 2000、Hoechst33342核染色剂、DMEM基础培养基、蛋白梯度指示剂和PBS缓冲液(pH 7.4)购自美国Thermo Fisher Scientific 公司;琼脂糖凝胶DNA 回收试剂盒、质粒提取试剂盒、DH5α感受态细胞、dNTP混合物、Trizol RNA 提取液和Oligo dT18、D2000 DNA梯度指示剂购自北京天根生物技术公司;琼脂粉购自上海Baygene生物科技有限公司;无内毒素质粒提取试剂盒由美国Omega 公司购买;96 孔黑色透底检测板购自美国Corning 公司;甲醛、无水乙醇、异丙醇、氨苄青霉素冻干粉和甲醇购自国药集团化学试剂有限公司;兔抗人α2B-AR 单克隆抗体(EPR9623)购自艾博抗(上海)贸易有限公司;小鼠抗人β 肌动蛋白单克隆抗体,辣根过氧化物酶(HRP)标记的山羊抗兔多克隆抗体和HRP 标记的山羊抗小鼠多克隆IgG二抗购自北京普利莱基因技术公司。
蛋白酶抑制剂cocktail、RIPA 细胞裂解液、5×蛋白上样缓冲液、30%丙烯酰胺溶液、Tris(pH 8.8)1.5 mmol·L-1缓冲液、10%SDS、过硫酸铵、TEMED、Tris(pH 6.8)1.0 mmol·L-1缓冲液、10×TBST 缓冲液、10×PAGE 电泳缓冲液和蛋白印迹膜再生液Stripping 缓冲液购自北京博迈德基因技术有限公司;PVDF膜和化学发光的HRP 底物显影液购自美国Millipore 公司;脱脂奶粉购自美国BD 公司;DMED 购自济南德信佳生物科技有限公司;ATI S160801 由浙江海正药业股份有限公司合成。Centrifuge 5424 R冷冻离心机购自德国Eppendorf公司;7300 Real Time PCR system 和电泳槽购自美国Applied Bionsystem 公司;Envision 2104 多功能酶标仪购自美国Perkin Elmer公司;PCR仪购自北京东胜创新生物科技有限公司;水浴锅购自北京长安科学仪器厂;GEL LOGIC 1500 成像系统购自美国KODAK 公司;DYY-8C 型电泳仪购自北京市六一仪器厂;CELL INSIGHT CX5高内涵筛选平台购自美国Thermo Scientific公司。
1.2 pcDNA3.1-Hygro-α2B-AR重组质粒的构建
以人源α2B-AR 基因CDS 序列为模板,设计含有Hind Ⅲ限制性内切酶酶切位点的正向引物:CCCAAGCTTATGGACCACCAGG 以及含有XhoⅠ限制性内切酶酶切位点的反向引物CCGCTCGAGATCACCAGGCCGT,通过PCR 法合成目的基因。反应体系如下:10×PCR缓冲液5 μL,正向引物(20 μmol·L-1)2.0 μL,反向引物(20 μmol·L-1)2.0 μL,dNTP 混合物(2 mmol·L-1)2.0 μL,Taq DNA 聚合酶2.0 μL,pCMV-SPORT6-α2B-AR(50 mg·L-1)1 μL,H2O 36 μL;反应过程如下:①94℃2 min,②94℃30 s,③65℃,30 s,④72℃60 s,⑤72℃10 min,其中过程②~④循环30 次。把PCR产物经琼脂糖凝胶电泳分离后分离得到目的基因(1353 bp),用DNA 凝胶回收试剂盒将目的基因回收后,与pcDNA3.1-Hygro 质粒分别经Hind Ⅲ与XhoⅠ限制性内切酶双酶切;酶切产物于16℃连接18~24 h,将连接产物转化到DH5α 感受态,接种到具有氨苄青霉素抗性的LB固体培养基,37℃培养24 h后,挑取若干细胞单克隆,在扩大培养以后提取重组质粒;经Hind Ⅲ与XhoⅠ限制性内切酶双酶切后,进行琼脂糖凝胶电泳pcDNA3.1-Hygro-α2B-AR,挑选具有目的基因条带的菌落,扩大培养并提取质粒,进行目的基因的测序比对。
1.3 U2OS-EGFP-NFATc1-α2B-AR 稳转细胞株的构建
使用无内毒素质粒提取试剂盒提取pcDNA3.1-Hygro-α2B-AR 重组质粒,按Lipofectamine 2000说明书转染方案转染至U2OS-EGFP-NFATc1 细胞;24 h后换液,随后用DMEM培养基(含10%FBS和Hygro 200 mg·L-1)进行抗生素压力筛选;10 d后采用有限稀释法挑取单克隆细胞并接种到96孔板,待细胞密度达到80%时,使用100 μL DMEM 培养基清洗细胞1次,空白对照组每孔加入200 μL DMEM基础培养基,实验组先后各加入150 μL的基础培养基和含有50 μL DMED 的培养基,使DMED终浓度达到1.0×10-7mol·L-1;37℃孵育30 min,每孔加入12%甲醛100 μL,室温固定20 min,使用PBS 缓冲液(pH 7.4)200 μL 冲洗细胞2 次,每孔加入100 μL用PBS 缓冲液配制的Hoechst33342 核染色剂1 μmol·L-1,室温下避光反应30 min,采用Thermo Scientific 公司的CELL INSIGHT CX5 高内涵筛选平台获取细胞荧光图像并分析,以单位细胞细胞核荧光颗粒荧光强度与单位细胞细胞质荧光颗粒荧光强度之比作为核转位指数,则相对核转位指数=实验组核转位指数-空白对照组核转位指数;筛选核转位指数最大的细胞株。
Z’因子法结合核转位实验评价所选细胞模型的可靠性,计算公式为Z’=1-(3σc++3σc-)/|μc+-μc-|,σ:标准差,μ:平均值,c+:阳性对照组(使用1×10-7mol·L-1DMED处理);c-:阴性对照组(溶剂处理组)。Z’因子在0.5~1时,表明细胞株功能比较稳定。
1.4 实时定量PCR(qRT-PCR)法检测α2B-AR mRNA转录水平
将U2OS-EGFP-NFAT2 细胞和U2OS-EGFPNFAT2-α2B-AR 细胞分别接种到6 孔板,采用Trizol法提取细胞的总RNA,采用紫外分光光度法测定总RNA 的浓度。以RNA 为模板,进行逆转录实验,20 μL 的反应体系如下:总RNA 1.0 μg,5×逆转录酶缓冲液4.0 μL,dNTP 混合物(10 mmol·L-1)2.0 μL,RNA 酶抑制剂(20 U·μL-1)0.5 μL,Oligo dT18 引物(50 mmol·L-1)1.0 μL,M-MLV 逆转录酶(200 U·μL-1):1.0 μL,其余体积用DEPC 处理水补足。反应条件如下:42℃1 h,70℃5 min。设计qRT-PCR 反应引物如下:α2B-AR 的正向引物:AGGTCAACGGACACTCGAAG,反向引物:CGGGTCCCAGTATCTTCAGG;GAPDH 的正向引物:AGGTCATCCCAGAGCTGAACG,反向引物:TCAGATGCCTGCTTCACCAC。以α2B-AR为目的基因,GAPDH为内参基因,检测α2B-AR mRNA相对含量。反应体系如下:2×Power SYBR Green PCR Master Mix 5.0 μL,cDNA 0.6 μL,正向引物(10 μmol·L-1)0.2 μL,反向引物(10 μmol·L-1)0.2 μL,DEPC处理水4.0 μL。反应过程如下:①95℃2 min,②95℃15 s,③62℃10 s,④70℃30 s,⑤72℃5 min,其中过程①进行1 个循环,过程②~④进行40 个循环,过程⑤进行1 个循环。以公式2-△△Ct计算mRNA的相对表达水平[15]。
1.5 Western蛋白印迹法检测α2B-AR蛋白的表达
U2OS-EGFP-NFAT2 细胞和U2OS-EGFPNFAT2-α2B-AR 细胞分别传至20 mm 培养皿,待生长约至90%,使用含有蛋白酶抑制(1×cocktail)的RIPA细胞裂解液在4℃收取全蛋白,在旋转摇床上裂解细胞30 min;4℃,13 000×g离心15 min,吸取上清液;采用BCA 法测定蛋白提取液的总蛋白浓度;加入相应体积的上样缓冲液后,于沸水中加热变性5 min。
配制10%的分离胶5 mL,体系如下:1.9 mL水,1.7 mL 30%丙烯酰胺溶液,1.3 mL Tris(pH8.8)1.5 mmol·L-1,50 μL 10%SDS,50 μL 10%过硫酸铵,20 μL TEMED。快速地将分离胶溶液灌注到玻璃板间,并在溶液上层覆盖1 mL的水。待凝胶聚合后,弃残留水,加入1 mL 5%积层胶(积层胶体系如下:680 μL水,170 μL 30%丙烯酰胺混合液,130 μL Tris(pH 6.8)1.0 mmol·L-1,10 μL 10%SDS,10 μL 10%过硫酸铵,1 μL TEMED),并插入10孔梳,待积层胶完全聚合后,即可进行SDS-PAGE凝胶电泳实验。配置SDS-PAGE凝胶电泳缓冲液,进行电泳实验,上样量为20 μL,含10 μg总蛋白,分组为:U2OSEGFP- NFAT2- α2B- AR 细 胞 组、U2OS- EGFPNFAT2细胞组和蛋白梯度指示剂组,电泳条件:80 V,20 min,110 V,1.5 h。取下凝胶,裁剪适当大小的PVDF膜和滤纸,在浸入电转液的条件下,将凝胶覆盖于两层滤纸上,将PVBF膜放在胶面上,并再次覆盖两层滤纸,滤纸两面用海绵夹住,形成“三明治”结构,关上转移盒置转移液槽中,加入适量转移液并放入冰袋,在冰浴的条件下进行转膜实验,在160 mA电流条件下,转膜1.5 h。
电转结束后,取下PVDF 膜,常温下在5%脱脂奶粉中封闭1 h。TBST清洗PVDF膜,常温下使用α2B-AR 单克隆抗体(1∶10 000)孵育5 h。清洗PVDF膜,使用HRP标记的山羊抗兔多克隆抗体(1∶3000)溶液常温下孵育2 h。清洗PVDF膜,配置适量显影液,于暗处滴加到PVBF膜上,使PVDF膜完全浸润。立即转移至显影仪显影。取已经显影的PVBF 膜,清洗过后,加入膜再生液,室温孵育30 min,清洗掉膜再生液,先后使用β肌动蛋白抗体(1∶3000)和相应HRP标记的山羊抗小鼠多克隆抗体(1∶3000)各孵育孵2 h,并显影。以目标蛋白与内参蛋白的积分吸光度值比值表示蛋白的相对表达水平。
1.6 U2OS-EGFP-NFAT2-α2B-AR 细胞受体活性评价
将U2OS-EGFP-NFAT2-α2B-AR 接种到96 孔板,待细胞密度达到80%时,选用非选择性α2-AR激动剂DMED及α2-AR拮抗剂ATI进行核转位实验评价U2OS-EGFP-NFAT2-α2B-AR 细胞受体活性。实验分组及加样方式如下:空白对照组,每孔加入200 μL DMEM基础培养基;DMED处理组,每孔加入50 μL 不同浓度的DMED(终浓度分别为:5.6×10-12,1.7×10-11,5.1×10-11,1.5×10-10,4.6×10-10,1.4×10-9,4.1×10-9,1.2×10-8,3.7×10-8,1.0×10-7,3.3×10-7,1.0×10-6mol·L-1);ATI处理组,每孔加入50 μL的DMED(终浓度为:1×10-7mol·L-1)和50 μL不同浓度的ATI(终浓度分别为:5.1×10-10,1.5×10-9,4.6×10-9,1.4×10-8,4.1×10-8,1.2×10-7,3.7×10-7,1.1×10-6,3.3×10-6,1.0×10-5mol·L-1),加入DMEM 基础培养基补足反应体系至200 μL。后续操作同1.3,计算相对核转位指数,绘制DMED 和ATI的量效曲线。
1.7 统计学分析
2 结果
2.1 构建的pcDNA3.1-Hygro-α2B-AR重组质粒
PCR 产物的琼脂糖凝胶电泳实验表明,在1000~2000 bp 之间有一条明显的条带(图1A),大小与目的基因(1353 bp)相吻合;PCR 产物胶回收后,用Hind Ⅲ与XhoⅠ限制性内切酶双酶切,与同样双酶切的pcDNA3.1-Hygro 质粒进行连接并转化DH5α感受态,从接种的单克隆菌株提取重组质粒,进行双酶切验证,酶切产物在约1300 bp 及>2000 bp 处均呈现较亮条带(图1B),分别为目的基因及载体条带。对重组质粒测序,目的基因序列与α2B-AR基因(Gene ID:151)的CDS区序列一致,表明α2B-AR基因的重组质粒构建成功。
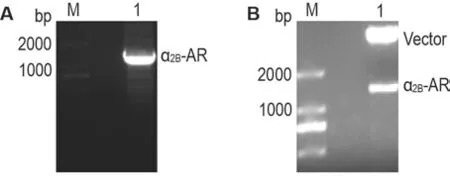
Fig.1 Verification of α2B-adrenoceptor(α2B-AR) by agarose gel electrophoresis.A:PCR product of α2B-adrenoceptor;B:recombinant plasmid pcDNA3.1-hygromycin B(Hygro)-α2B-AR digested by HindⅢand XhoⅠ. M:marker;Lane 1 was PCR product of α2B-AR(A)or pcDNA3.1-Hygro-α2B-AR digested by Hind Ⅲand XhoⅠ(B).
2.2 构建的U2OS-EGFP-NFAT2-α2B-AR 稳转细胞株
采用有限稀释法培养经Hygro 200 mg·L-1筛选的转染细胞,共得到13 株单克隆细胞U2OSEGFP-NFAT2-α2B-AR。采用核转位实验筛选阳性细胞株,发现编号12的细胞株生长状态良好并具有最高的活性,核转位指数为0.445(图2)。在不同传代次数的3 次平行实验中,Z’因子分别为0.664,0.533和0.634,均在0.5~1之间,表明编号12细胞株功能稳定,下一步对该细胞株进行mRNA和蛋白水平的验证。
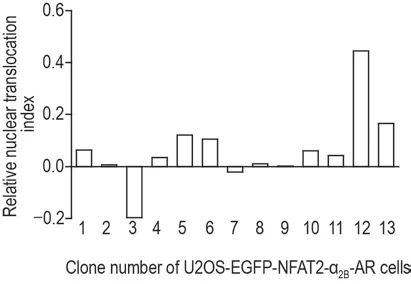
Fig.2 Screening of U2OS cells expressing enhanced green flourescent protein labeled nucleus factor of activated T cells 2(EGFP-NFAT2)and α2B-AR(U2OSEGFP-NFAT2-α2B-AR)cells by nucleus translocation assay.
2.3 U2OS-EGFP-NFAT2-α2B-AR 稳转细胞α2B-AR mRNA转录水平
U2OS-EGFP-NFAT2-α2B-AR 细 胞 表 达 的α2B-AR mRNA 在第5,10,15 和20 代的水平与第1代相当,且为对照细胞U2OS-EGFP-NFAT2的百倍以上(P<0.01)(图3),表明α2B-AR mRNA在持续的传代过程中稳定表达。
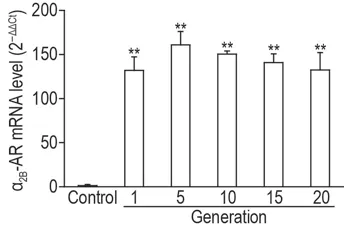
Fig.3 Transcriptional levels ofα2B-AR in mRNA U2OSEGFP-NFAT2-α2B-AR cells.s,n=4. **P<0.01,compared with U2OS-EGFP-NFAT2 cells(control)by t test.
2.4 U2OS-EGFP-NFAT2-α2B-AR稳转细胞α2B-AR蛋白表达水平
Western 蛋白印迹结果显示,在分子质量约45 ku 处,U2OS-EGFP-NFAT2-α2B-AR 细胞(α2B组)中可检测到明显的目的条带,而在U2OSEGFP-NFAT2 细胞(对照组)中未检测此条带(图4),说明U2OS-EGFP-NFAT2 细胞无α2B-AR 蛋白表达,并且U2OS-EGFP-NFAT2-α2B-AR 细胞株的α2B-AR蛋白在多次传代后稳定表达。

Fig.4 Expression of α2B-AR protein in U2OS-EGFPNFAT2-α2B-AR cells(α2B)and U2OS-EGFP-NFAT2 cells(control)by Western blotting.
2.5 U2OS-EGFP-NFAT2-α2B-AR细胞受体活性
NFAT2核转位实验检测U2OS-EGFP-NFAT2-α2B-AR细胞受体活性。空白对照组细胞的相对核转位指数为0,EGFP-NFAT2 绿色荧光蛋白在细胞质中呈弥散性分布,胞核内无荧光颗粒聚集;DMED 1.4×10-9mol·L-1处理后,细胞的相对核转位指数增加到0.138,即可以观察到EGFP-NFAT2绿色荧光颗粒聚集,但颗粒聚集程度不明显;DMED 1.0×10-7mol·L-1处理后,细胞的相对核转位指数增加到0.276,细胞核中可以观察到明显的EGFP-NFAT2绿色荧光颗粒聚集,同时细胞质的绿色荧光强度明显降低;ATI 1.0×10-5mol·L-1处理后(与1.0×10-7mol·L-1DMED共孵育),EGFP-NFAT2绿色荧光蛋白在细胞质中呈弥散分布,核内无荧光颗粒聚集,DMED(1.0×10-7mol·L-1)对EGFPNFAT2 核转位的促进作用被完全拮抗(图5A)。DMED在5.6×10-12~1.0×10-6mol·L-1浓度范围内,可以浓度依赖性地增强EGFP-NFAT2的核转位,其半数有效浓度(EC50)为(2.616±0.121)nmol·L-1,DMED 的浓度达到3.7×10-8mol·L-1时,即达到最大效应,此时相对核转位指数约为0.445(图5B)。
ATI在5.1×10-10~1.0×10-5mol·L-1浓度范围内,可以浓度依赖性地拮抗DMED的作用,半数抑制浓度(IC50)为(89.05±0.22)nmol·L-1(图5C);在ATI浓度达到3.7×10-7mol·L-1时,即可完全拮抗DMED的作用,此时相对核转位指数约为0(图5C)。U2OS-EGFP-NFAT2-α2B-AR 细胞的编号12 号的细胞株受体活性良好,稳转细胞株构建成功。
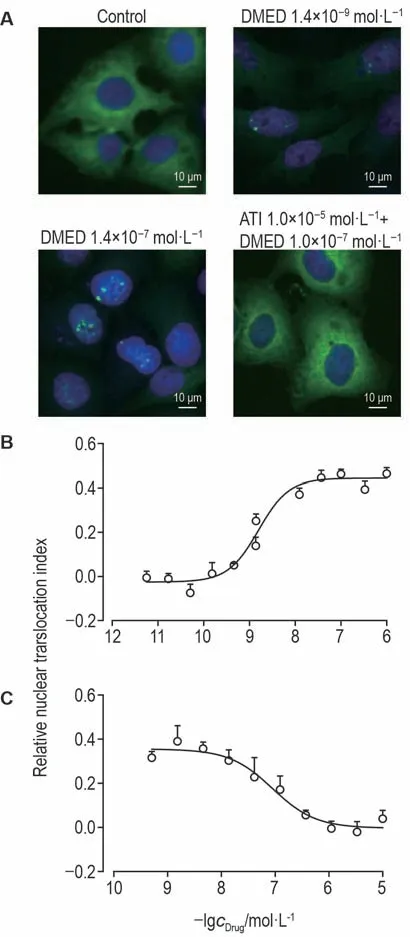
Fig.5 Receptor activity of U2OS-EGFP-NFAT2-α2B-AR cells evaluated by nucleus translocation assay. A:fluorescent images. Arrows show NFAT2 translocated to nucleus. B and C:concentration-response curve of DMED(B)and ATI(C)in U2OS-EGFP-NFAT2-α2B-AR cells,respectively.,n=3.
3 讨论
本研究以NTAT2的核转位原理为基础,成功构建了可用于高内涵筛选靶向α2B-AR 化合物的细胞模型。α2B-AR 激活以后,可以通过NFAT 信号通路使NFAT2 发生明显的核转位,通过核转指数的变化,可以浓度依赖性地检测化合物对α2B-AR的激活或者拮抗作用。
α2-AR 属于G 蛋白偶联受体,受体激活后可以升高人红白血病细胞胞浆内的Ca2+浓度[9],胞内钙浓度的升高可能由G蛋白激活的磷脂酶C介导的,或者与G 蛋白偶联的胞膜或者线粒体上的钙通道的激活有关。本课题组研究发现,以本课题组构建的α2A-AR稳转细胞株为工具细胞,α2A-AR激活后胞内Ca2+浓度的升高是由G 蛋白激活后βγ 亚基介导的磷脂酶C 激活引起的,并且Gαi亚基与Gβγ亚基具有相反的作用[16],但是尚无研究明确α2B-AR激活后胞内Ca2+浓度升高的机制及其相关的分子信号通路。本文构建的α2B-AR稳转细胞株,结合高内涵分析方法,提供了一种简易快速地研究α2B-AR下游信号通路分子机制的新途径,并可与课题组基于PKA重分布实验构建的α2A-AR和α2C-AR细胞株一起,共同用于靶向α2-AR化合物的筛选。
DMED 是一种α2-AR 激动剂,对α2-AR 的3 种亚型无明显选择性,临床上用于患者机械插管时的辅助镇静。临床使用不当时(如给药速度过快,或者过量应用),可能会产生心动过缓、心律失常和血压降低等副作用。鉴于α2B-AR 在外周的广泛分布及与血压调节的密切关系,推测这有可能与DMED对α2B-AR的激活有关。有研究发现,DMED的镇静作用主要由α2A-AR所介导[17],推测DMED的毒副作用也可能是由特定亚型的α2-AR的所介导。以本文所建立的细胞模型为工具细胞,有助于DMED激活α2-AR后细胞内信号通路转导的研究,并为从受体水平阐释DMED的药效学和毒理学机制提供支持,还可应用于靶向性好、毒性低的新药研发。
