禽流感病毒HA蛋白的原核表达与鉴定
2019-06-14李令臣侯力嘉吴胜昔李俊萱鲁友铭梁望旺
李令臣,侯力嘉,吴胜昔,李俊萱,鲁友铭,徐 缘,李 志,曾 政,梁望旺
(1.重庆理工大学 药学与生物工程学院, 重庆 400054; 2.重庆市动物疫病预防控制中心, 重庆 401120)
禽流感,是由A型流感病毒引起的从呼吸系统病变到全身性败血症的一种高度接触性急性传染病[1-3]。据世卫组织称,自2003年以来,全球已报告860例人感染H5N1型流感病毒病例,意味着该病毒具有感染人类的潜力。在不断研究中,发现此类病毒可能对家禽工业和人类公共卫生构成潜在威胁,因此对病毒进行持续监测和鉴定对于预防任何可能的疾病暴发至关重要。
高致病性禽流感(HPAI)是由正黏病毒科A型流感病毒属的H5亚型或H7亚型禽流感病毒(AIV)引起的[6],其基因组由8个分节段的单股负链RNA组成,共编码11种蛋白[7]。血凝素蛋白(hemagglutinin,HA)是作为目前存在于甲型流感病毒(IAV)包膜上的最主要表面糖蛋白,许多研究都致力于了解HA的结构及其抗原性[8-9]。本研究拟在不改变HA蛋白氨基酸序列的情况下,根据大肠杆菌密码子偏好性优化基因序列,化学合成HA全基因,将其克隆至原核表达载体pET28a(+)中,构建pET28a(+)-HA重组质粒,并转化BL21大肠杆菌进行诱导表达,以期建立低廉、快速、高效的HA重组蛋白原核表达系统,为后续疫苗及诊断方法的研究奠定基础。
1 材料与方法
1.1 菌株和质粒
实验所用大肠杆菌BL21(DE3)、感受态DH5α菌株购自北京鼎国昌盛生物有限公司;所用pET28a(+)质粒由重庆理工大学基因工程实验室惠赠。
1.2 主要试剂
DNA Marker、QuickCut BamHI、QuickCut EcoRI限制性内切酶,购自TaKaRa;小型质粒提取试剂盒、小量胶回收试剂盒,购自重庆威斯腾生物科技有限公司;SDS-PAGE凝胶配制试剂盒、蛋白质分子质量标准,购自北京鼎国昌盛生物有限公司。
1.3 序列分析与合成
根据从NCBI的基因数据库GenBank中査取的禽流感 HA(ID=DQ023145.1)的基因组序列,利用DNAWorks2.4软件进行密码子优化设计。Primer Premier 5.0软件设计1对特异性引物,通过设计在序列上游引物P1中引入EcoRI (碱基序列为GAATTC)限制性酶切位点,在序列下游引物P2中引入BamHI (碱基序列为GGATTC)限制性酶切位点,此引物交由上海生工生物工程有限公司合成。引物P1、P2序列如下:
P1:
5′-GACGAATTCACCAATGTGCCGGAATGG-3′
(含EcoRI 酶切位点);
P2:
5′-GGGGGATTCACCATCCTAATGATGCGG-3′
(含BamHI酶切位点)。
1.4 pET28a(+)-HA重组载体的构建
将含有禽流感HA 基因的TOP10甘油菌在无菌条件下划线培养后,挑菌入小试管再培养。得到大量菌体后,离心并用DNA小量提取试剂盒提取含有HA基因的质粒。将所得质粒用BamHI和EcoRI进行双酶切鉴定。利用琼脂糖凝胶电泳得到有效切割的HA基因片段。鉴定正确的HA质粒转化入表达宿主[BL21(DE3)]中,将其大量扩增,留取部分做菌株保存。
1.5 重组蛋白的诱导表达及纯化
将鉴定成功的菌株大量扩增,使菌浓度OD600 nm值在0.6~0.8之间时,加入诱导剂IPTG。进行诱导温度(20、25、30、37 ℃)、IPTG浓度(0.1 mmol/L、0.5 mmol/L、1 mmol/L)、诱导时间(8、10、12、16 h)的筛选。取出0.5 mL 菌液,10 000 r/min 离心 5 min,弃上清,沉淀重悬于 40 μL 1×PBS,并加入10 μL 5×SDS-PAGE 凝胶电泳上样缓冲液,100 ℃变性 10 min进行 SDS-PAGE电泳。按优化后的最佳条件重新诱导表达,采用蛋白纯化仪的Ni柱蛋白纯化得到重组HA蛋白,利用电泳鉴定。
1.6 蛋白质印记(Western blot)分析
经过镍柱纯化后得到的HA重组蛋白要经过Western免疫印迹鉴定分析,具体步骤参见文献[8]。
2 结果与分析
2.1 重组质粒pET28a(+)-HA酶切鉴定
重组质粒pET28a(+)-HA经BamHI和EcoRI双酶切后电泳,分别切出与对应目的基因大小相符的条带(1 740 bp)以及与空载体pET28a(+)大小相符约5 369 bp的另一条带(见图1)。这表明已成功构建重组表达载体。
2.2 重组蛋白的诱导表达
将pET28a(+)-HA经IPTG诱导破菌,分别取适量的沉淀(灭菌水溶解)和上清进行SDS-PAGE检测。结果表明:当诱导条件为30 ℃、IPTG 1 mmol/L诱导8 h时,蛋白表达最高,在70 kD处有一条明显的蛋白条带(见图2),与预期大小相一致,说明pET28a(+)-HA成功表达。且重组菌在上清和沉淀中显示70 kD的条带,上清表达明显高于沉淀(见图3、4)。
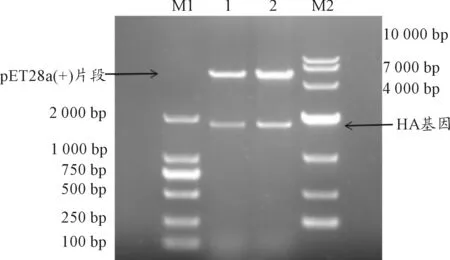
M1、M2:DNA分子质量标准;1、2:pET28a(+)-HA的双酶切产物
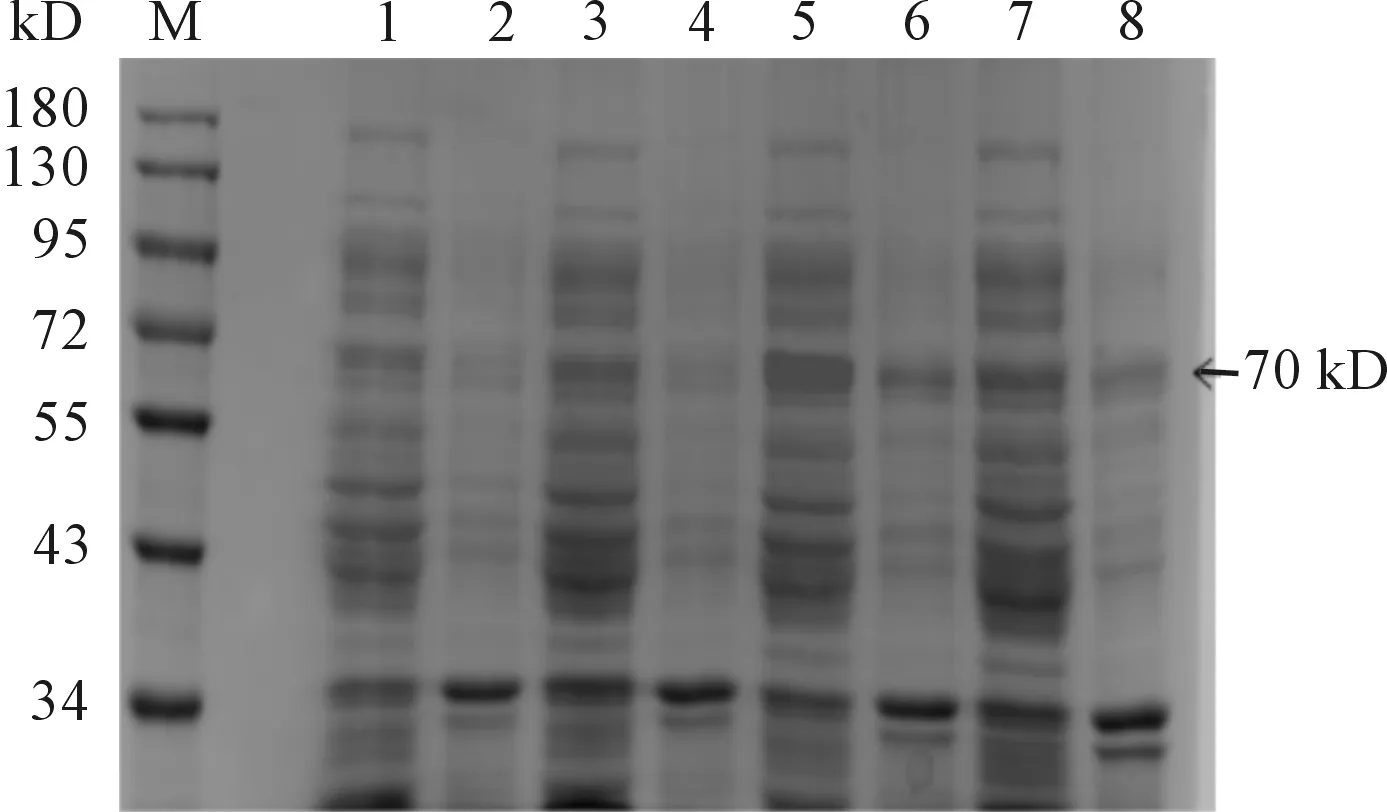
M:蛋白质分子质量标准;1、3、5、7:20、25、30、37 ℃(0.5 mmol·L-1IPTG,10h)条件下重组菌pET28a(+)-HA/BL21(DE3)经裂解液破碎后的上清; 2、 4、 6、 8: 20、25、30、37 ℃(0.5 mmol·L-1IPTG,10 h)条件下重组菌pET28a(+)-HA/BL21(DE3)经裂解液破碎后的沉淀
图2 HA蛋白在不同诱导温度条件下SDS-PAGE检测结果
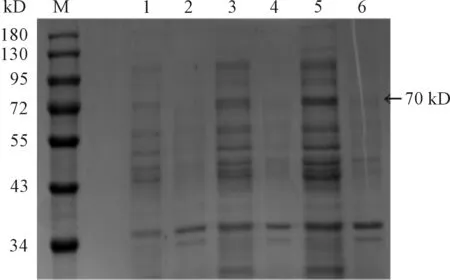
M:蛋白质分子质量标准;1、3、5:0.1、0.5 、1 mmol·L-1IPTG(30 ℃,10 h)条件下重组菌pET28a(+)-HA/BL21(DE3)经裂解液破碎后的上清; 2、 4、 6: 0.1、0.5、1 mmol·L-1IPTG(30 ℃,10 h)条件下重组菌pET28a(+)-HA/BL21(DE3)经裂解液破碎后的沉淀
图3 HA蛋白在不同诱导剂量条件下SDS-PAGE检测结果
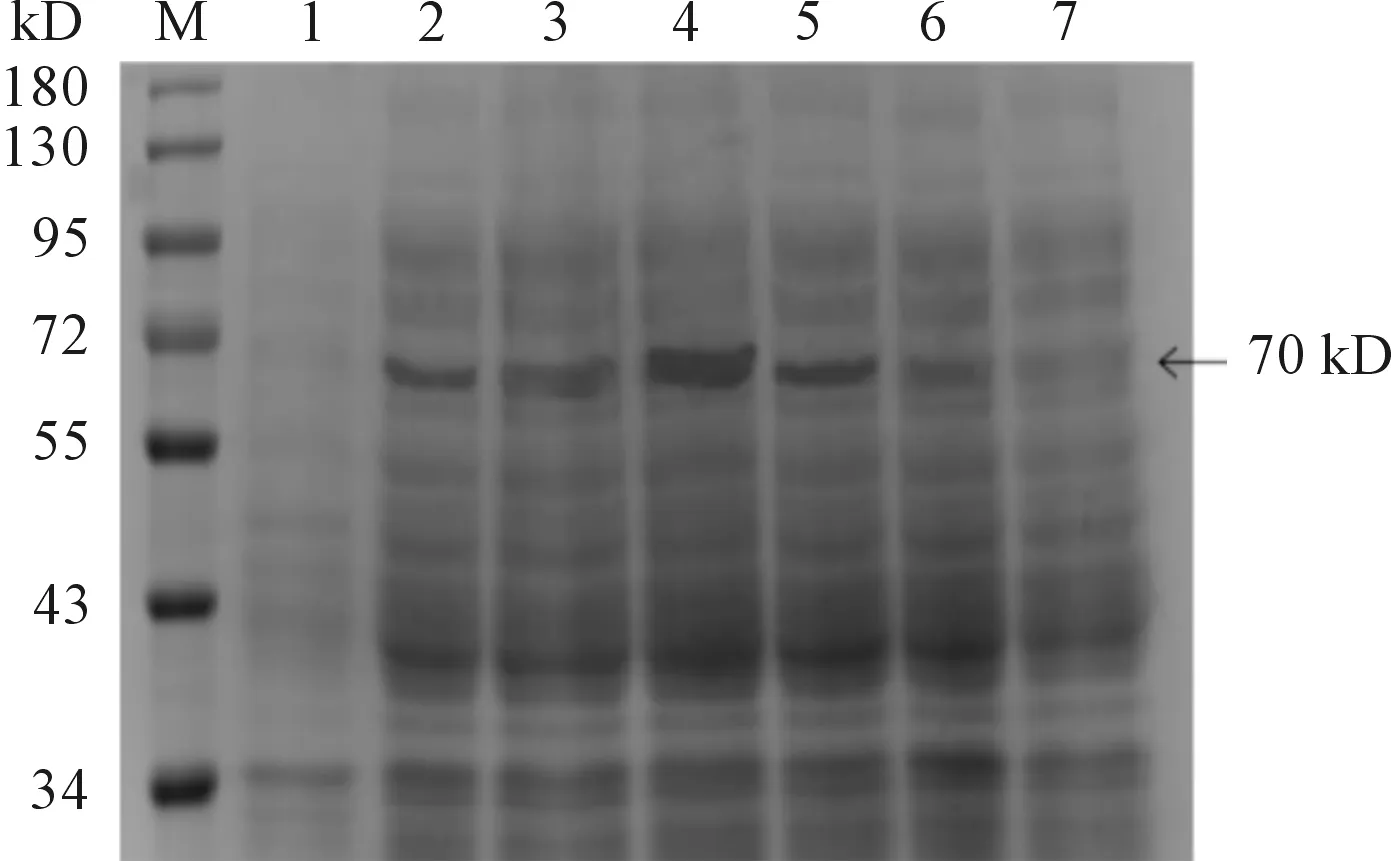
M:蛋白质分子质量标准;1、2、3、4、5、6、7:分别为2、4、6、8、10、12、14 h(1 mmol·L-1IPTG,30℃)条件下重组菌pET28a(+)-HA/BL21(DE3)经裂解液破碎后的上清
图4 HA蛋白在不同诱导时间条件下SDS-PAGE检测结果
2.3 重组蛋白PET28a(+)-HA纯化及Western blot分析
利用最大浓度咪唑(imidazole)线性洗脱后确定最佳的洗脱浓度,并进行完全洗脱,收集洗脱液,经10% SDS-PAGE电泳鉴定(见图5)。结果发现在150 mM的咪唑浓度可将大部分目的蛋白洗脱下来。纯化后的重组蛋白经Western blot鉴定后发现:在70 kD处有特异性条带,与预期的目的蛋白的大小相符(图6)。
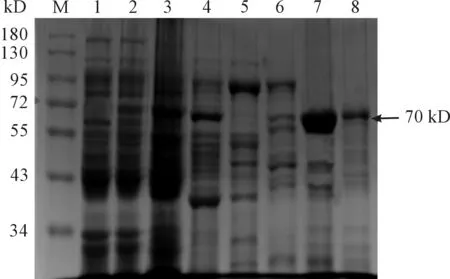
M:蛋白分子质量标准;1.空载体pET28a(+)感受态细菌超声破碎后沉淀;2.重组菌pET28a(+)-HA/BL21(DE3) 经裂解液破碎后的上清;3.HA穿透液;4.20 mM咪唑洗脱蛋白;5.50 mM咪唑洗脱蛋白;6.100 mM咪唑洗脱蛋白;7.150 mM咪唑洗脱蛋白;8.250 mM咪唑洗脱蛋白。
图5 HA纯化蛋白的SDS-PAGE电泳结果

M:蛋白分子质量标准; 1.纯化后的重组HA蛋白;2.空载体pET28a(+)感受态细菌对照
图6 HA蛋白的Western blot检测结果
3 讨论
近年来随着各类禽流感的多次大规模暴发,对感染的家禽只能大批量捕杀。随着病毒加速变异,在国内也出现了多例关于人感染高致病性禽流感死亡的相关报道。禽流感 H5N1 亚型是能够通过家禽传染给人类的高致病型禽流感,每年疫情爆发时期均产生大规模的公众恐慌。国内的研究人员在有关禽流感H5N1的病原学、致病机制、爆发规律以及预防措施方面都有较为深入的研究。本实验采用的成本低廉、周期短的原核表达系统,被广泛应用于诊断试剂、亚单位疫苗生产和蛋白功能的研究等方面[10-12]。
本研究根据 GeneBank 已发表的基因序列,设计并合成了HA的特异性引物,并选择pET28a(+)作为表达载体导入大肠杆菌中,在载体上两端都带有多聚组氨酸标签(His-tag),可以和镍柱与咪唑发生相互作用,从而有利于蛋白的亲和纯化。在筛选最佳诱导条件中,经过对温度、时间、IPTG浓度等因素的重复试验,逐渐摸索出重组质粒PET28a(+)-HA在30 ℃、IPTG浓度在1 mmol/L诱导8 h时蛋白表达量最大。鉴定结果显示:纯化后的重组蛋白可达到较高的浓度,但纯化结果略有杂蛋白,可能的原因在于蛋白洗脱浓度阶梯需要进一步优化,后期将以更精准的咪唑浓度洗脱以获得高纯度的HA蛋白。在后期ELISA实验中,所得重组蛋白与相关病毒血清有强烈反应(数值略),所以所得重组蛋白具有相似的免疫原性。吴艳菊等[13]将H5N1亚型的NS1 和NA蛋白进行包涵体原核表达,得到的蛋白免疫小鼠效果良好;邹淑梅等[14]利用包涵体表达,利用8 mol/L的尿素洗脱蛋白,表达量占总蛋白的90%。对于可溶性表达,包涵体表达量高、蛋白折叠度好。但蛋白本身无活性,需要蛋白复性等操作,因此建议比较分析其他蛋白的原核诱导表达条件、异同及其原因。
本研究获得的重组HA蛋白将为后续开展禽流感检测方法及疫苗的研究提供参考。
