盐胁迫对燕麦幼苗Na+、K+吸收和离子积累的影响
2019-06-14刘景辉杨彦明陈晓晶
海 霞,刘景辉,杨彦明,赵 洲,陈晓晶,贾 硕
(内蒙古农业大学农学院/全国农业科研杰出人才及其创新团队/内蒙古“草原英才”创新团队,内蒙古呼和浩特 010019)
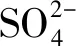
燕麦作为粮饲兼用的作物,具有抗寒、耐贫瘠、耐盐碱等特性,是盐碱地改良的作物之一[6]。研究燕麦的耐盐性机理,对耐盐品种筛选和抗盐栽培具有重要意义。在盐胁迫下,燕麦植株体内Na+积累量增加,K+积累量降低,叶片中Ca2+、Mg2+分配较多,从而保持叶生物膜的完整性、选择性,同时将胞质中的Na+区隔化入液泡来维持叶片中合理的Na+/K+比[7-11]。另外,增加植物根系Na+的外排,限制Na+吸收和区域化分布,减少体内K+流失,可维持植株体内K+/Na+平衡,提高耐盐性[12-14]。在盐胁迫下,植物会吸收更多的Na+,只有小部分可以通过韧皮部再循环到根,在很大程度上植物的耐盐性取决于对Na+从根到茎的净转运的限制,这依赖于几个关键的机制,其中之一是Na+从根到外部介质的高效外排[15]。由于阳离子竞争效应,Na+的积累会减少对K+、Ca2+以及Mg2+的吸收,导致植物体内自身的离子平衡被扰乱,所以植物通过重建体内离子平衡来抵御盐渍伤害[16-17]。
目前,对小麦[18]、向日葵[19]、沙枣[20]等耐盐性研究发现,盐胁迫造成植物根系Na+过量积累和K+大量外排,使组织器官中Na+/K+失衡。耐盐品种具有较强的Na+外排能力和较弱的K+流失,可通过驱动根系Na+/H+逆向转运体将Na+排出,并通过区域化Na+来提高耐盐性。以上研究均基于不同盐浓度或不同处理方式下对作物幼苗根系离子流速、流向进行测定,而针对盐胁迫时间长短对根系离子流影响的研究鲜见报道,尤其是燕麦。本试验采用“非损伤微测技术”[21]对燕麦根毛区Na+、K+流速和流向进行测定,并结合各器官中Na+、K+、Ca2+、Mg2+的积累,分析离子在植物体内的分布规律,从离子流动、吸收、分配角度揭示燕麦耐盐性,以期为燕麦耐盐品种的筛选及栽培提供理论基础。
1 材料与方法
1.1 试验设计
本试验于2016-2017进行,供试燕麦品种为加拿大农业与农业食品部渥太华研究发展中心提供的Vao-9( 耐盐性较强)和吉林省白城市农业科学院提供的白燕5号(耐盐性较弱)。
挑选大小一致的燕麦种子,用3%的NaClO消毒10 min,再用蒸馏水冲洗3次,用滤纸吸净表面的水分,均匀放入发芽盒中发芽。发芽盒内铺有2层滤纸,加入蒸馏水,以滤纸和种子浸湿为宜,放入恒温箱培养。恒温箱培养条件:16 h光照(25 ℃),8 h黑暗(20 ℃),湿度80%,冠层强光400 μmol·m-2·s-1。待发芽盒中种子长出子叶且胚根长度达到3~5 cm时,移至装有1/2 Hoagland营养液的聚乙烯盆中,营养液上放泡沫板固定燕麦幼苗,每盆48孔,每孔1株,放到温室培养,用电动气泵连续通气,每2 d更换一次营养液。温室培养条件:16 h光照(25~30 ℃),8 h黑暗(15~18 ℃),采用自然光照和植物补光灯补光。待燕麦两叶一心时,用70 mmol·L-1混合盐(NaCl和Na2SO4摩尔比1∶1,以下简称盐胁迫)处理0、24、48、72 h,重复3次。
1.2 测定指标及方法
1.2.1 Na+、K+离子流检测
燕麦根际Na+、K+离子流检测利用非损伤微测系统(BIO-001B,Younger USA Sci.&Tech.Corp.,USA)完成(北京市农林科学院提供此仪器测定),以非损伤性扫描离子选择电极技术获取进出燕麦根毛区的Na+、K+浓度、流速及流向信息。离子选择性微电极使用之前需要校正,Na+和K+的校正斜率为58±3。
测试之前,将燕麦幼苗根系置于测试液中浸泡10 min。测试时,用小石块将测试部位固定压好。每个样品至少测6个重复,结果取平均值。测量区域是位于距离根尖15 mm左右的根毛区。电极尖端置于距离根表面10 μm处作为原点,在垂直于根表面的方向进行两点往复移动,从而获得两点的电压差,两点移动距离为30 μm,每个样品稳定测量15 min[22]。
1.2.2 离子含量测定
幼苗根、茎、叶Na+、K+、Ca+、Mg2+含量采用原子吸收分光光度计(岛津AA-7000)测定。用去离子水洗净待测幼苗,用滤纸吸干表面水分,将幼苗根、茎、叶分开,剪2 cm左右的小段混匀,精确称量0.2 g鲜样,放入消解罐,再加入5 mL HNO3和2 mL H2O2,盖上内盖,安装好保护套消解12 h,然后将消解罐放入微波消解系统,设置微波消解程序(20 min,100 ℃;15 min,130 ℃;30 min,160 ℃),开始消解。消解结束后,取出內罐,用漏斗转移消解液于50 mL容量瓶,并用去离子水多次洗涤消解罐,加2.5 mL的掩蔽剂,用0.1% HNO3的定容混匀,用于测定Na+、K+、Ca+、Mg2+含量,生物重复3次,技术重复2次。
1.3 数据处理
利用旭月科技有限公司开发的Mage flux软件计算离子流速,用Excel 2003整理数据和制图,用SAS 9.0软件进行方差分析。
2 结果与分析
2.1 盐胁迫时间对燕麦根系Na+流速的影响
在盐胁迫前后两个燕麦品种幼苗根系Na+均表现为外排,且随盐胁迫时间的增加,燕麦根系成熟区Na+外排流速先增后降(图1)。在盐胁迫0 h下,白燕5号Na+外排的净流量显著高于Vao-9;盐胁迫24 h时,白燕5号Na+外排的净流量大于Vao-9,但两个燕麦品种间差异不显著;盐胁迫48 h时,Vao-9根系Na+外排的净流量是白燕5号的3倍,且差异显著;盐胁迫72 h时,白燕5号Na+外排的净流量大于Vao-9,两个燕麦品种间差异显著。

不同小写字母表示不同盐胁迫时间差异显著(P<0.05)。不同大写字母表示品种间差异显著(P<0.05)。下同。
Different lowercase letters above the columns indicate significant differences among different salt stress time at 0.05 level. Different capital letters above the columns indicate significant differences between varieties at 0.05 level. The same below.
图1 不同盐胁迫时间下燕麦根系Na+平均流速
Fig.1Average flow rate of Na+in the roots of oat under different salt stress duration
2.2 盐胁迫时间对燕麦根系K+流速的影响
盐胁迫0~72 h后,两个燕麦品种根系K+积累量下降,同时盐胁迫时间越长,其根毛区K+外流的净流量越大,两者结果相吻合,表明盐胁迫造成了植株K+流失。盐胁迫0 h下,两个燕麦品种K+内流和外排相对稳定,盐敏感白燕5号的K+净流量显著低于耐盐品种Vao-9;而盐胁迫24、48和72 h时,白燕5号的K+净流量显著高于Vao-9,且品种间差异显著(图2)。
2.3 盐胁迫对燕麦各器官Na+、K+、Ca2+、Mg2+含量的影响
正常条件下燕麦幼苗的各器官Na+含量很少,K+在茎秆和叶中的含量大于根系,两个品种表现一致。随盐胁迫时间的延长,幼苗茎、叶Na+积累量明显高于根系,呈增加趋势,根系Na+累积量相对较少,呈先增后降趋势(图3)。与盐胁迫0 h相比,盐胁迫24、48和72 h时,两个燕麦品种间根、茎、叶Na+积累量差异显著(P<0.05);盐胁迫48 h时,两个燕麦品种间根和茎中的Na+积累量差异不显著,而白燕5号叶中Na+积累量显著高于Vao-9;盐胁迫72 h时,白燕5号根、茎、叶中Na+分配比例分别为12.3%、43.1%和44.6%;Vao-9分别为10.1%、50.5%和39.4%,且白燕5号茎中Na+积累量显著低于Vao-9,叶片中Na+积累量显著高于Vao-9。
两个燕麦品种根、茎、叶的K+随盐胁迫时间的延长呈减少趋势(图3)。盐胁迫24 h时,白燕5号叶中K+含量显著高于Vao-9;盐胁迫48 h时,白燕5号茎中K+含量显著高于Vao-9;盐胁迫72 h时,白燕5号根、茎、叶中K+分配比例分别为21.15%、36.50%和42.36%,Vao-9分别为13.76%、40.30%和45.84%,Vao-9根中K+含量显著低于白燕5号,而叶片和茎秆中K+含量高于白燕5号,但差异不显著。
随盐胁迫时间的延长,两个品种根、茎中Ca2+含量呈减少趋势,白燕5号叶片Ca2+含量呈增加趋势,而Vao-9叶片Ca2+含量先降再升(图4)。两个品种间茎秆中的Ca2+含量在盐胁迫0、24、48、72 h时差异显著(P<0.05),且盐胁迫下白燕5号茎和叶中的Ca2+含量始终小于Vao-9。
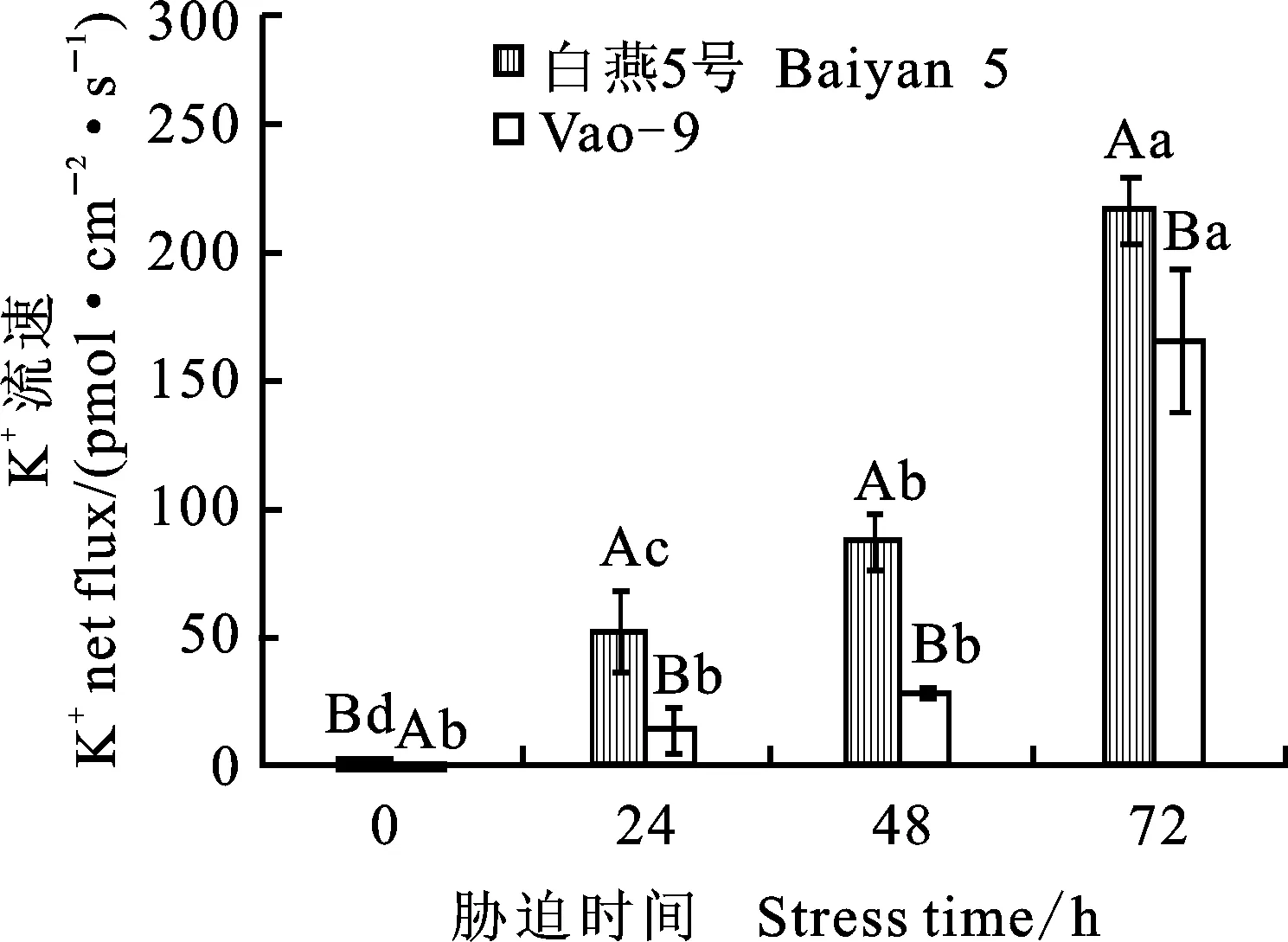
图2 不同盐胁迫时间下燕麦根系K+平均流速及流向
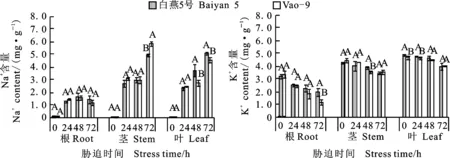
图3 盐胁迫下燕麦不同部位的Na+、K+含量
白燕5号和Vao-9根中Mg2+含量随盐胁迫时间的延长呈减少趋势,茎中Mg2+含量呈先降后升趋势,而叶中Mg2+含量呈先升后降趋势(图4)。盐胁迫24 h时,Vao-9根和叶中Mg2+含量较白燕5号多15.8%和8.7%;盐胁迫72 h时,两个品种间茎中Mg2+含量差异显著,Vao-9较白燕5号多4.2%。
2.4 盐胁迫下Na+/K+、Na+/Ca2+和Na+/Mg2+值的变化
由表1可知,随盐胁迫时间的增加,两个燕麦品种根、茎、叶Na+/K+均呈上升趋势,白燕5号根、茎Na+/K+上升趋势明显弱于Vao-9,而叶的Na+/K+上升趋势强于Vao-9。盐胁迫24 h时,白燕5号根和叶的Na+/K+显著低于Vao-9;盐胁迫72 h时,白燕5号根Na+/K+较Vao-9低26.3%,茎Na+/K+较Vao-9低17.8%,而叶Na+/K+较Vao-9高12.4%,且两个燕麦品种间根和茎Na+/K+差异显著。
盐胁迫下,Na+/Ca2+表现为茎>根>叶,两个燕麦品种间根、茎、叶Na+/Ca2+随着盐胁迫时间的延长呈增加的趋势。盐胁迫48 h时,白燕5号茎Na+/Ca2+显著高于Vao-9;盐胁迫72 h时,Vao-9根、茎、叶Na+/Ca2+值比白燕5号低22.0%、12.2%和18.6%,且白燕5号根中Na+/Ca2+显著高于Vao-9。
盐胁迫下,Na+/Mg2+表现为茎>叶>根,随盐胁迫时间的增加,两个燕麦品种间根中Na+/Mg2+先升后降,茎和叶中Na+/Mg2+逐渐上升。盐胁迫24 h、48 h和72 h时,白燕5号根和叶 Na+/Mg2+值大于Vao-9,而茎Na+/Mg2+值小于Vao-9;特别是盐胁迫72 h时,白燕5号叶片中的Na+/Mg2+显著高于Vao-9。

图4 盐胁迫下燕麦品种不同部位的Ca2+、Mg2+含量
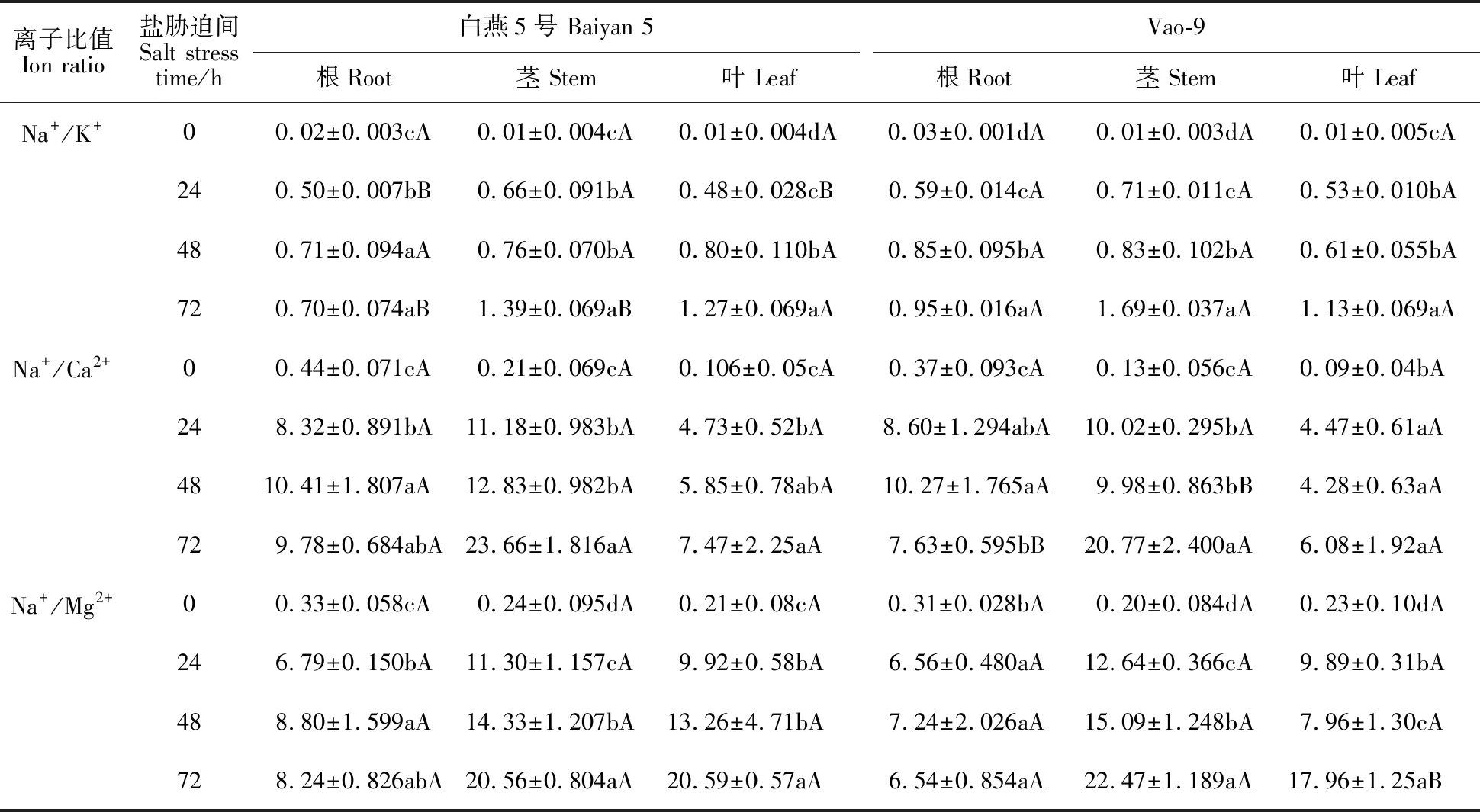
离子比值Ion ratio盐胁迫间Salt stress time/h白燕5号 Baiyan 5根Root茎 Stem叶 LeafVao-9根Root茎 Stem叶 LeafNa+/K+00.02±0.003cA0.01±0.004cA0.01±0.004dA0.03±0.001dA0.01±0.003dA0.01±0.005cA240.50±0.007bB0.66±0.091bA0.48±0.028cB0.59±0.014cA0.71±0.011cA0.53±0.010bA480.71±0.094aA0.76±0.070bA0.80±0.110bA0.85±0.095bA0.83±0.102bA0.61±0.055bA720.70±0.074aB1.39±0.069aB1.27±0.069aA0.95±0.016aA1.69±0.037aA1.13±0.069aANa+/Ca2+00.44±0.071cA0.21±0.069cA0.106±0.05cA0.37±0.093cA0.13±0.056cA0.09±0.04bA248.32±0.891bA11.18±0.983bA4.73±0.52bA8.60±1.294abA10.02±0.295bA4.47±0.61aA4810.41±1.807aA12.83±0.982bA5.85±0.78abA10.27±1.765aA9.98±0.863bB4.28±0.63aA729.78±0.684abA23.66±1.816aA7.47±2.25aA7.63±0.595bB20.77±2.400aA6.08±1.92aANa+/Mg2+00.33±0.058cA0.24±0.095dA0.21±0.08cA0.31±0.028bA0.20±0.084dA0.23±0.10dA246.79±0.150bA11.30±1.157cA9.92±0.58bA6.56±0.480aA12.64±0.366cA9.89±0.31bA488.80±1.599aA14.33±1.207bA13.26±4.71bA7.24±2.026aA15.09±1.248bA7.96±1.30cA728.24±0.826abA20.56±0.804aA20.59±0.57aA6.54±0.854aA22.47±1.189aA17.96±1.25aB
同列数据后不同小写字母表示不同胁迫时间间差异显著(P<0.05)。不同大写字母表示品种间差异显著(P<0.05)。
Different lowercase letters following data indicate significant differences among different salt stress times at 0.05 level. Different capital letters indicate significant differences between varieties at 0.05 level.
3 讨 论
3.1 盐胁迫对不同燕麦品种Na+、K+吸收及根系离子流的影响
Na+主动外排、Na+区隔化以及减少胞质中K+流失是维持Na+/K+平衡、提高植物耐盐性的有效机制之一[23-26]。混合盐胁迫下,燕麦植株Na+积累量增加,根、茎、叶Na+积累差异显著。对小麦和玉米等[27-28]的研究表明,盐胁迫下植株根部Na+含量明显高于地上部分,耐盐性强的品种将Na+主要储藏在根部,从而降低过多的Na+对自身伤害。本研究结果则表明,在相同时间混合盐胁迫下,燕麦茎、叶Na+积累量明显高于根系,茎Na+积累量为根系的1.8~5.1倍,叶Na+积累量为根系的1.7~5.0倍,表明燕麦根系并无明显贮存盐分的作用[21],这可能与作物基因型或处于不同生育时期有关。耐盐品种Vao-9在盐胁迫时间增加的情况下,将Na+优先积累在茎中,阻止Na+向叶片运输,从而降低对叶器官伤害,从而证明Na+在植物体不同器官中的积累分配是品种间耐盐性差异的原因之一,该结果与萨如拉等[10]研究碱性盐胁迫对燕麦矿质离子吸收与分配的影响结果相似。有研究发现,耐盐性较强的品种在盐胁迫下具有较强的Na+外排能力[29]。本试验中耐盐品种Vao-9幼苗根系在盐胁迫48 h下Na+净流量明显大于盐敏感品种白燕5号,可能是质膜Na+/H+转运蛋白或质膜H+-ATPase活性在盐胁迫下被诱导合成或者激活,将细胞中大量的Na+区域化在茎秆的液泡里或者将Na+从细胞质外排到细胞外,阻止Na+向叶片中的积累和运输[30]。本研究还发现,Vao-9在24 h混合盐胁迫下根、茎、叶中Na+积累量明显高于白燕5号,但在72 h混合盐胁迫下,叶Na+积累量显著低于白燕5号,茎中Na+积累量显著高于白燕5号,表明耐盐品种Vao-9对盐离子转运及分配能力较强。
由于Na+和K+有相似的离子半径和水合能[31],Na+竞争K+转运位点,使K+吸收及转运受到抑制,影响植物正常代谢,所以维持合理Na+/K+对植物具有重要意义[32-33]。有研究发现,盐胁迫使细胞去极化程度加强,促使外向K+通道和非选择性阳离子通道外流的K+增加,但耐盐性较强的品种能减少K+流失[34-35]。但也有研究显示,根据K+外排不能预测不同基因型水稻的耐盐性[36]。 本试验研究发现随混合盐胁迫时间增加,两个燕麦品种根系K+积累量呈下降趋势,同时根毛区K+外排速率加快,表明盐胁迫造成了植株K+流失;同时发现盐敏感品种白燕5号K+外排速率显著高于耐盐品种Vao-9,证明在盐胁迫条件下耐盐品种减少K+流失的能力优于盐敏感品种,但具体的分子机理有待进一步研究。
3.2 盐胁迫对不同燕麦品种Ca2+、Mg2+吸收的影响
植物受到盐胁迫后,会吸收更多的Na+,减少对K+、Ca2+以及Mg2+的吸收[16-17]。Ca2+是植物代谢和发育的主要调控者[37]。高浓度Na+可置换质膜和细胞内膜上结合的Ca2+,破坏Ca2+平衡,增加膜透性,伴随着K+吸收的减少,进一步影响Mg2+吸收[38-39],所以在盐碱胁迫下作物叶片中保持较低的Na+/K+、Na+/ Ca2+和Na+/Mg2+值,是衡量作物耐盐碱的重要指标[33]。萨茹拉等[11]研究表明,碱性盐胁迫下,耐盐品种在抽穗期有较高的Ca2+选择吸收能力,对Mg2+吸收与不耐盐品种差异不大,在根和叶中Ca2+、Mg2+含量最多,且向叶片中分配Ca2+、Mg2+能力较强。而在本试验中,随盐胁迫时间的延长,两个燕麦品种幼苗根系、茎中Ca2+、Mg2+含量下降,叶片中的Ca2+含量增加,Mg2+含量先增加后下降,这可能是盐胁迫条件下不同生育时期耐盐性存在较大差异所致。耐盐品种Vao-9在盐胁迫下茎和叶中的Ca2+、Mg2+含量始终大于盐敏感品种白燕5号,且两个燕麦品种间茎中Ca2+含量在72 h盐胁迫下差异显著。Ca2+能维持细胞质膜的完整性,降低逆境下的膜透性等[39]。本试验结果表明,在盐胁迫下Vao-9较白燕5号茎中积累更多Na+,同时保证茎秆中Ca2+的高含量,可能与Ca2+降低茎秆细胞膜透性有关[40],保持茎秆中离子平衡和细胞正常代谢,进而降低叶片中Na+含量。盐胁迫下Vao-9保持叶片和茎中较低的Na+/Ca2+和Na+/Mg2+值有利于稳定细胞质膜的完整性,保证光合作用的正常进行,说明燕麦维持离子的选择性吸收与分配能力与其耐盐性有关[41]。
