DNA双链断裂损伤焦点的定量计算和分析方法研究进展
2019-06-13尤培蒙王晨曦何俊霞肖文媛
尤培蒙,黎 晨,王晨曦,何俊霞,肖文媛,赵 晋
(西北民族大学 医学院,甘肃 兰州 730030)
DNA双链断裂(Double strand breaks,DSBs) 由内在的细胞进程或外在的基因毒性造成,是DNA损伤最严重的一种,不及时修复则可引起细胞周期检查点停滞并发生细胞死亡,更大危害是不被修复和错误修复的DSB可诱导细胞基因组不稳定而呈现恶性表现[1].
DSBs形成后会立刻激活细胞的DNA损伤应答机制,使DNA双链断裂点以及附近的组蛋白H2AX,53BP,TRF2,ATM等迅速磷酸化[2],聚集在双链断裂处感应和放大DNA损伤信号并募集修复蛋白对DSBs进行修复.这些磷酸化的组蛋白大量聚集在DSBs处成为损伤灶点即焦点(Foci)[3].使用免疫荧光染色分析技术,借助高对比度、高分辨率及可重建三维图像的独特优势的激光共聚焦显微镜获取图像就可以量化灶点数目,用于评价 DSBs的数量和位置,从而评价DNA双链断裂损伤的程度[4].目前常用于定量计算和分析焦点的方法有基于ImageJ软件的Focipicker 3D粒子计数器[5]和collect cell tool细胞处理工具的AutoFoci自动焦点计数法[6],Focicounter软件[7],CellProfiler Analyst(CPA)细胞轮廓分析器[8],FoCo算法工具[9],新型算法识别系统[10]等.
1 定量计算和分析焦点算法工具
1.1 ImageJFocipicker 3D粒子计数器
该技术首先搜索图像最大中心,然后从中心扩展到局部阈值定义的焦点边缘,它在识别出焦点后,可以通过T值(定义焦点内像素的最小亮度范围),V值(定义一个焦点所包含的最小面积),R值(定义识别粒子的最小半径)条件对结果进行过滤[11].它可以分析识别对象的体积、面积、强度和坐标,并将结果存储,同时识别对象可在单独的图像堆栈中以不同的颜色显示.
1.2 应用collect cell tool细胞处理工具AutoFoci自动焦点计数法
AutoFoci检测包含foci和非特定背景信号的对象进行记录各种对象属性,如强度、大小和锐度.对象属性的组合与人工分类相关联,并给出了一种双模态对象分布,可用于区分焦点背景信号[12].
使用ImageJ的Collect cell tool软件工具从获取DAPI通道的5张堆栈图像中识别单个细胞核,并对其进行裁剪以获得单细胞图像[13].然后从5张堆栈图像中选择对比度最高,非特定焦点影响小的一张进行进一步分析,并将背景信号与所有5个平面的最大强度投影进行比较,完成所有图像采集和处理步骤.应用AutoFoci算法设置对象评价参数(OEP)的阈值便,标识单元内的对象细胞核,背景信号以及焦点,获得双模态对象分布实现DSBs的自动评分[14].
1.3 Focicounter软件
FociCounter是一个简单的聚焦标记程序,它可以绘制多个帧数的测量图像,通过调整细胞图像参数阈值如MSS(median square side中值滤波器)EP(enhancement parameter对比度)CR(crown radius焦点边缘识别半径)RR(rim radius焦点识别半径)BD(brightness difference亮度)计算获得最佳检测焦点[7].计数结果包括检测到的焦点个数、焦点亮度和细胞亮度,用于获得这些结果的参数集合同样也能保存下来进行比较分析.
1.4 CellProfiler Analyst (CPA)细胞轮廓分析器
CellProfiler Analyst (CPA)是一个高通量、基于图像的实验数据图像分析软件.CPA软件使用高分辨率细胞分类器识别细胞核的细微差别进行预分类,实现对一定数量的对象进行快速检索,通过人工设置多组滤镜识别参数对分类图像组进行焦点的搜寻,记录,并进行计算焦点阴性和阳性比率[15].
1.5 Foco聚焦量化算法
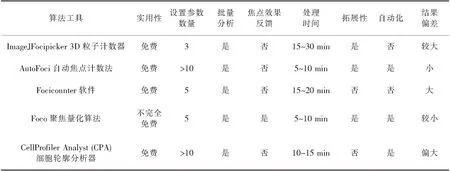
聚焦量化算法Foco是一个开源的算法工具,它具有用于单个焦点计数的GUI(图形用户界面),适用于单个细胞显微图像中各种细胞核病灶的计数.该算法只需要调整5个参数就能够可靠地量化密集分布的病灶,例如受辐射剂量高达10 Gy的细胞图像病灶密集程度很高,即使在低信噪比和密集分布的聚焦情况下,Foco也能够产生可靠和稳定的聚焦量化[7][9][12].表1汇总了五种计数和分析方法的主要特点.
表1五种定量计算焦点的分析方法和算法工具的比较
2 定量计算和分析病灶过程中问题的解决方法
2.1 参数校准问题
在使用ImageJ,Focicounter等粒子计数和图像处理软件分析计算焦点foci时,选择不同的R值,V值,T值进行对选取对象过滤所得结果有很大的差异.例如在ImageJFocipicker 3D粒子计数器计数中选取的“Minimum pixels number in the focus(焦点的最小像素)”的参数调整要在1~3 pixels以内,不同的参数所得的焦点数是不同的.KroeberJ等人解决思路是进行Bland-Altman分析又称为数据偏倚分析[16].用2~3组不同的参数计算分析焦点数,得出测量结果“一致性界限”,并用图形的方法直观地反映出这个一致性界限——通常以测量结果的差值为纵轴,以测量结果的均数为横轴,绘制散点图进行校准.同时需要用流式细胞术,细胞凋亡实验和细胞克隆实验作为参考,验证这个一致性界限的准确性[17],也可区别细胞凋亡或其他原因引起的DNA损伤灶点和正常化合物遗传毒性导致的灶点的假阳性.校准后的数据才更具有准确性和真实性.
2.2 双染双标焦点计数问题
在使用ImageJ,AutoFoci等粒子计数和图像处理软件分析计算焦点foci既能够进行单染单标的焦点计算,也能够进行双染双标的焦点计数,而且可以解决DNA损伤双染双标灶点位置毗邻或重叠的问题.根据Laia Hernández等人在进行γH2AX焦点计数和细胞周期分类是提供的思路[18],例如进行TRF2和53BP双标双染的图像分析时,可以捕获红(53BP)+绿(TRF2)+蓝(DAPI)和红(53BP)+绿(TRF2)+蓝(DAPI,激光通道关闭)图像分别记录保存再使用软件进行分析,定位细胞核记录红色和绿色焦点量,以及红+绿总量做以下差值运算:S1=Number of green dots—(Amount—Number of red dots)S2=Number of red dots—(Amount—Number of green dots)再做偏倚校准.如果分析焦点时出现假阳性,可参考LengertN,MirschJ等人经过将近50万个细胞焦点的计数的运算方法即Actual Value(真实值)=True-Positives(真阳性量)/(True-Positives+false-positives)获取有效的焦点计数[6][14].
2.3 灶点空间位置重叠问题(Foci overlap)
激光共聚焦显微镜使用获取的扫描图像是一种特殊的复合图像,在分析和计算损伤灶点的时候,会出现细胞核空间位置在图像中的重叠,或者不同层次的焦点亮度在图像中表现差异,使得计数的准确性降低.免疫荧光图像数据获取过程中LengertN,Mirsch J等人采用AutoFoci计数分析法的cell collect tool工具[12][13],González JE,Lee M等人使用cell profile工具进行处理[15][19].以AutoFoci分析法为例,它要求使用扫描显微镜以DAPI通道检测标志物的5层图像图像,并选择高对比度识别信号强度最大的图像投影进行运算和分析.实验过程中仍需要记录每个图层的参数数据便于矫正和参数的选用.
2.4 细胞核无效量问题
此问题一般出现在人工计算分析焦点时,由于免疫荧光实验过程中细胞本身的因素造成细胞核无效量增多,核灶点准确性降低,人工选取细胞核也会有很大误差,主要表现在细胞核图像DAPI蓝色通道有很多核外染色伪影,细胞核变性[20].避免这个问题首先要保证免疫荧光实验过程中细胞状态良好,细胞量正常或略多,可以保证细胞核有效量.其次使用AutoFoci计数分析法的cell collect tool工具,cell profile图像处理工具进行智能图像选取.图像选取有效量高,计算和分析焦点时,才尽最大可能的消除细胞核出现灶点无效量.
2.5 核灶点亮度(Foci brightness)和核灶点面积(Foci area)问题
免疫荧光激光共聚焦定位技术是反映DNA双链断裂损伤最直观的检测项目,即对DNA损伤的灶点数量和灶点位置算法分析.但是因细胞种类的不同,实验细胞的状态,或者是引起细胞DNA双链断裂损伤的原因不同,引起的焦点亮度(Foci brightness),细胞核亮度(cell brightness)以及焦点面积(Foci area)的期望值和实际值偏差[5][9].目前相关研究未给出确切的解决方案.
3 结语
测定DNA双链断裂损伤方法有很多,如流式细胞术、中性彗星电泳实验等[21,23],而选用免疫荧光技术通过激光共聚焦图像可反映出不同损伤灶点位置和损伤程度,但是由于激光共聚焦图像中损伤灶点颗粒大小,颗粒聚集程度与引起细胞DNA双链断裂损伤的复杂关系,使用定量计算和分析算法工具也各具特色,新型的算法识别系统也在开发应用,所以选择合适准确的定量计算方法和分析工具,以及同时辅助应用其他的DNA双链断裂损伤测定方法,有利于提高分析计算结果的准确率.
