128例再次心脏瓣膜置换术的原因分析
2019-06-13郑才斌
黄 烽 郑才斌 韩 涛
1 福建省立医院心脏血管外科,福建医科大学省立临床医学院,福建省 福州市 350001 2 南平市第一医院胸心外科,福建省 南平市 353001
心脏瓣膜病是临床上比较常见的心脏疾病,在人群中的发病率较高,瓣膜置换手术是最有效的治疗方案[1]。由于人口的老龄化及平均寿命的延长,瓣膜病变继续进展、瓣膜置换术后血流动力学的变化、人工瓣膜障碍及并发症等因素,心脏瓣膜再次置换甚至多次置换成为临床上不可避免的热点和难点。本研究回顾性分析128例心脏瓣膜再次置换患者的病历资料,并就再次心脏瓣膜置换患者的术前一般资料、病史特点,总结治疗经验,现报道如下。
1 资料与方法
1.1 一般资料
本组选取2000年1月至2015年12月在福建省立医院心血管外一科行心脏瓣膜再次置换术的住院患者128例,纳入标准为既往在体外循环下接受过心脏瓣膜置换手术。128例中,男性50例(39.1%),女性78例(60.9%),年龄21~70岁,平均(45.6±11.4)岁,距前次心脏瓣膜置换时间间隔0.75~29年,平均(10.99±5.56)年;术前心功能分级(New York Heart Association,NYHA),Ⅱ级6例,Ⅲ级100例,Ⅳ级22例;术前心脏彩超部分数据,左房内径2.25~10.4 cm,平均(4.93±1.27)cm,左室舒张末期内径2.96~9.15cm,平均(5.19±1.15)cm,左室射血分数30.1%~70%,平均(54.03±9.51)%;术前心胸比0.48~0.85,平均心胸比(0.65±0.09)。术前合并房颤者72例,合并糖尿病者11例,合并高血压者20例,合并肺动脉高压者32例,合并冠心病者6例,肺部感染者14例。
1.2 手术方法
二尖瓣置换术者86例,其中生物瓣20例,机械瓣66例。主动脉瓣置换术者12例,其中生物瓣6例,机械瓣6例。二尖瓣联合主动脉瓣置换术者30例,其中生物瓣2例,机械瓣28例。全组病例中126例为二次瓣膜置换手术,2例为三次瓣膜置换手术。
1.3 术后处理
术后送至监护室观察,呼吸机辅助呼吸,常规使用多巴胺、多巴酚丁胺和硝普钠等血管活性药物。根据活化凝血时间中和使用鱼精蛋白,按血气分析结果调整内环境及电解质。观察纵膈引流量,保持引流管通畅,记录尿量。待循环及呼吸稳定后拔除气管插管。
1.4 统计学方法
采用描述性统计学分析,计量资料采用(±s)表示,计数资料采用n(%)表示。
2 结果
2.1 病因分析
全组128例患者中,依据其瓣膜病变的原因分为4类,(1)因风湿性心脏病变由二尖瓣病变发展至主动脉瓣再次心脏瓣膜置换30(23.4%)例;(2)因生物瓣衰败再次心脏瓣膜置换22(17.2%)例;(3)因机械瓣相关并发症再次心脏瓣膜置换42(32.8%)例;(4)因三尖瓣继发病变再次心脏瓣膜置换34(26.6%)例,具体见表1。
30例风湿性心脏病进展瓣,为原二尖瓣置换术后继而出现主动脉瓣病变。34例三尖瓣继发病变中,为左心瓣膜置换术后继续出现三尖瓣严重关闭不全。22例生物瓣衰败中,13例生物瓣严重钙化、6例瓣叶磨损变形、2例血栓形成和1例慢性炎性反应。42例机械瓣相关并发症中,4例为内源性机械瓣相关并发症,其中2例出现瓣膜磨损、1例瓣膜破裂、1例瓣柱断裂,且均为单叶瓣。38例为外源性机械瓣相关并发症,其中瓣周漏12例,人工心脏瓣膜血栓(prothetic valve thrombosis,PVT)形成12例,瓣环组织内膜增生8例,人工瓣膜相关性心内膜炎(prothetic valve endocarditis,PVE)6例。
3 讨论
将本组128例研究对象的再次心脏瓣膜置换原因,笔者根据其是否原人工瓣膜出现功能障碍或者再发别的瓣位的瓣膜发生病变,分为原位及非原位两组统计,可以更加直观的观察,具体分为以下几类:风湿性心脏病变由二尖瓣病变发展至主动脉瓣、生物瓣衰败、三尖瓣继发病变、机械瓣相关并发症。
(1)风湿性心脏病变由二尖瓣病变发展至主动脉瓣:二尖瓣置换术后再发主动脉瓣风湿性病变加重是本组研究再次心脏瓣膜置换的重要原因之一,占全组的23.4%。该类患者瓣膜风湿性病变发展缓慢[2-3]。研究发现,因病变继续进展而再次行心脏瓣膜置换手术的时间间隔为(11.67±4.32)年,该类病因患者手术平均年龄为(40.06±11.35)岁,根据术中探查后的实际情况,可采取主动脉瓣成形或预防性置换主动脉瓣的治疗策略[3-4]。(2)生物瓣衰败:因生物瓣衰败而再次心脏瓣膜置换的患者占全组17.2%,距上次手术时间间隔为(11.45±3.56)年,通过术中探查具体表现为生物瓣严重钙化、瓣叶磨损变形、血栓形成和慢性炎性反应。生物瓣与人体自身瓣膜结构较为相近,目前研究普遍认为生物瓣使用寿命预期为10~15年[5],本组研究较预期使用年限偏低,除了现有瓣膜制作工艺水平因素外,可能与平均年纪较轻有关。年轻患者相比老年患者发生瓣膜损坏的时间更快、程度更重,这与年轻患者心搏出量大、生物瓣膜受到的血流冲击较老年患者大以及更容易钙化等。(3)三尖瓣继发病变:本组中瓣膜置换术后出现三尖瓣关闭不全的患者有占26.6%。左心脏瓣膜置换术后出现三尖瓣关闭不全的机制可能有以下原因,①持续性的右室及三尖瓣环扩大,在二尖瓣的慢性病程中,长期过重的压力负荷使右室及三尖瓣环承受着不可逆性损害,二尖瓣置换术后,心搏出量可随着增加,而右心仍然由于过重的舒张期负荷而扩大,阻碍扩大的三尖瓣环恢复,并以此形成恶性循环;②持续性的肺动脉高压可引起右室扩大及功能障碍,长期风心病严重的二尖瓣病变使肺血管病变不可逆转,肺动脉高压可持续存在[6];③二尖瓣置换术后瓣膜仍存在返流或狭窄,使右室功能不断损害及肺动脉压不断升高,致使功能性三尖瓣关闭不全;④风湿性瓣膜病患者因反复的风湿活动使心肌受累,发生纤维化改变,致右室功能不全加重,引起三尖瓣关闭不全。研究报道,术前合并房颤、左房内径扩大是左心脏瓣膜置换术后发生三尖瓣关闭不全的独立危险因素[6-7],本组病因患者中70.6%(24/34)合并有房颤。(4)机械瓣相关并发症:机械瓣相关并发症是心脏瓣膜置换术后最严重的并发症之一。中国机械瓣膜的使用率高于生物瓣膜,术后出现机械瓣相关并发症也随着增多,我院收治42例此类患者,按发病机制人工机械瓣相关并发症可分为内源性和外源性。由于早期制作工艺水平的限制,人工机械瓣相关并发症以内源性为主,主要由瓣膜磨损、破裂、瓣柱断裂等因素引起。随着人工瓣膜制作工艺的发展与进步,目前外源性人工机械瓣相关并发症成为主要原因[8-11]。42例患者外源性机械瓣相关并发症中瓣周漏发生的原因有瓣膜的黏液样退行性改变,容易被缝合线切割而发生瓣周漏;外科操作技术不当,切除过多的瓣周组织;缝合技术不到位,缝的过密或过疏,或打结用力过度造成瓣周组织撕裂,或线结松脱等都可致瓣周漏;人工瓣膜选择的尺寸不合适,过大或过小都易造成瓣周漏。PVT是人工瓣膜置换术后严重的并发症,机械瓣的发生率高于生物瓣。随着人工瓣膜的制作工艺不断提高进步,由于瓣膜本身造成的PVT较之前已明显降低。机械瓣膜置换术后血流动力学的改变、左心房扩大、心功能下降及并发房颤都是PVT形成的高危因素,抗凝不当是最常见的原因。瓣环组织内膜增生过度的形成机制目前尚不明确。这可能与心脏瓣膜置换时遗留过多的瓣叶残边,造成残边处的组织生长过度;抗凝不足是瓣环组织内膜增生过度的重要原因之一或是因为选择了较小型号的瓣膜造成跨瓣压差升高,使血流形成涡流,继而产生内膜损伤所致[8,11]。此外PVE也是发生瓣周漏的常见原因,在本组6例PVE患者中,主要是由于人工瓣膜的异物作用及血流动力学的改变导致。PVE不仅会造成患者反复的贫血、营养不良、发热和动脉菌栓栓塞等症状,还可导致瓣周漏、瓣周脓肿、假性动脉瘤等一些人工瓣膜并发症。因此,早期诊断、早期积极有效的治疗PVE不仅可降低术后并发症的发生,还可降低术后的病死率[12-13]。
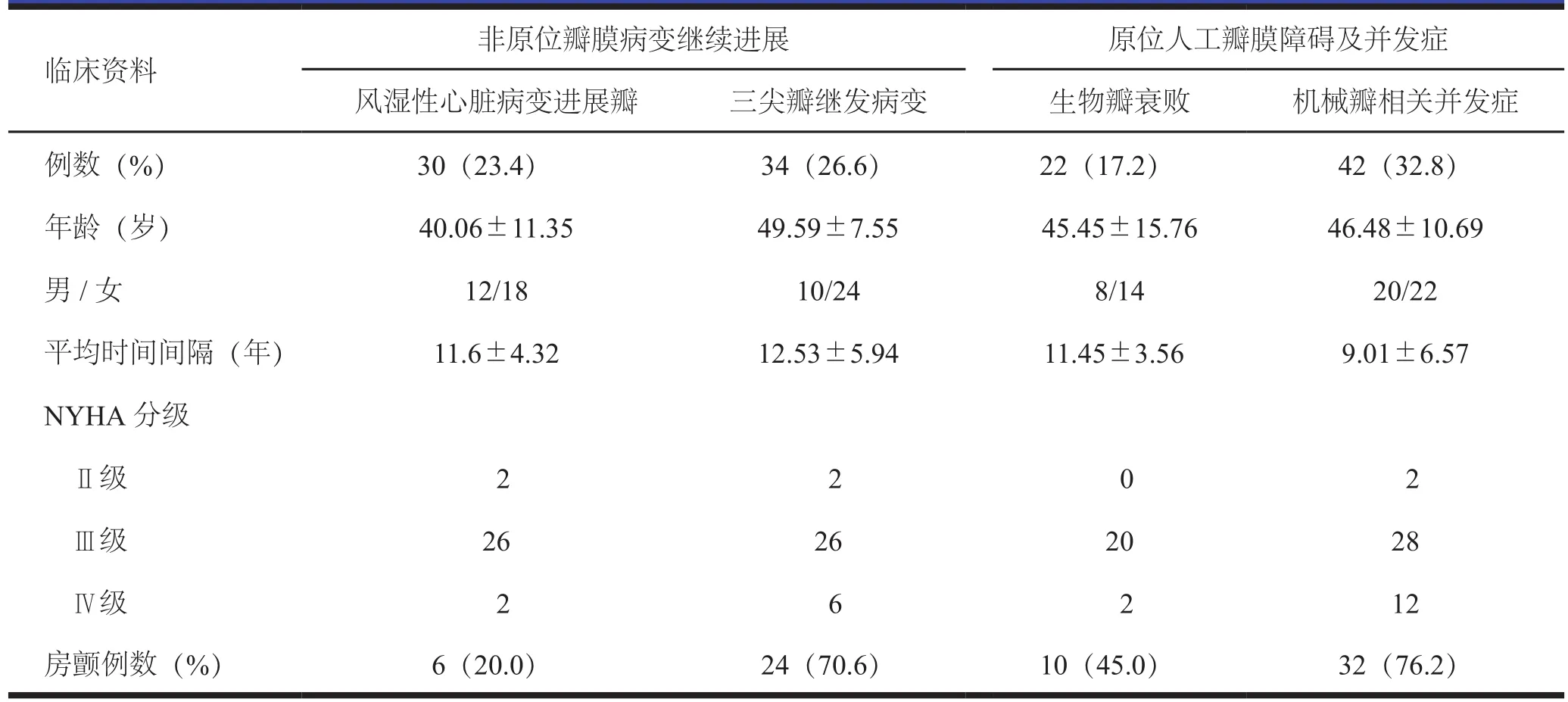
表1 128例患者再次心脏瓣膜置换原因及临床资料统计
