一种新型血管内实时测压抗栓装置的初步研究
2019-06-13冯怡雯甘树杰汤敬东
王 敏 冯怡雯 甘树杰 李 燕 汤敬东
1 上海交通大学附属第一人民医院甲乳血管外科,上海 200080 2 上海市浦东医院血管外科,上海 201399
随着人口老龄化和人民生活水平的提高,动脉硬化性闭塞症(arteriosclerosis obliterans,ASO)的发病率无论在西方国家还是在我国都呈逐年升高的状态[1-2]。据文献报道,ASO的截肢率为15.3%,死亡率为3.6%[3],对患者的生活质量造成了极大的影响。目前,对重症ASO的治疗方法包括了传统手术和血管腔内治疗,然而,无论是传统手术还是血管腔内治疗,术后高并发症率成为制约治疗成功的主要因素。国外文献报道,ASO外科治疗后,血管腔内动脉血栓形成和动脉栓塞的发生率分别为7%和5%[4],是术后最主要的并发症。因而,能否解决ASO术后血栓形成和动脉栓塞将成为决定治疗成败的关键因素。为有效解决ASO术后血管腔内血栓形成的问题,本课题组设计制作了一种集传感器和载药囊为一体的生物兼容微型装置(国家发明专利申请号201910002432.9),后文中简称为新型血管内实时测压抗栓装置。
1 资料与方法
1.1 装置原理与设计
新型血管内实时测压抗栓装置为一种方便植入目标血管段,通过术中、后血流压力的实时监测,根据血流压力的变化,对血栓形成实施实时预警,通过对血流压力的检测,实现抗栓药物的缓慢释放,达到抗栓目的的一种集传感器和载药囊为一体的生物兼容微型装置,目前国际上尚无文献报道。
该生物兼容微型装置包括压力传感器和载药囊,其结构如图1所示。该压力传感器被具有生物兼容性的聚对二甲苯聚合物包裹形成一个椭圆形的载药囊,载药囊前段上下两侧设有传感器柔性触杆,中部上下两侧设有管壁固定钩,上下两侧设有肝素缓释通道。载药囊头端还设有引线,尾端连接有电路引线。传感器柔性触杆与压力传感器本体相连,肝素缓释通道与载药囊相通。压力传感器为压阻式压力传感器,其结构如图2所示。压力传感器外表面利用生物兼容性的聚合物进行包裹,当该微型装置被放置在血管中时不影响血流;该压力传感器及载药囊仿生墨西哥丽脂鲤表皮神经触感原理,一方面,利用载药囊前段上下两侧设有的传感器柔性触杆消除了刚性触杆在流体中造成的产生“涡街效应”,从而利用压力传感器可准确测量血管内的微压和微流量,同时确保传感器不对血管内血流产生影响;另一方面,设于载药囊中部上下两侧的管壁固定钩用于在装置置入血管中相应位置后,利用管壁固定钩与血管壁固定,从而保持装置的稳定,确保压力传感器压力监测的准确性;最终,通过压力传感器在血管内被血流的挤压程度不同,从而通过载药囊后段上下两侧设有的肝素缓释通道释放不同浓度的抗栓药物。因而,该装置在置入血管中的时间内,可监测目标血管的内膜修复和血栓形成情况,通过局部靶向性抗凝,从而减少抗凝药的使用。
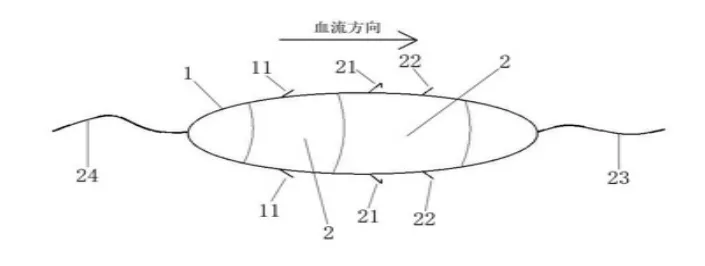
图1 集传感器和载药囊为一体的生物兼容微型装置示意图
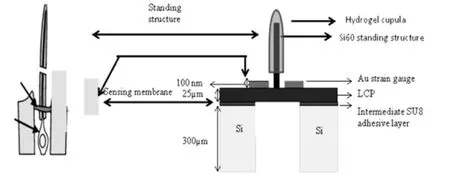
图2 压阻式压力传感器结构示意图
1.2 体外实验
为评估新型血管内实时测压抗栓装置在流动液体条件下作用效果和稳定性,课题组进行了模拟体外试验。试验装置如图3所示,包括压力调节泵、压力瓶、连续流量泵,加热器、测试瓶及测试用的实时测压抗栓装置。各个装置间以封闭压力管道连接,以保证输出的压力与压力泵的输出数值相一致,压力泵的输出数值则可手动调节和监测。加热器将液体加热至37℃,以模拟正常人体内血液温度。该试验所用液体为等渗盐水,以模拟正常人体血液环境的渗透压。流量泵的流量控制在4 L/min,即模拟人体内血流的平均流量。实时测压抗栓装置通过连接线与外部输出设备相连,最后在计算机上连续记录所测得的压力。外部输出设备包括模拟数字信号转换电路和阻抗提取电路两部分。其中,模拟数字信号转换电路为了提高转化精度,降低量化噪声,采用采样速率和分辨率较高的ADS4122和DAC900芯片。阻抗提取电路包括驱动放大电路、差分检测电路、放大滤波电路以及单端转差分电路。驱动放大电路用于放大DAC输出的扫频信号,差分检测电路用于提取传感器信号,放大滤波电路用于传感器信号的放大和滤波处理,单端转差分电路用于将信号转换成易于ADC采样的信号。

图3 体外测试装置
1.3 动物实验
为验证新型血管内实时测压抗栓装置在体内放置及测压的可行性,课题组进行了初步的动物实验。动物实验获得上海交通大学附属第一人民医院动物伦理委员会的批准。该动物实验均符合中国国家标准《实验动物环境及设施》(GB14925-2001)及相关规定。动物实验实施对象为一只10月龄母羊,体重47公斤,上海交通大学医学院实验动物部提供。实验动物合格证号:SCXK(沪)2018-0037。
实验对象用肌肉注射氯胺酮15 mg/kg镇静后,用异氟烷诱导麻醉。取侧卧位。插管后,使用容量控制的呼吸器对动物进行机械通气。用2%~3%异氟烷在由80%~100%氧气补充室内空气的气体混合物中维持麻醉。通过检查眼睑反射和持续监测整个潮气量(呼吸量和频率适应其保持在35~45 mmHg范围内,1 mmHg=0.133 kPa),心电图,动脉血压,心率和血氧饱和度来监测麻醉。丁丙诺啡盐酸盐0.3 mg和美洛昔康0.5 mg/kg 用于镇痛。通过手术将该装置置入目标血管后进行连续监测。并且,为对比分析该装置的测量性能,实验同时通过下肢动脉穿刺连接多通道生理记录仪监测下肢动脉压变化。
2 结果
2.1 体外实验结果
体外试验结果如图4所示,在测量开始的48 h,传感器基线的出现显著漂移。在开始的10 h内,漂移率达到10 U/h。因测量是在750 mmHg(单位大气压)下进行的,该值对应于0.7 mmHg/h的初始漂移。然而,在20 h后漂移迅速衰减至0.12 mmHg/h,并且在测量50 h后,传感器的输出保持稳定,并与认为设定的压力输出值一致,显示了该实时测压抗栓装置在体外试验中压力测量的可信性较高。
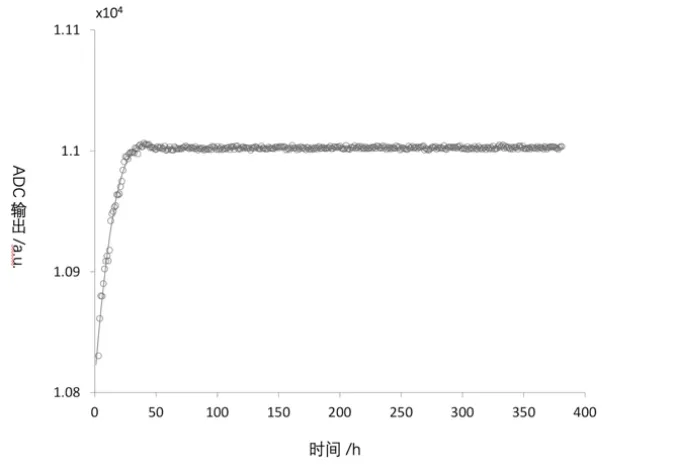
图4 新型血管内实时测压抗栓装置实时血流压力监测
2.2 动物实验
动物实验中,实验对象处于麻醉状态下,通过计算机对该装置检测的实时动脉压波形进行记录,具体波形如图5所示。由多通道生理记录仪记录的波形作为参考信号,新型血管内实时测压抗栓装置记录的血压变化周期为1.42 Hz,血压波动范围在42~80 mmHg,单个血压周期的峰峰值为36 mmHg;同时,多通道记录仪测的血压变化周期为1.44 Hz,血压波动范围为48~85 mmHg,单个血压周期的峰峰值为34 mmHg,两者呈现出较好的相关性,(r=0.85,P<0.01)。
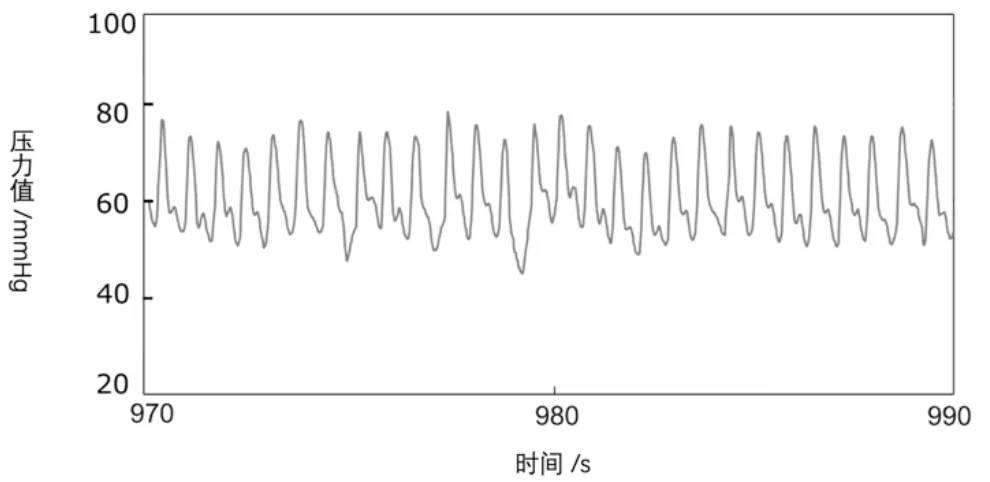
图5 新型血管内实时测压抗栓装置测得动脉压波形情况
3 讨论
血管内局部血流压力变化是判断血栓形成重要依据。血栓形成的原因包括血液改变、血管受损和血流淤滞,而血流速度变慢和淤滞更是血栓形成的重要机制。当手术后血管形态等原因导致血流紊乱造成涡流时,使得血细胞在涡流内滞留时间长,将促进血栓形成[5]。根据血栓对血流动力学影响的分析及计算流体力学模拟表明,血栓会对靶向血流循环系统的血流动力学参数造成严重影响,血液流经血栓段时压强降低、流速和壁面剪切力增加,血液流动的阻力增加,血流会出现:速度减缓、压力梯度减小、壁面剪切力的分布更加均匀,从而会导致对靶向血流循环系统的供血能力下降,在血栓的周围和相应血管内形成新血栓的可能性增加[6-8]。因而,血管内局部血流压力变化是判断血栓形成重要依据。
在第9版ACCP临床实践指南中血栓栓塞性疾病的抗栓治疗,推荐低分子量肝素来治疗和预防血栓,并建议抗凝药物的使用总疗程至少为3个月,优于较短的治疗时间[9]。同时,文献表明局部溶栓的疗效优于全身溶栓[9-10],目前易栓处定位药物持续抗栓的优越性已得到共识,其优越性是显而易见的。
药物的缓释是将药物活性分子与高分子载体结合(或复合、包囊))后,投施到生物活性体内通过扩散、渗透等控制方式,药物活性分子再以适当的浓度和持续时间释放出来,从而达到充分发挥药物疗效的目的。按其生物降解性能的不同又可分为生物降解型和非生物降解型两类。药物在聚合物载体中的扩散可以通过两个基本途径[11]:(1)直接通过聚合物非晶区;(2)通过聚合物内部的孔隙进行扩散。
基于以上原因,笔者所在团队设计制作了该种方便植入目标血管段,通过术中、后血流压力的实时监测,根据血流压力的变化,对血栓形成实施实时预警,通过对血流压力的检测,实现抗栓药物的缓慢释放,达到抗栓目的的一种集传感器和载药囊为一体的生物兼容微型装置。
近年来,基于微电子机械系统技术(micro-electronicmechanic-system,MEMS)的微型压力传感器逐渐在临床中应用[12-14]。压阻式压力传感器体积小,可以做到横截面不超过500 μm,使设计想法能够获得实现的可能。笔者所在团队设计制作的新型实时测压抗栓装置,其压阻式压力传感器,体积小,可通过手术或介入的方法将其置入血管实时监测血流压力,其前端的引线起到引导的作用,设于载药囊尾端的电路引线与压力传感器本体相连,且直径较细,可穿在外部导丝内,从而在装置置入血管中时,通过将电路引线穿过导丝,利用导丝将装置置入血管指定位置后,撤出导丝即可,而外部的电路引线则外接相应的压力显示设备和报警器等,利用压力显示设备便可设定压力传感器对于血流压力监测的阈值,且同时连通报警器进行报警,从而使得在监测的过程中,通过压力传感器测得的压力变化(在设定阈值内),控制载药囊释放出不同浓度的抗栓药物,以达到局部抗栓的目的,如压力传感器测得的压力值超过某个设定的阈值,则说明装置放置处已有血栓形成,且同时出发报警,此时,临床医师第一时间转为溶栓导管进行对血栓的治疗,并可以根据血流恢复情况,精确控制用药量,尽可能降低溶栓药对其它器官的损伤。
目前,对于这种新型实时测压抗栓装置,笔者所在团队才进行了一些初步研究,证明了其体内体外实时测压的可行性,对于药物缓释的效果及最终的临床效果仍需大量的后期工作进一步验证。
