儿童肿瘤溶解综合征高尿酸血症的诊治进展
2019-06-13郑胡镛
蒋 理 郑胡镛
(国家儿童医学中心 首都医科大学附属北京儿童医院血液肿瘤中心 儿童血液病与肿瘤分子分型北京市重点实验室 儿科学国家重点学科 儿科重大疾病研究教育部重点实验室,北京 100045)
近些年来,通过对儿童血液肿瘤的多药联合化学药物治疗(以下简称化疗)方案的不断优化,强化方案对肿瘤细胞的杀伤作用愈发高效迅速,尽管支持治疗得到重视和提高,但治疗相关合并症仍然是儿童血液肿瘤患者主要的死亡原因[1],其中肿瘤溶解综合征(tumor lysis syndrome, TLS)是化疗初期具有高肿瘤负荷患儿易发生的危及生命的严重合并症[2]。TLS是一种由于大量肿瘤细胞破坏,胞内核酸、钾、磷等成分爆发式释放,引起的严重代谢紊乱疾病。临床上以高尿酸、高钾、低钙及高磷血症为主要特征。高尿酸血症所致急性肾损伤代表了TLS最严重的结果,因此对高尿酸血症的早期识别和积极干预是疾病管理的重要内容。
1 高尿酸血症
1.1 高尿酸血症的诊断
国际上将2次非同日的空腹血尿酸浓度作为诊断指标。男性>420 μmol/L (7 mg/dl),女性>357 μmol/L(6 mg/dl)诊断为高尿酸血症。儿童高尿酸血症的定义则是血尿酸高于特定性别、年龄的正常值上限:1~12个月婴儿>500 μmol/L(8.4 mg/dl),1~ 10岁儿童>320 μmol/L(5.3 mg/dl);11~15岁男童>470 μmol/L(7.8 mg/dl),11~15岁女童>350 μmol/L(5.8 mg/dl),15岁以上儿童采用成人标准[3]。
1.2 高尿酸血症所致肾损害在TLS分级中的重要性
对TLS管理的关键是对血液肿瘤患者进行危险度分级,Cairo等[4]以肿瘤的类型、负荷、肾脏损害等为危险因素,建立了TLS的分级模型。将发生率低于1%的患儿定义为低风险(low risk disease, LRD),将发生率为1%~5%的患儿定义为中风险 (intermediate risk disease, IRD),将发生率超过5%的患儿定义为高风险(high risk disease, HRD)。如图1所示,急性白血病(急性非淋巴细胞白血病和急性淋巴细胞白血病)TLS风险评估取决于白细胞计数(white blood cell count, WBC)和乳酸脱氢酶(lactic dehydrogenase, LDH)浓度。在急性非淋巴细胞白血病中,WBC小于25×109/L且LDH低于正常值上限的两倍的患儿可认为患TLS的风险低,为LRD组。WBC大于等于25×109/L但小于100×109/L的患儿和WBC小于25×109/L且LDH大于等于正常值上限的两倍的患儿有中等程度的风险发展为TLS,为IRD组。HRD组为WBC大于100×109/L的患儿。在急性淋巴细胞白血病中,IRD组为WBC小于100×109/L且LDH低于正常值上限的两倍的患儿。HRD组为WBC大于100×109/L的患儿和WBC小于100×109/L且LDH大于等于正常值上限的两倍的患儿。但是,最终的TLS风险调整基于肾功能,尿酸在体内的急剧聚积会严重破坏人体稳态,加剧以肾脏为主的组织器官损害,与TLS的发生发展互为因果,造成恶性循环。高尿酸血症为TLS的独立危险因素,当存在肾功能损害或肾脏受累时,危险度进一步上升,LRD患者调整为IRD,IRD患者调整为HRD,足可见高尿酸血症所致肾损害在TLS分级中的重要性。风险等级的升高将大大提升TLS的发生率,为儿童血液肿瘤患者的治疗带来更多挑战。

图1 TLS危险度分级Fig.1 Evaluation of risk of TLS
TLS:tumor lysis syndrome;WBC:white blood cell count;LDH:lactic dehydrogenase;LRD:low risk disease;IRD:intermediate risk disease;HRD:high risk disease;ULN:upper limit of normal;WNL: within normal limits.
2 急性尿酸盐肾病
在血液肿瘤患者中,尿酸浓度对急性肾功能损伤和TLS的发生率有着巨大的影响[5],功能正常的肾脏可以有效地排出过量的尿素,但大量不溶性尿酸的排泄依赖于运输,而在肾小管负荷极高的情况下运输尿酸更加困难。尿酸盐在近端小管中被重新吸收和分泌这些过程的平衡决定了最终的等离子体水平[6]。当患儿血尿酸浓度突然升高,则会造成急性尿酸盐肾病,在短时间内大量尿酸盐就会在肾小管内形成结晶并堵塞肾小管,肾小管内压力升高,肾小球滤过率及肾脏血流减少,从而导致少尿或无尿,高尿酸血症对急性肾功能损伤的发生推波助澜[7]。除此之外,尿酸也可能通过多种机制直接导致肾脏中毒。尿酸清除一氧化氮,导致血管收缩和肾缺血[8]。血管平滑肌细胞暴露于尿酸,多种细胞因子的产生上调,包括单核细胞趋化蛋白-1和肿瘤坏死因子-α,导致白细胞趋化和组织损伤[9]。尿酸会抑制肾小管细胞的近端增生,延长肾损伤的时间[10]。尿酸亦可介导线粒体功能障碍引起氧化损伤进而影响内皮细胞功能,造成肾小管细胞凋亡[11]。
别嘌呤醇是传统的抗尿酸药物,通过抑制黄嘌呤氧化酶,阻止次黄嘌呤转换为黄嘌呤、阻止黄嘌呤生成尿酸。但别嘌呤醇的应用会造成黄嘌呤与次黄嘌呤的底物堆积,这两种底物的可溶性差,可导致肾小管结晶形成,使肾功能恶化[12]。由于别嘌呤醇不能减少已经生成的尿酸,故对于高尿酸血症,别嘌呤醇只能有一部分的预防作用而无治疗作用。若高尿酸血症无法控制,则势必会引起急性肾损伤,急性肾损伤代表了TLS最严重的结果,具有很大的死亡风险。
3 尿酸氧化酶的应用进展
3.1 尿酸氧化酶作用途径
在大多数哺乳动物中,体内均存在内源性尿酸氧化酶,可以将尿酸氧化为比尿酸的溶解度高十倍的尿囊素,并从尿液中排出。但在人类缺乏该酶,尿酸是嘌呤代谢的最终产物[13]。1975年,科学家首次使用微生物中提取的非重组性尿酸氧化酶来预防和治疗高尿酸血症[14]。2002年,重组黄曲霉尿酸氧化酶被批准上市,临床用于高尿酸血症的治疗及预防。与传统药物比较,尿酸氧化酶通过催化尿酸氧化形成溶解度更大的尿囊素从肾脏排泄从而降低尿酸,对高尿酸血症的治疗及预防有显著效果。2002年之前,抗尿酸药物治疗仅限于黄嘌呤氧化酶抑制剂别嘌呤醇。2002年,美国食品和药物管理局(Food and Drug Administration, FDA)批准将重组尿酸氧化酶拉布立酶应用于儿童,推荐给药方案为每日0.15~0.20 mg/kg,开启了TLS治疗的新篇章[15]。尿酸氧化酶的作用途径见图2[16]。
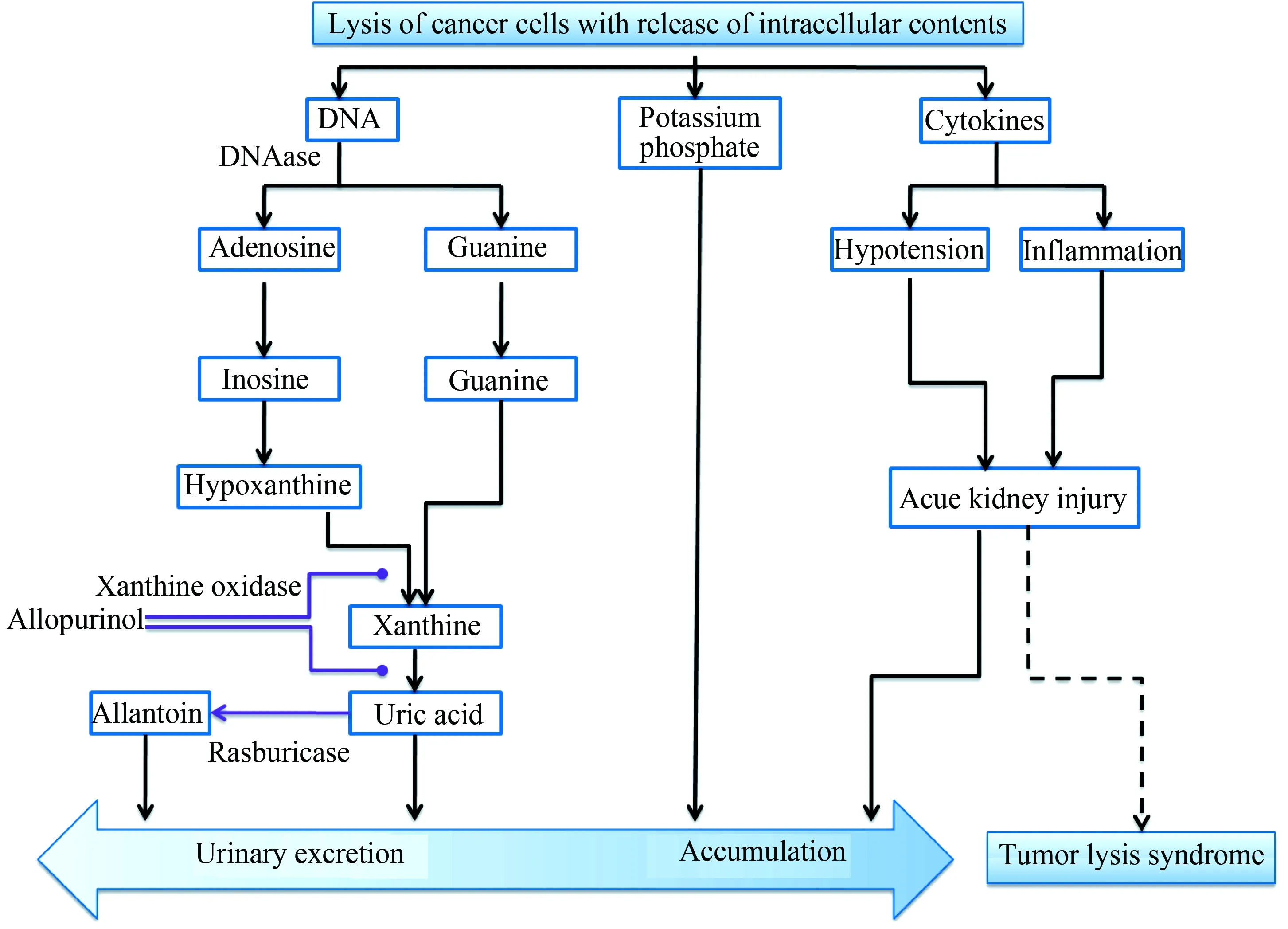
图2 尿酸氧化酶作用途径[16]Fig.2 Mechanism of uric acid oxidase[16]
3.2 尿酸氧化酶的临床试验
Goldman等[17]就52名罹患淋巴瘤或白血病的有高风险TLS的患儿进行了随机对照试验研究,这也是最早的研究尿酸氧化酶与别嘌呤醇作用效果差异的随机对照试验,在后续的研究分析中举足轻重。实验组与对照组的给药方式分别为拉布立酶0.2 mg/kg 每日1次给药,共5~7 d;别嘌呤醇300 mg/m2每日1次给药或10 mg/kg每8 h 1次给药,比较了起始尿酸浓度大于8 mg/dL的患者在第一次给药后24 h内尿酸变化,发现单次静脉注射拉布立酶与口服标准剂量别嘌呤醇在尿酸的降低程度上差异有统计学意义。实验组第一次给药4 h后血浆尿酸浓度降低了86%,而别嘌呤醇仅降低了12% (P<0.000 1)。且实验组在4 h内尿酸浓度均低于8 mg/dL,而对照组在4 h内尿酸浓度均高于8 mg/dL,该研究有力地证明了尿酸氧化酶-拉布立酶在治疗高尿酸血症方面的卓越效果并且为后来的众多临床对照试验奠定了坚实基础。Cheuk等[18]的系统综述Meta分析与Cairo等[19]的回顾性队列研究都肯定了尿酸氧化酶的有效性。
基于Goldman等[17]的研究,学者们对尿酸氧化酶的用量用法、有效性、经济成本等方面展开了讨论,Kikuchi等[20]比较了30例有高风险TLS的儿童血液肿瘤患者应用0.2 mg/kg与0.15 mg/kg的拉布立酶降低血尿酸的效果,比较了首剂后4 h与用药5 d后24 h的血尿酸浓度,差异无统计学意义,证明了低剂量方案的有效可行性。Syrimi等[21]提出单次使用尿酸氧化酶即可有效降低尿酸浓度。Yu等[22]对4项儿童研究进行Meta分析,探究尿酸氧化酶治疗儿童TLS的单次给药剂量,表明1.5 mg和0.15 mg/kg的尿酸氧化酶能有效治疗儿童TLS。这些研究均证明了尿酸氧化酶低剂量、短疗程治疗的可行性和有效性且尿酸氧化酶不需要对肾损害患者进行剂量调节,也不干扰细胞色素P450的活性[23]。
在笔者单位,一些在化疗初期发生TLS的高肿瘤负荷的患儿,也初步尝试应用尿酸氧化酶,就临床效果而言,单次单剂量1.5 mg的尿酸氧化酶静脉应用,对血尿酸的降低作用十分显著,一部分患儿在用药后血尿酸浓度甚至可下降至0,对于那些尿酸起始值较高的患儿,在首剂应用24 h后再次追加一剂1.5 mg尿酸氧化酶,基本可控制血尿酸浓度在正常值范围内。近些年,我国应用大肠杆菌表达,经发酵纯化制备出高纯度尿酸氧化酶,并在笔者单位开展了治疗及预防儿童高肿瘤负荷患者急性高尿酸血症的I期临床试验,对药效动力学进行研究,初步结果显示国产尿酸氧化酶与拉布立酶的效果大致相同,为Ⅱ期临床试验提供了重要依据。
4 高尿酸血症患儿的综合管理
虽然越来越多的研究[19,24]证实了尿酸氧化酶较传统药物别嘌呤醇能明显的降低血尿酸浓度,在整体的经济成本上也更胜一筹。但同时需要注意的是,一些研究[17,25-27]指出尿酸氧化酶与传统药物在降低急性肾损伤事件的发生率及TLS的发病率方面无明显差异,对这一问题,Cheuk等[18]对其进行过粗略计算,假设TLS的病死率为0.9%,尿酸氧化酶可减少50%的病死率,那么需要223人才会产生1人的差异,如要获得统计学差异,则需要的样本量为856人。除去样本量的因素,还应意识到TLS的管理是多方面的,仅对高尿酸血症进行干预可能会忽略其他可造成急性肾损伤的因素,可能会弱化降低TLS的发生率与病死率的作用。有研究[28]表明血液透析在快速降低尿酸浓度方面也非常有效。当血清尿酸浓度低于10 mg/dL时,血液透析对急性尿酸性肾病引起的少尿作用显著,而腹膜透析在降低尿酸浓度方面的效率较低。故应在化疗开始前或化疗开始时尽快对TLS的风险进行分级,对于中、高风险患者密切监测积极干预,注意充分水化,保持稳定尿量,对难以纠正的电解质紊乱与高尿酸血症采取肾替代治疗,对排除6-磷酸葡萄糖脱氢酶缺乏的高尿酸血症患者可应用尿酸氧化酶,时刻警惕急性肾损伤事件的发生。对TLS进行综合管理,方能为儿童血液肿瘤患者的治疗保驾护航。
