清毒汤对重症肝损伤大鼠肠上皮细胞自噬的影响
2019-06-13赵梦培李爱红车念聪张秋云杜宇琼付修文高连印
赵梦培 李爱红 崔 颖 车念聪 张秋云 杜宇琼 付修文 高连印*
(1.首都医科大学中医药学院中医临床基础学系 中医络病研究北京重点实验室,北京 100069;2.首都医科大学临床检验中心,北京 100069)
慢性重型肝炎(chronic severe hepatitis,CSH)是在慢性肝炎、肝硬化的基础上由于多种因素导致肝细胞广泛变形、坏死而出现肝衰竭的严重疾病,包括慢加急性、亚急性及慢性肝衰竭[1]。其发病机制复杂,合并症多,预后极差,病死率为50%~55%[2]。肠源性内毒素是CSH发生和病情加重的重要因素,CSH患者多伴肠道黏膜屏障功能受损使肠道黏膜通透性增加,进而诱发肠源性内毒素血症[3]。自噬是细胞通过膜囊泡结构降解胞质内大分子物质和受损细胞器维持机体稳态的生物学过程。自噬是真核细胞通过溶酶体降解胞内受损的细胞器和大分子物质维持自身内环境的稳定的病理生理过程。研究[4]显示,自噬参与保护肠黏膜机械屏障,修复受损的肠上皮细胞,降低肠道通透性。清毒汤是首都国医名师王融冰等[5]治疗肝病肠源性内毒素症的经验方,前期研究[6-7]显示清毒汤临床治疗CSH安全有效,对模型大鼠有保肝,降低肠道通透性的作用。本研究拟建立硫代乙酰胺(thioacetamide,TAA)致实验性大鼠重症肝损伤模型,通过观察清毒汤对模型大鼠内毒素、白细胞介素-17(interleukin-17,IL-17)、白细胞介素-23(interleukin-23,IL-23)肠上皮细胞自噬及相关蛋白LC3、Beclin-1的影响,进一步研究清毒汤通过诱导肠道上皮细胞自噬保护肠道黏膜屏障减轻重症肝损伤的作用机制。
1 材料与方法
1.1 实验动物
SPF级健康雄性Wistar大鼠24只,体质量180~200 g,购自北京维通利华实验技术有限公司,实验动物许可证号: SCXK(京)2016-0006,饲养于首都医科大学实验动物中心SPF级动物房,室温(22.0±2.0) ℃,相对湿度40%~70%,光照明暗交替12 h/12 h。实验动物使用及实验方案均已经首都医科大学伦理委员会审核批准。
1.2 实验试剂及仪器
清毒汤由大黄10 g、枳实10 g、厚朴10 g、茜草9 g、生地黄12 g组成,饮片均购自北京同仁堂,由首都医科大学实验室煎制,根据课题组前期实验[6-7]得出有效剂量,浓缩成生药含量1.6 g/mL 的水煎剂,4 ℃冰箱保存备用。硫代乙酰胺(货号:V900086,德国Sigma-Aldrich公司);乳果糖(货号:346940,荷兰苏威制药有限公司);内毒素(南京建成生物工程研究所);IL-17、IL-23试剂盒(美国eBioscience,公司);LC3抗体(货号:12741,美国Cell Signaling Technology公司);Beclin-1抗体(货号:3495s,美国Cell Signaling Technology公司)。高速冷冻离心机(XIANGYI),Image Pro 6.0(美国Media Cybernetics公司),日立7600生化仪,Multiskan MK3酶标仪(美国Thermo Fisher Scientific公司),JEM-2100透射电子显微镜(日本电子/JEOL)。
1.3 造模及给药
本实验采用TAA诱导大鼠重度肝损伤模型[8],24只大鼠适应性喂养7 d后,采用数字表法随机选取6只分为正常组,给予0.9%(质量分数)氯化钠注射液灌胃;其余18只为造模组,每日予以12 mg/kg的TAA进行灌胃,持续12周。第8周末将造模组采用数字表法随机分为模型组、乳果糖组、中药组,每组6只。乳果糖组给予1.6 g/kg的乳果糖;中药组给予为5.95 g/kg的清毒汤浓缩液;模型组给予等量的0.9%(质量分数)氯化钠注射液,持续4周。造模及治疗期间,各组大鼠自由摄食饮水,在造模第12周末夜间禁食。
1.4 标本制备
所有大鼠在第12周末禁食10~12 h后,按0.035 mL/kg体质量腹腔注射的水合氯醛进行麻醉。打开腹腔,腹主动脉取血,缓慢注射于无菌真空采血管内,3 000 r/min,4 ℃,离心15 min后取其上清液分装,置于-80 ℃冰箱保存备用。动物处死后立即取少许结肠组织于戊二醛中固定。取相同部位的部分肝脏及结肠组织置于4%(质量分数)多聚甲醛中,置-4 ℃冰箱保存,其余结肠组织分装于冻存管内,液氮中快速冻存,随后移至-80 ℃冰箱存放。
1.5 指标检测
石蜡包埋肠组织,制备切片,进行苏木精-伊红(hematoxylin-eosin, HE)染色,光镜下观察组织病理变化。将固定液中的结肠组织进行漂洗、锇酸固定、脱水、包埋、切片,透射电镜下观察肠上皮细胞自噬体变化。内毒素及IL-17、IL-23采用酶联免疫吸附法检测,严格按照试剂盒说明执行。Western blotting法检测肠组织中自噬相关蛋白LC3、Beclin-1蛋白相对表达量:取适量肠组织经裂解处理,离心后取上清液,经封闭、一抗孵育、二抗孵育后,胶片定影,用Image Pro Plus进行灰度统计,目的蛋白表达量以目的蛋白/β-actin的灰度比值表示。
1.6 统计学方法
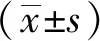
2 结果
2.1 各组大鼠肝、肠组织病理改变
为了观察清毒汤对重度肝损伤模型大鼠的组织病理学影响,对肝和结肠组织进行了HE染色。光镜下可见正常组大鼠组织结构清晰,排列规则,细胞质与细胞核分明,没有明显的炎性细胞浸润,肝脏细胞以中央静脉为中心, 呈放射状排列,肠道黏膜上皮无脱落及坏死;模型组大鼠存在大量炎性细胞浸润,炎性反应面积增加,肝脏结构破坏,有假小叶形成,肝细胞排列紊乱、变性及坏死,肠道黏膜上皮的断裂,肠黏膜上皮细胞排列相对较紊乱;乳果糖组和中药组大鼠组织的炎性浸润较模型组均有所改善,且中药组改善作用最显著,详见图1。
2.2 各组大鼠肠黏膜自噬泡电镜检测
电镜下可见正常组大鼠肠上皮细胞结构基本正常,细胞连接紧密,可见少量的自噬体;模型组大鼠肠上皮细胞连接疏松,甚至消失,线粒体肿胀,内质网扩张,自噬体极少;乳果糖组肠上皮细胞连接依然疏松,但自噬体较模型组增多,出现双层膜结构的自噬体;中药组肠上皮细胞连接较为紧密,自噬体增多最为明显,详见图2。

图1 各组大鼠肝(200×)和结肠(100×)组织切片HE染色Fig.1 Result of HE staining of liver (200×)and colon (100×) tissue in each group of rats

图2 透射电镜观察各组大鼠肠上皮细胞的自噬体结构Fig.2 Transmission electron microscopy observation of autophagosome structure of intestinal epithelial cells in each group of rats (3 000×)
2.3 各组大鼠内毒素及 IL-17、IL-23的表达水平比较
与正常组比较,模型组大鼠内毒素及IL-17、IL-23质量浓度升高(P<0.01);与模型组比较,乳果糖组及中药组大鼠内毒素及IL-17、IL-23质量浓度均明显下降(P<0.01),其中,中药组较乳果糖组的IL-17表达有所减少,IL-23表达下降更为显著(P<0.01),详见表1。

表1 各组大鼠内毒素、IL-17、IL-23表达情况Tab.1 Expression of endotoxin, IL-17 and IL-23 in each group of rats
2.4 各组大鼠肠组织中LC3、Beclin-1蛋白表达水平比较
各组任取6只大鼠检测肠组织中LC3、Beclin-1蛋白表达量见图3,表2。与正常组相比较,模型组大鼠的LC3Ⅱ/LC3I及Beclin-1蛋白显著下降(P<0.05或P<0.01)。经干预治疗后,LC3Ⅱ/LC3I均显著升高(P<0.01),乳果糖组Beclin-1含量有所升高,但差异无统计学意义(P>0.05);中药组的Beclin-1含量则显著升高(P<0.01)。

图3 各组大鼠肠组织中LC3、Beclin-1蛋白表达Fig.3 Expression of LC3 and Beclin-1 in intestinal tissues of rats in each group
A: normal control group;B: model group;C: lactulose group;D: Qingdu Decoction group.

表2 各组大鼠肠组织LC3、Beclin-1蛋白表达比较Tab.2 Comparison of protein expression of LC3, Beclin-1 in intestinal tissues of rats in each group
##P<0.01vsnormal control group;**P<0.01vsmodel group;△△P<0.01vslactulose group.QDD: Qingdu Decoction group.
3 讨论
肠源性内毒素是CSH加重的重要因素,大量研究[9-10]证实CSH伴有肠源性内毒素血症。CSH患者肝脏结构遭到破坏,血液循环失调,门静脉回流受阻,肠道黏膜充血水肿,通透性增加,致使内毒素的吸收增加。过量的内毒素进入血液,可诱导相关细胞炎性因子如IL-17、IL-23等的大量分泌,从而造成肝脏的“二次打击”,加剧肝脏损伤。IL-17是炎性反应的早期启动因子,由Th17细胞分泌,可以通过促进释放前炎性细胞因子来放大炎性反应,IL-23能促进Th17细胞产生IL-17,与重症肝损伤密切相关[11-12]。
如何通过修复肠黏膜屏障来改善CSH肝损伤也成为疾病治疗的关键环节。肠黏膜屏障的损伤因素主要是缺血、缺氧,炎性因子,病原入侵等,而肠上皮细胞作为肠黏膜屏障的重要组成部分,在抵抗微生物、毒素的入侵方面发挥着至关重要的作用。关于自噬与肠黏膜屏障功能障碍的研究[13-14]已有报道,在肠黏膜屏障功能发生障碍过程中,自噬对于维持肠上皮细胞的存活起关键性作用。自噬相关蛋白LC3及Beclin-1在自噬过程中起着非常重要的作用。LC3定位与自噬泡内膜,为自噬是否发生的重要标志物。LC3-I参与自噬起始环节,自噬发生时,经泛素样加工修饰与自噬泡膜表面的磷脂酰乙醇胺结合,经修饰形成LC3-Ⅱ。Beclin-1 是参与自噬的重要基因,与酵母自噬基因Atg6 同源,其编码的Beclin-1蛋白可参与自噬前提复合物和自噬小体的形成。目前,电镜观察自噬体是较为可靠的自噬检测手段。LC3含量与自噬泡数成正比例关系,是自噬标志物,LC3-Ⅱ/LC3-I可作为检测自噬水平的生物学指标[15]。作为自噬的标志性分子,Beclin-1作为自噬活性的辅助指标,已广泛应用于自噬活性的检测[16]。
清毒汤是在“通肠治肝”法的指导下创制治疗CSH内毒素血症的新方。该方化裁自增液承气汤,由大黄、枳实、厚朴、生地、茜草组成,具有滋阴通下、凉血解毒之效,通过清除肠道毒浊邪气,以排出肝脏中浊气,从而治疗肝病。本实验建立TAA致重症肝损伤模型,对清毒汤的机制进一步探讨,结果显示,清毒汤可明显减轻肝肠组织炎性浸润,降低实验大鼠内毒素及IL-17、IL-23表达,提高自噬体数量及LC3、Beclin-1蛋白含量。
综上,TAA致重症肝损伤大鼠内毒素升高,IL-17、IL-23释放增多,自噬体少见,并且LC3及Beclin-1蛋白含量降低,表明肝脏严重损伤时炎性反应因子及内毒素增多且肠上皮细胞自噬水平较低。清毒汤干预后可降低实验大鼠血清内毒素及IL-17、IL-23含量,并提高自噬水平,这说明清毒汤可能通过激活重症肝损伤大鼠的肠上皮细胞自噬,减少炎性反应因子的释放,来降低内毒素的产生,从而减轻肝脏损伤。
