等温滴定量热技术检测蛋白质间相互作用方法的优化*
2019-06-11贾继阳申兰兰张耀川张海娇白素兰
贾继阳 徐 奭 申兰兰 张耀川 张海娇 白素兰**
(1. 首都师范大学生命科学学院,北京 100048; 2. 北京农业职业学院园艺系,北京 102442)
0 引 言
等温滴定量热技术(ITC)是通过检测分子相互作用所释放或吸收的能量,通过单次滴定实验即可提供完整的热动力学信息,直接提供结合常数,化学计量比及反应焓变,揭示蛋白质分子间特异性相互作用[1].ITC技术的特点是需要的样品量非常小且无需任何化学修饰或标记,其能够检测的亲和力范围从100 μmol/L到1 nmol/L[2].高质量的ITC数据需要经过样品制备,滴定实验,数据分析及实验优化几个步骤才可能获得.几乎所有蛋白质类型的样品和几乎所有的缓冲液体系均可用于ITC实验,但是滴定物的稀释热量或对照热量及滴定物与被滴定物的缓冲液体系是否匹配对ITC实验的成功与否起到至关重要的作用.当滴定物被滴定到样品池中的缓冲液中混匀后,就会产生结合热之外的其他热量,称为稀释热量或对照热量.一个ITC实验成功的关键就是要尽量减小对照热量,使得结合热量能够被测定得更加准确.如果对照热量非常小且恒定,先用滴定样品的数据扣除平均对照热量,之后就可以进行曲线拟合以获得结合参数.造成对照热过大有两个主要原因,一个是滴定物与样品池中的大分子样品缓冲液不匹配;另一个是过高的滴定物浓度.最常见的缓冲液不匹配是由滴定物和大分子溶液pH值的差异造成的.对于不匹配的滴定物与被滴定物,样品制备的关键就是通过透析或凝胶过滤进行缓冲液置换,以确保滴定物和被滴定物的溶液完全匹配才能保证稀释热完全合格[3].
拟南芥中控制根毛发生的关键蛋白包括CAPRICE(CPC)和GLABRA3(GL3),当CPC与GL3互作形成蛋白质复合体时,抑制下游基因GLABRA2(GL2)表达,促进表皮细胞发育为根毛细胞[4].虽然已经有酵母双杂交结果证明CPC蛋白和GL3蛋白会发生相互作用[5],但是与其它检测体外蛋白相互作用的实验方法一样也存在着假阳性结果的可能.等温滴定量热技术灵敏度高,适用范围广,测定结果更加精确可靠,目前已被作为测量分子之间相互作用的“黄金标准”[6].本研究通过大肠杆菌原核表达、分离纯化,得到了溶解在咪唑缓冲液中的蛋白质样品CPC和溶解在还原型谷胱甘肽缓冲液中的蛋白质样品GL3,在进行ITC滴定之前进行磷酸缓冲液置换使得滴定物与被滴定物缓冲液匹配,获得了准确的蛋白质相互作用实验结果.为今后利用等温滴定量热仪研究蛋白相互作用提供了理论依据.
1 实验材料和方法
1.1 实验材料及仪器
透析膜(型号 66012,美国赛默飞世尔科技公司),台式全温振荡器(THZ-C-1,苏州培英实验设备有限公司),多用途高速冷冻离心机(1580R,中国香港基因有限公司),高速冷冻离心机(CR22G Ⅲ,日本日立集团),超声波细胞粉碎机(JY92-2D,宁波新芝生物科技股份有限公司),紫外/可见光分光光度计(Ultrospec 3100pro,美国GE公司),马尔文微量热等温滴定量热仪(MicroCal iTC200,英国马尔文仪器有限公司).
1.2 原核蛋白表达和纯化
CPC蛋白的表达和纯化:将含有CPC-His融合蛋白的大肠杆菌(pET-28a载体BL21感受态,北京全式金生物技术有限公司)培养在含有50 g/mL 卡那霉素的Luria-Bertani(LB)培养基中,置于37℃,200 转/min,摇床中孵育,培养至光密度(OD)值为一定值时,即OD600 nm=0.6~0.8时,加入1 mmol/L 的异丙基-β-D-硫代半乳糖苷(IPTG),37℃诱导 5 h.将菌液离心,破碎后与Ni-NTA混合于4℃结合4 h,将混合液倒入重力柱中,先用低浓度50 mmol/L咪唑溶液洗去非特异性结合的蛋白,后用高浓度300 mmol/L 咪唑溶液洗脱并收集目标蛋白.
GL3蛋白的获取方法:将含有GL3-GST融合蛋白的大肠杆菌培养在含有50 g/mL 氨苄抗生素的LB培养基中,置于37℃,200 转/min的摇床中培养至OD600 nm=0.6~0.8时,加入1 mmol/L的IPTG,换至16℃诱导10 h.将菌液离心,破碎后与谷胱甘肽琼脂糖珠子混合于4℃结合4 h,将混合液倒入重力柱中,先用2 mmol/L还原性谷胱甘肽溶液洗去非特异性结合的蛋白,然后用10 mmol/L 还原性谷胱甘肽溶液洗脱并收集目标蛋白.
1.3 蛋白质透析
利用透析袋对两种不同的蛋白质进行透析来置换成相同浓度的磷酸缓冲液(PBS)体系.将纯化得到的CPC-His和GL3-GST分别放于截留分子量为 5 000和20 000的透析袋中,将透析袋分别放于相同浓度的PBS缓冲液(pH 7.4)中,在4℃进行静置透析10 h.
1.4 蛋白质浓缩
将装有透析样品的透析袋放于4℃,把PEG 20 000均匀铺洒在透析袋上进行蛋白质浓缩.
1.5 等温滴定实验
将未透析或透析后的样品放在等温滴定量热仪iTC200的滴定针中,将缓冲液放于样品池中,温度设定为25℃.除第1滴溶液的滴定体积为0.4 μL,其余19滴分别为每150 sec滴定2 μL体积.
1.6 数据处理
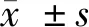
2 实验结果
2.1 仪器稳定性测量
使用超纯水滴定超纯水进行仪器性能稳定性测试,参考功率设定为 5 μW,仪器稳定性结果如图1所示.基线漂移从5.06~5.11 μW,符合(5.0±0.5)μW的要求.最大幅度为第12滴,约0.05 μW,小于0.05~0.06μW的要求.实验结果显示,每一滴水滴清晰,滴定质量好,样品池清洁,仪器性能好,可以进行后续实验.
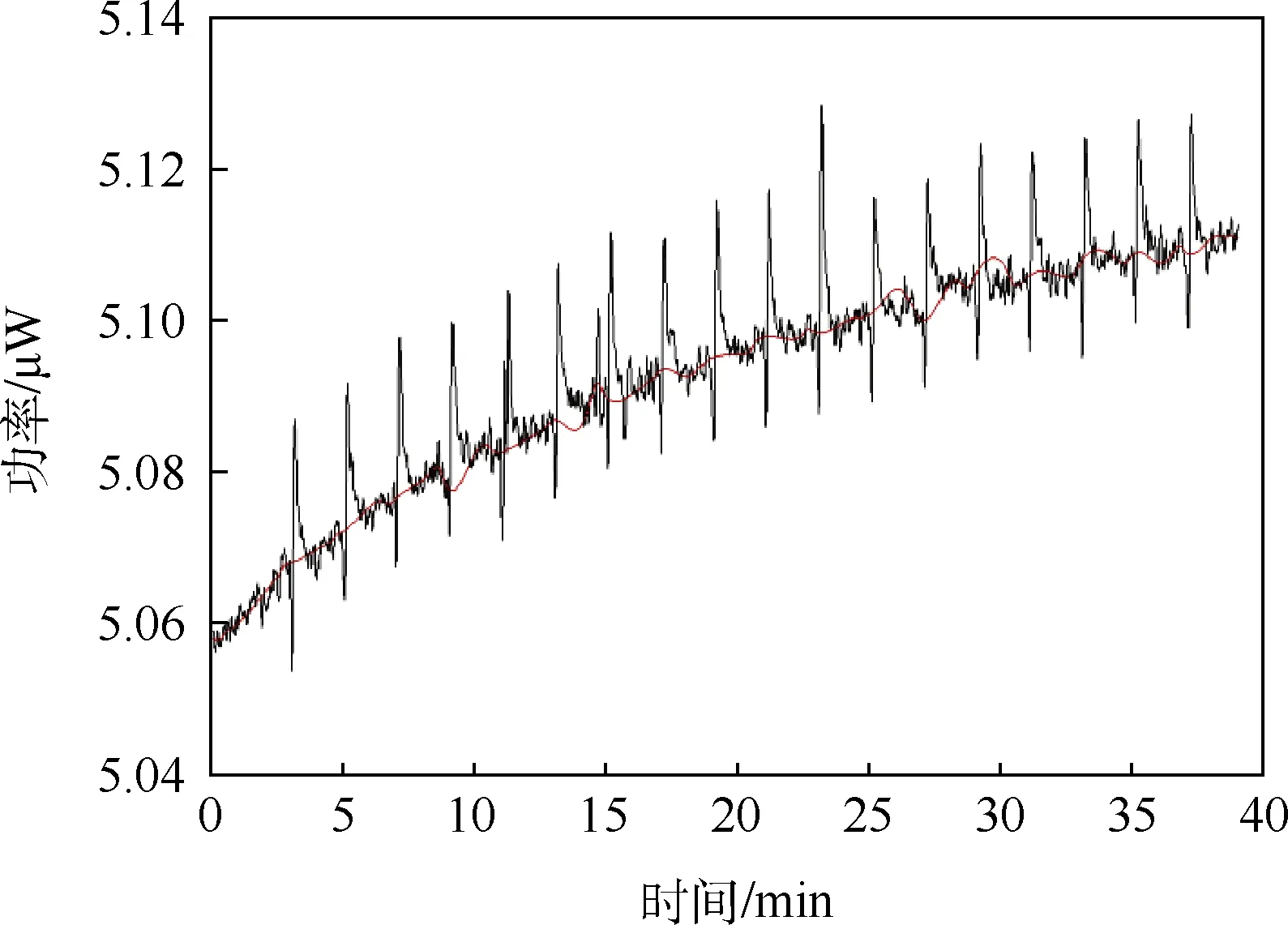
图1 水滴水实验结果
2.2 CPC蛋白质样品透析优化
为了确定样品溶液对蛋白质相互作用是否有影响,分别对未透析样品和透析样品进行滴定过程释放热量进行测量.透析样品前处理过程是将CPC蛋白样品在PBS缓冲液中进行透析.磁力搅拌虽会增加透析速度减少透析时间,但是也会造成CPC蛋白发生沉淀.由于ITC技术只适用于检测液体样本,沉淀样本无法利用ITC进行检测,因此,本研究透析过程采用静置透析.
用未透析 CPC蛋白溶液滴定PBS缓冲液,滴定过程释放的热量值如图2所示.实验结果显示,滴定过程首先发生的是一个明显的放热反应,最大幅度为第2滴,为22.5 μW,远远大于0.2 μW稀释热的合格标准(对应的积分面积为-335.4 μW.sec).之后在第8、9滴反应趋于饱和,继而转化为一个幅度基本相同的吸热反应,幅度约为1.25 μW,>0.2 μW稀释热的合格标准,直到第20滴(对应的积分面积为14.48 μW.sec).

图2 未透析CPC蛋白质样品滴定反应热量释放
未透析CPC蛋白质样品滴定摩尔ΔH如图3所示,结果显示滴定针中的蛋白质样品和样品池中的缓冲液发生了明显的相互作用,造成过高的对照热量(稀释热),这是由于滴定针中的蛋白质样品溶解在咪唑溶液中,与样品池中的PBS缓冲液不匹配造成的.
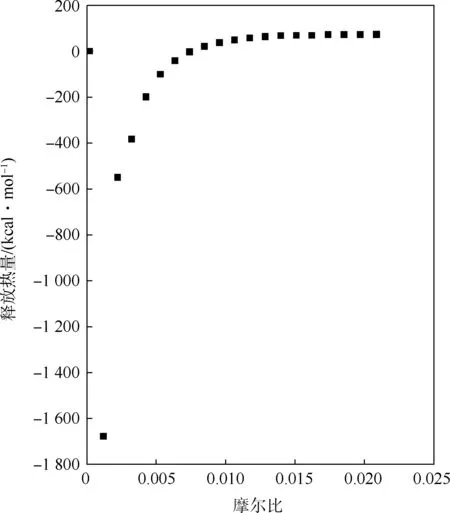
图3 未透析CPC蛋白质样品滴定摩尔焓变
透析后CPC蛋白质样品滴定PBS缓冲液,透析后CPC蛋白质样品滴定反应热量释放如图4所示.最大幅度为第3滴,约0.11 μW;第19滴幅度最小,约为0.05 μW,<0.2 μW稀释热的标准,且全部20滴的双向正负峰一致.

图4 透析后CPC蛋白质样品滴定反应热量释放
透析后CPC蛋白质样品滴定摩尔ΔH如图5所示,结果显示绝对热量变化很低.因此,透析样品能够提高ITC测定结果的可靠性.
图5 透析后CPC蛋白质样品滴定摩尔焓变
2.3 GL3蛋白质透析前后滴定PBS缓冲液
用未透析GL3蛋白质溶液滴定PBS缓冲液,滴定过程释放的热量值如图6所示.实验结果显示,滴定过程发生的是一个明显的放热反应,最大幅度为第2滴,为35 μW,远远大于0.2 μW稀释热的合格标准(对应的积分面积为-539.5 μW.sec),反应在最后几滴(18~20)趋于饱和(第20滴对应的峰面积为-10.2μW.sec).和放热反应同时存在的是一个较小的吸热反应,反应最大幅度在第2滴,为1.25 μW,>0.2 μW稀释热的合格标准,在第9滴反应趋于饱和.

图6 未透析GL3蛋白质样品滴定反应热量释放
未透析GL3蛋白质样品滴定摩尔ΔH如图7所示,结果均表明滴定针中的蛋白质样品和样品池中的缓冲液发生了明显的相互作用,造成过高的对照热量(稀释热),这是由于滴定针中的蛋白质样品与样品池中的PBS缓冲液不匹配造成的.

图7 未透析GL3蛋白质样品滴定摩尔焓变
然后采用CPC蛋白质透析成功的方法对GL3蛋白质进行透析.不使用磁力搅拌器,使透析缓和,防止过度透析产生沉淀;使静置时间延长从而延缓整个透析时间.这样透析后的GL3蛋白质样品很均一,未发生沉淀,其滴定PBS缓冲液相关热量释放结果如图8所示.实验结果显示,滴定过程发生的是一个放热反应,最大幅度第3滴为2.05 μW,>0.2 μW 稀释热的合格标准,第20滴幅度最小,为1.0 μW.虽然较未透析的GL3蛋白质稀释热有非常明显的改善,反应最终也未达到饱和,说明透析产生一定的效果,但原始滴定曲线仍体现出滴定针中的蛋白质样品和样品池中的缓冲液有一定的相互作用的趋势,整个反应高于稀释热的标准,说明此种适用于类CPC蛋白质透析的方法并不适用于GL3蛋白质.这是由于透析不彻底导致的.
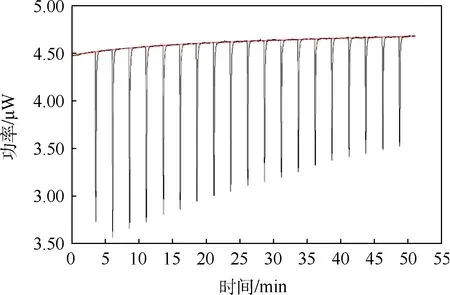
图8 透析中GL3蛋白质样品滴定反应热量释放
为了获得可靠的滴定结果,本研究改变了对GL3蛋白质透析方法.在GL3蛋白质透析过程中使用磁力搅拌器进行透析,透析过程中未发生沉淀现象,获得了均一稳定的GL3蛋白质.透析后GL3蛋白质样品滴定PBS缓冲液,相关热量释放结果如图9 所示.最大幅度为第二滴,<0.05 μW,接近水滴水,<0.2 μW 稀释热的标准.此结果说明透析完全合格,此种透析方式适用于GL3蛋白质.
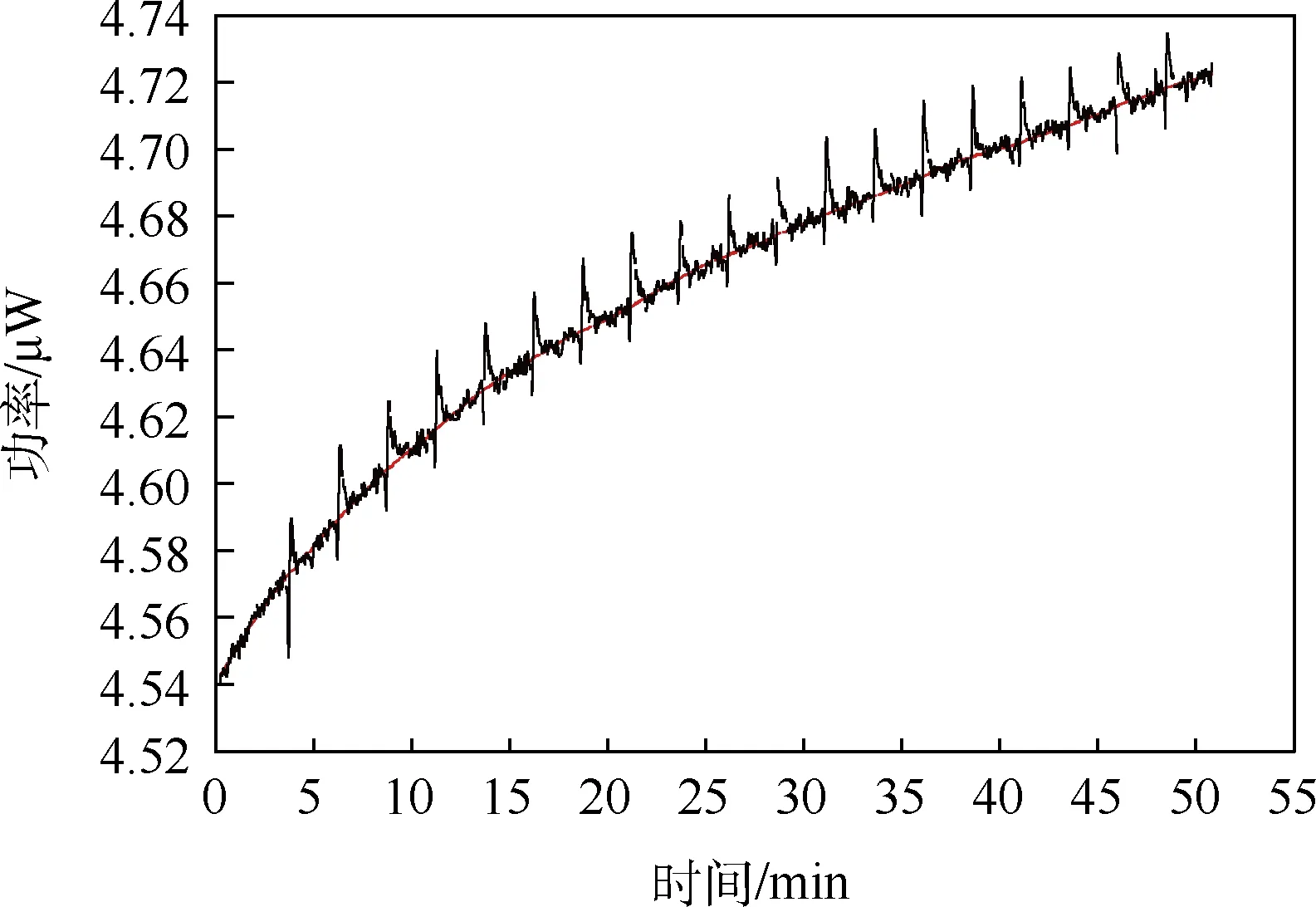
图9 透析后GL3蛋白质样品滴定反应热量释放图
2.4 透析后CPC与GL3蛋白质相互作用测量
使用透析后浓度为68 μmol/L的GL3蛋白质溶液滴定浓度为22 μmol/L的CPC蛋白质溶液.该滴定反应以放热成分为主,由于释放热量仅为微瓦(μW)级别,不会造成蛋白质样品变性.点对点扣减背景数据后,采用顺序结合模型进行拟合.当结合位点数为2时,拟合曲线及结果合理.由热动力学结果可知,在PBS缓冲液中,透析后的GL3和CPC这两个蛋白质至少存在两个结合位点并很可能是以顺序结合的方式相互作用.第1个和第2个结合位点的解离平衡常数Kd分别为(3.2±0.2)和(16.7±0.9)μmol/L,由此可以初步判断:在第1个结合位点两个蛋白质相互作用的亲和力高于第2个结合位点.由等温滴定量热技术所测定出的ΔH及ΔS的绝对数值不一定准确,但其正负符号是准确的.从ΔH和ΔS的结果来看,二者都是由焓驱动的过程(ΔH<0),都发生了不利的熵的补偿效应(ΔS<0).具体来看,第1个和第2个结合位点的ΔH分别为(-160.3±1.1)和(-566.3±18.2) kcal/mol,ΔH<0表明在两个蛋白质之间可能形成了氢键、离子键、范德华力等非共价键,这些因素都是有利于GL3和CPC这两个蛋白质结合的.第1个和第2个结合位点的-TΔS分别为152.7和560.5 kcal/mol,其中T为开尔文温度(T=273.15+反应温度,此处ITC实验反应温度为25℃).-TΔS>0,由此可知ΔS<0,这表明在两个蛋白结合过程中,某个蛋白质很有可能还发生了构像变化,这会使得分子的自由度下降,是不利于GL3和CPC两个蛋白质结合的因素.由以上测定结果初步判断GL3和CPC蛋白有两个结合位点.该结果与已发表的研究结果相比更加精确,已有研究只是报道CPC蛋白和GL3蛋白间有相互作用,而没有报道有几个相互作用位点.
3 讨 论
ITC是研究分子间相互作用的一种可靠方法[7].ITC研究一个经典的应用就是在结构信息已经明确的情况下,研究体现广阔生物学功能的蛋白质和配体相互作用的结构和热动力学之间潜在的关系.这对于理解生物分子相互作用及优化配体结合的亲和力都非常重要.此外,ITC能够提供精确的结合热动力学,因此特别适用于药物设计,能够优化药物及靶点的相互作用,促进发展潜在性新型有效药物用于未来临床应用.
对于一个完整的等温滴定量热实验,从样品制备到滴定实验受很多因素的影响,其中缓冲液体系的匹配就是影响因素之一.ITC实验要求滴定物与被滴定物的缓冲液体系必须匹配,包括缓冲液的成分,pH值及盐浓度等.极其微小的pH值,NaCl盐浓度的差异,会导致极大的背景噪音热信号,即稀释热,从而干扰分子间相互作用的特异性信号.对缓冲液不匹配的两种蛋白质可以通过透析的方式进行缓冲液置换[8].
本研究采用拟南芥中两种不同类型的蛋白质,CPC蛋白和GL3蛋白,进行不同方式的透析,利用ITC分别检测不同处理的样品分子的稀释热,结果表明对不同类型的蛋白质需要采用不同的透析方法才能达到最佳的效果,最大程度地减少噪音.对于小分子量蛋白宜采用缓慢透析的方法透析防止透析过度,而对于分子量比较大的蛋白宜采用快速透析的方法透析防止透析不彻底.通过ITC初步判断GL3和CPC蛋白质有两个相互作用结合位点.已有研究只是报道CPC蛋白和GL3蛋白间有相互作用,而没有报道有几个相互作用位点,该结果与已有的研究结果相比更加精确.
ITC是一种可靠的、快速检测蛋白之间相互作用的技术手段.对应用该技术方法的优化为今后检测蛋白质间相互作用提供了坚实的理论依据.
