白酒杂醇油酯化酶的分子构建
2019-06-11张瑞瑞
张瑞瑞
(湖北工业大学 马克思主义学院 湖北省非物质文化遗产研究中心,湖北 武汉 430068)
杂醇油是指除乙醇外含有≥3个碳原子的一元醇的总称,在白酒中含量较大的为正丙醇、异丁醇和异戊醇[1]。α-酮酸经埃里希途径(Ehrlich)和合成代谢途径(Harris)形成高级醇[2]。
白酒中过高的杂醇油含量,对人体有毒害作用,造成神经系统充血,使人感觉头痛[3]。杂醇油也是造成白酒苦味、涩味和浑浊的原因。降低白酒中的杂醇油含量,是提升白酒品质的重要措施之一。
国内外降低杂醇油的含量研究主要集中于原料和酒曲的优选[4-5],发酵工艺的调整[6-9],白酒酒体的过滤等。采用对酒体的过滤去除白酒中杂醇油的含量,虽有一定效果,但是工艺复杂[10-12],而且不可避免的会对酒体的口感产生影响。现在白酒酿造的原料和酒曲都是精选后的原料和酒曲,而且每种白酒的酿造原料和酒曲都有其特定要求,可供选择的优质原料和酒曲的种类有限。在工业化生产的规模下,发酵不同批次或同一批次的不同发酵槽或发酵罐都不可避免的存在细微差异,更精细调控发酵工艺从而降低杂醇油含量的挑战性较大。
酯化酶能高效酯化醇和酸形成酯。正丙醇的沸点为97℃,乙酸正丙酯的沸点为101.6℃[13];异戊醇的沸点为131.04℃,乙酸异戊酯的沸点为142.06℃[14];异丁醇沸点为106.94℃,乙酸异丁酯沸点为116.75℃[15]。酯化酶的酯化具有高效和专一性的特点,利用酯化酶酯化杂醇油成酯,杂醇油被酯化为酯后,沸点升高,分子质量变大。更大的分子质量和更高沸点的酯类物质在蒸馏时,从酒醅蒸馏出进入酒体的量会大大降低。基因工程改造技术能够得到酯化特定醇的酯化酶,能够降低白酒中杂醇油的含量,提升白酒品质;也可以运用于酒头或酒尾的处理,生产香味酯,将资源合理的利用。杂醇油形成的酯类具有一定果香味,因此,杂醇油酯化酶可以应用于果香味香料的绿色化生产[16]。因此,通过构建高效酯化杂醇油的酯化酶,在酒醅中添加酯化酶高效酯化杂醇油为相对应的酯类,从而大幅度降低白酒中杂醇油的含量是一个新颖可行便捷的措施,形成的杂醇油的酯类还能丰富酒体中酯的种类,增加酒体口感饱满度。
目前,酿酒酯化酶的报道关注于乙醇为底物的酯化酶[17-18],例如生产乙酸乙酯、己酸乙酯的酯化酶、乳酸乙酯等酯化酶以及肉桂醇[19]、苯酚等为底物的酯化酶[20],对酿酒酯化酶的研究主要集中于主要酯类风味物质酯化的酶。检索PDB数据库和酯化酶的相关文献,对以杂醇油为底物的酯化酶和杂醇油酯化高活性酶的构建鲜有报道。
本研究采用逆转录-聚合酶链式反应(reverse transcription-polymerase chain reaction,RT-PCR)扩增酯化酶基因,易错聚合酶链式反应(error-prone PCR)方法突变酯化酶基因,检测酶活筛选出高效酯化杂醇油的酯化酶。杂醇油酯化酶的构建不仅对提升白酒的保健品质具有重要的意义,而且对绿色生产具有果香味的酯类具有重要的实际应用意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
产酯化酶近平滑假丝酵母(Candida parapsilosis):本实验室从深海沉积物中选育;大肠杆菌(Escherichiacoli)BL21、质粒pET28a(+):国家典型培养物保藏中心(national type culture collection,NTCC)-BioVector质粒载体菌株细胞基因保藏中心。
1.1.2 化学试剂
乙酸正戊酯、乙酸正丙酯、乙酸异丁酯、乙酸异戊酯及乙醇(均为色谱纯):阿拉丁控股集团有限公司;分子试剂盒:天根生化科技有限公司;EcoR I限制性内切酶(10 U/mL)、Xho I限制性内切酶(10 U/mL):宝日医生物技术(北京)有限公司。D2500-01琼脂糖凝胶回收试剂盒:北京索莱宝科技有限公司。
1.1.3 培养基
LB液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L,调pH至7.0,用去离子水定容至1 L。在121℃条件下灭菌15 min。固体培养基中加入20 g/L琼脂。
1.2 仪器与设备
ZHJH-C1214B超净工作台:上海智城分析仪器有限公司;FE20型pH计:梅特勒-托利多仪器有限公司;AR1140电子分析天平:奥克斯国际贸易有限公司;PHX智能生化恒温培养箱:宁波莱福科技有限公司;C100 PCR仪、PowerPac电泳仪:美国Bio-Rad公司;7890A气相色谱(gas chromatography,GC)仪:美国安捷伦公司;程序控制超声波细胞粉碎机HN-1000CS:上海汗诺仪器有限公司。
1.3 方法
1.3.1 基因克隆
克隆Candida parapsilosis的酯化酶,编码基因的碱基长度均为1 398 bp,用RT-PCR方法克隆[21]。引物序列:lip1F-1(5"→3"):CCGGAATTCATGCATTTTTGGTT CCTATCCA;lip1R-1(5"→3"):TTGAATCTCATACATTTTCACATT CTCGAGCGG。下划线部分为酶切位点。
1.3.2 质粒构建
将反转录获取的PCR产物脂肪酶(lipase)及提取的空载质粒pET28a(+)分别进行双酶切,再以T4 DNA连接酶于16℃条件下连接过夜。重组质粒以化学转化法导入Escherichia coli DH5α,涂布卡那霉素抗性平板,37℃培养得到含目的基因的亚克隆菌株。单菌落进行聚合酶链反应(PCR)扩增产物测序,验证构建的质粒序列。
1.3.3 易错PCR
根据已知的基因序列,利用引物设计软件Primer 5.0设计一对特异引物,引物序列:E-lip1F(5"→3"):GGAATTC ATGCACTTTTGGTTCT;E-lip1R(5"→3"):ATGCAGTTCCAAATTCTCGAGCGG。
使用含有初始酯化酶的质粒作为易错PCR的模板。以即用型易错PCR试剂盒进行易错PCR。获得的目的条带以胶回收试剂盒回收,储存于-20℃备用。易错PCR的PCR程序:94℃变性3min;94℃变性30s,62℃退火30 s,72℃延伸2 min,退火温度每个循环下降0.5℃,循环11次。然后94℃变性30 s,56.5 ℃退火30 s,72 ℃延伸2 min,循环19次。
利用琼脂糖胶回收试剂盒回收纯化扩增产物,回收纯化的易错PCR酯化酶产物进行琼脂糖凝胶电泳。
1.3.4 转化和筛选
回收的易错PCR产物及空载质粒pET28a(+)分别进行EcoR I限制性内切酶和Xho I限制性内切酶双酶切,酶切结束后纯化,进行T4 DNA酶连接。获得的突变重组质粒以电转化法导入Escherichia coli BL21,转化后涂布卡那抗性LB平板,挑选单菌落。将挑取出的单菌落接种于LB液体培养基,37℃培养6h,加入异丙基-β-D-硫代半乳糖苷(isopropyl-beta-D-thiogalactoside,IPTG)诱导培养20 h后进行酶活检测,检测酯化杂醇油的酶活,活性高的为筛选的转化子。
1.3.5 测序
提取酶活提高的转化子的质粒,以pET28a(+)通用测序引物进行PCR产物扩增。产物进行测序,以DNAMAN软件进行序列的比对及翻译,得到突变的编码序列及氨基酸序列。
1.3.6 诱导表达和酯化酶酶液制备
挑取出的大肠杆菌(Escherichia coli)单菌落接种于LB液体培养基,37℃培养6 h,加入IPTG诱导培养20 h。培养的菌液用超声波细胞粉碎机120 W条件下超声3 s,停10 s,超声破碎2.0 min。破碎的菌液5 000 r/min离心10 min,上清液为酯化酶酶液,进行3种醇的混合酯化以检测酶活。
1.3.7 分析检测
酯化酶酶活测定的酯化体系为:杂醇油含量(正丙醇、异丁醇、异戊醇)各1%;乙酸2%;酯化酶酶液50%;蒸馏水46%。先加水、杂醇油及乙酸,再加入酶液。且在加入粗酶液前,以200 g/L的NaOH溶液将体系pH调至3.5。粗酶液均做2组酯化体系,其中1组为试验组,1组为对照组。对照组为将酶液以等量的未诱导菌株酶液代替。酯化体系配制完毕后,放置于30℃、200 r/min恒温摇床中酯化1 d。酯化酶的定义为:24 h酯化合成1.0 mg/L酯所需的酶量为一个酶活单位(U/L)。
采用气相色谱法测定酯化产物中酯含量[22-23]。以出峰时间定性,以峰面积定量。
2 结果与分析
2.1 Candida parapsilosis酯化酶基因扩增
重组质粒构建成功后,亚克隆于DH5α菌株中,以pET28a(+)质粒测序通用引物进行菌落原位PCR扩增,电泳检测后测序,结果见图1。由图1可知,菌落原位PCR扩增出的碱基大小约为1 400 bp,与预期大小一致。产物测序结果与设计的序列一致。

图1 酯化酶大肠杆菌BL21原位菌落PCR扩增产物电泳图Fig.1 Electrophoresis of in situ PCR amplification product of Escherichia coli BL21
2.2 杂醇油酯化酶易错PCR
易错PCR扩增产物琼脂糖凝胶电泳,结果见图2a。由图2a可知,通过梯度降度PCR(touch down-PCR,TD-PCR)程序,该易错PCR的特异性极好,且目的条带的大小与预期的一致。易错PCR产物胶回收纯化,纯化的易错PCR产物进行琼脂糖凝胶电泳,结果见图2b。由图2b可知,纯化后弥散带消失。单一的目的条带有利于高效酶切和高效与酶切的质粒连接。
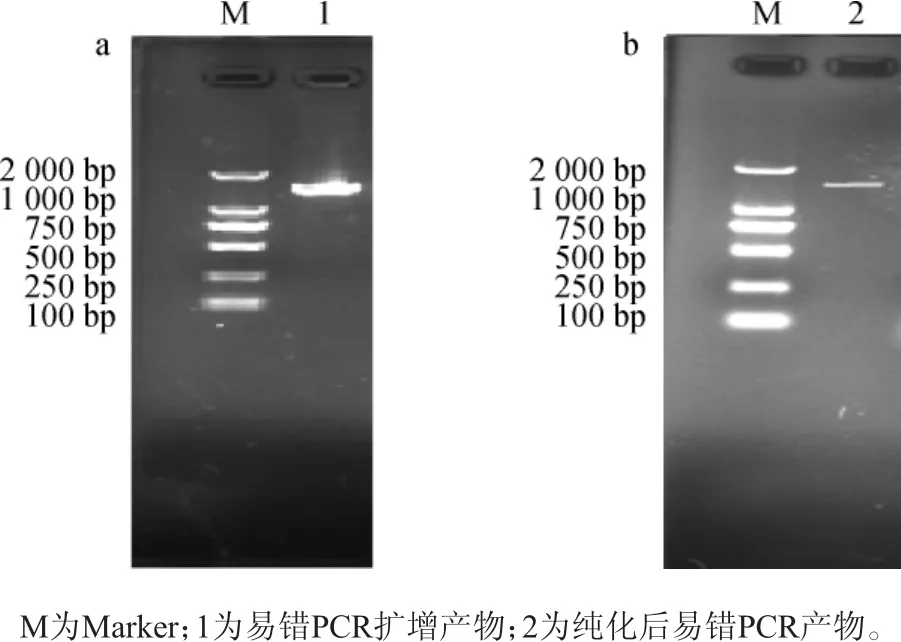
图2 易错PCR扩增产物(a)、易错PCR产物切胶纯化片段及收获片段(b)电泳图Fig.2 Electrophoresis of error-prone PCR amplification products(a)and purified and harvested fragment of error-prone PCR product by cutting gel(b)
2.3 筛选转化子产生的酯化酶的酯化性能
以空载质粒E.coli BL21酶液为空白对照,Candida parapsilosis酯化酶作为初始酯化酶。初始酯化酶在大肠杆菌(Escherichiacoli)BL21表达得的酯化酶活性为:乙酸正丙酯10.828U/L;乙酸异丁酯2.579 U/L;乙酸异戊酯3.82 U/L。
初始酯化酶经过多次易错PCR,以及PCR产物酶切,连接质粒,转化筛选,获得1株杂醇油酯化能力显著突变菌株L1-70,其酯化酶催化活性测定结果见表1。由表1可知,菌株L1-70对正丙醇、异丁醇及异戊醇均有酯化作用,酯化酶酶活分别是初始酯化酶酶活的2.28倍、2.42倍及2.29倍。已有报道的酯化酶的研究主要为以乙醇为底物的酶[17-19],构建的杂醇油酯化酶能高效酯化非乙醇的高级醇。酯化酶对杂醇油酯化能力的提高主要原因是氨基酸序列的改变导致的酯化酶三维结构的改变[24],三维结构的改变可能导致了结合部位或催化部位的改变,从而更有利于杂醇油、乙酸和酶形成复合物,进而形成乙酸正丙酯、乙酸异丁酯、乙酸异戊酯。

表1 初始酯化酶与构建酯化酶的酶活对比Table 1 Comparison of the original esterase and the constructed esterase activities
2.4 高活性杂醇油酯化酶的氨基酸序列
对正向突变菌株L1-70测序,再以分析软件进行比对,结果见图3。由图3可知,L1-70突变的碱基为3个,突变的氨基酸也为3个,分别为V146D:146位缬氨酸突变为天冬氨酸;T198I:198位苏氨酸突变为异亮氨酸;E376K:376位谷氨酸突变为赖氨酸。酶的氨基酸突变能够提高酶活,可能的原因是氨基酸序列突变后,造成酶整体结构或局部结构的变化,而结构变化的结果可能导致底物更容易进入到酶的结合部位,从而更容易在结合部位结合,并在催化部位作用下相互缩合成酯。酶催化活性提高的原因也可能是氨基酸序列改变后,造成酶表面电荷的变化,表面电荷的变化更有利于酶催化合成酯。酶结构的改变也可能赋予了酯化酶更好的热稳定性,因而提高了酶的活性[25]。

图3 突变菌株L1-70与原始菌株酯化酶的氨基酸序列比对Fig.3 Amino acid sequence alignment of lipase of mutant strain L1-70 and original strain
3 结论
本研究通过RT-PCR扩增出酯化酶基因,易错PCR构建出高效酯化杂醇油的酯化酶。构建酯化酶的乙酸正丙酯、乙酸异丁酯、乙酸异戌酯酶活分别是初始酯化酶酶活的2.28倍、2.42倍、2.29倍。构建的高效杂醇油酯化酶在酿酒行业具有重要的实际应用意义。解析酶的晶体结构,分子对接研究杂醇油高效酯化酶的分子动力学等是进一步研究的方向。
