镰形扇头蜱卵巢中丝氨酸蛋白酶抑制分子群的克隆和生物信息学分析
2019-06-11许正茂周勇志张厚双龚海燕巴音查汗周金林
许正茂,周勇志,曹 杰,张厚双,龚海燕,巴音查汗,周金林
(1.新疆农业大学动物医学学院,乌鲁木齐 830052;2.中国农业科学院上海兽医研究所,上海 200241)
蜱是专性吸血的外寄生虫,侵袭人,可寄生于哺乳类、鸟类、爬行类、两栖类等动物。蜱被认为是非常重要的医学媒介昆虫,是仅次于蚊子的第二大传播媒介节肢动物,可以传播多种细菌病、病毒病、原虫病等疾病,严重影响动物和人类的健康,在兽医和公共卫生方面具有重要意义。
丝氨酸蛋白酶抑制分子(serine protease inhibitor,Serpin)是种类最多的蛋白酶抑制剂超家族,分为抑制型和非抑制型两大类[1]。典型的Serpin是由350~500个氨基酸的单链蛋白、3个β折叠(A、B和C)、8~9个α螺旋构成一个保守的蛋白主体以及一个暴露在主体外的反应中心环RCL(reactive center loop)组成。Serpin使用独特的自杀底物机理,与靶酶形成极为稳定的共价复合物,靶酶活性被不可逆抑制。具有抑制活性的Serpin是亚稳态蛋白,一旦与靶酶发生反应后,Serpin的构象会发生显著变化,多余的能量被释放,这种变化通常称为“紧绷-松弛”(stressed to relaxed,S to R)机理[2-5]。大部分Serpin都表现出蛋白酶抑制剂活性,在多种生理过程中发挥作用,包括食物消化、血液凝固、免疫应答、炎症反应等,部分人类Serpin还具有转运激素、分子伴侣和肿瘤抑制功能[6]。对一些节肢动物Serpin的研究表明,他们在调节内源性蛋白酶平衡、先天性免疫反应、病原体传播、发育和繁殖上具有重要作用[7-8]。鉴于Serpin在蜱体内的广泛分布,在调节生命活动和病原体传播过程中的重要作用以及对宿主免疫应答的影响,本研究对镰形扇头蜱卵巢组织转录组数据库中发现的10个Serpin基因(Rhipicephalus haemaphysaloidesSerpin,RhS)进行克隆,分析其编码的蛋白质理化性质、结构特征,为进一步研究Serpin基因的功能以及抗蜱疫苗的研究提供依据。
1 材料与方法
1.1 材料
1.1.1 蜱种和实验动物 镰形扇头蜱由中国农业科学院上海兽医研究所动物原虫病团队繁殖保种;成年健康新西兰大白兔,雌性,清洁级,购自上海杰思捷实验动物有限公司。
1.1.2 主要试剂 2× Super HiFi PCR Mix(KT212)、琼脂糖凝胶DNA回收试剂盒(DP209)均为天根生化科技(北京)有限公司产品;TRIzol试剂(Cat. No.15596-018)为Invitrogen公司产品;DNA A-Tailing Kit(Code No.6019)、PrimeScript RT reagent Kit with gDNA Eraser(Code No.RR047A)、E.coliDH5α Competent Cells(Code No.9057)均为TaKaRa公司产品。
1.2 方法
1.2.1 蜱的繁殖培养 耳袋法接种镰形扇头蜱成蜱并繁殖后代,于25℃、相对湿度95%的生化培养箱中培养。
1.2.2 组织分离与RNA提取和反转录 镰形扇头蜱雌性成蜱饱血后,体视显微镜下解剖出卵巢组织,根据Invitrogen TRIzol试剂说明书提取卵巢组织总RNA,使用Nanovue超微量分光光度计检测RNA的浓度及纯度。根据TaKaRa反转录试剂盒说明书进行cDNA的合成:去除gDNA,1 μg RNA中加入5× gDNA eraser buffer 2 μL,gDNA eraser 1 μL,用ddH2O将总体积补至10 μL,混匀后42℃反应2 min;向已去除DNA的样品中加入PrimeScript RT enzyme mixⅠ 1 μL、RT primer mix 1 μL,5×PrimeScript buffer 4 μL、RNase free dH2O 4 μL,混匀后37℃反应15 min,85℃反应5 s。
1.2.3 卵巢转录组数据库构建 构建卵巢组织RNA文库,然后使用Agilent 2100 Bioanalyzer和ABI StepOnePlus real-time PCR system质检,合格后使用Illumina HiSeq 4000进行测序,测序所得数据称为raw reads。首先,过滤掉低质量、接头污染以及未知碱基N含量过高的reads,过滤后的数据称为clean reads。然后对clean reads进行组装得到Unigene,对其进行SSR检测、功能注释。NT、NR、GO、COG、KEGG、SwissProt 以及 InterPro都属于功能性数据库。使用Blast对Unigene进行NT、NR、COG、KEGG以及SwissProt注释;使用Blast2GO以及NR注释结果进行GO注释;使用InterProScan5进行InterPro注释。根据功能注释结果,按照NR、SwissProt、KEGG、COG的数据库优先顺序,挑选Unigene的最佳比对片段作为该Unigene的CDS,以5→3的方向存储为FASTA格式。未能注释上的Unigene使用上一步预测的 CDS 作为模型进行建模,然后使用ESTScan进行预测。
1.2.4 引物设计与合成 根据卵巢转录组数据库查找的Serpin家族基因,通过NC(https://www.ncbi.nlm.nih.gov/orffinder/)查找其开放阅读框(open reading frame,ORF),设计特异性引物扩增ORF区,引物序列由上海华津生物科技有限公司合成。引物序列见表1。
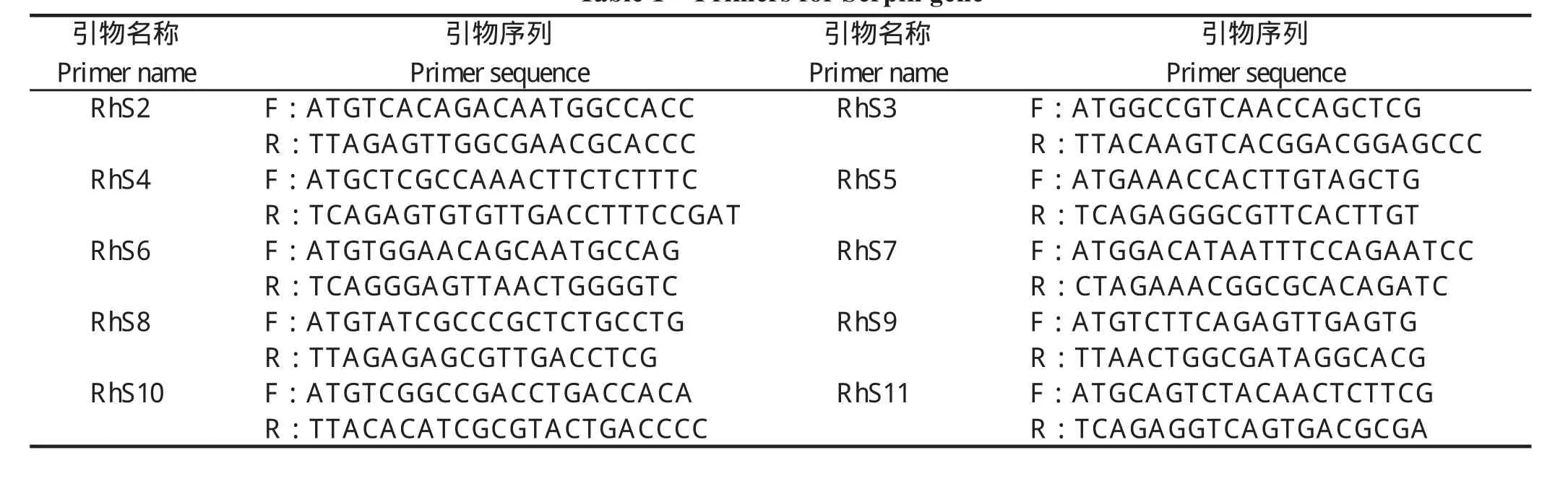
表 1 Serpin 基因引物设计Table 1 Primers for Serpin gene
1.2.5 Serpin基因的扩增 以卵巢cDNA为模板,PCR管中加入2× super HiFi PCR mix 25 μL、上游引物1.25 μL、下游引物1.25 μL、cDNA 1 μL、ddH2O 21.5 μL,混匀后进行PCR反应。PCR反应条件:94℃预变性3 min;98℃变性10 s,58℃~60℃退火30 s,68℃延伸45 s,35个循环;68℃再延伸5 min。PCR反应结束后进行琼脂糖凝胶电泳,然后根据琼脂糖凝胶DNA回收试剂盒说明书进行目的片段胶回收。
1.2.6 pMD18-T连接和转化 根据TaKaRa的A尾试剂盒说明书在胶回收产物3'末端添加“A”尾,然后连接至pMD18-T载体。1 μL pMD18-T vector加入solution Ⅰ 5 μL、目的片段0.3 pmol,ddH2O补充总体积至10 μL,混匀后16℃反应30 min。最后将连接好的载体转至E. coliDH5α菌株中,菌体培养后进行测序。
1.2.7 生物信息学分析 使用NCBI网站BLAST(Basic Local Alignment and Search Tool)中的Blastx、Blastn和Blastp算法检测Serpin基因。使用ClustalX和Jalview软件分析氨基酸序列和序列比对;使用Signal4.1服务器(http://www.cbs.dtu.dk/services/SignalP/)预测信号肽;使用NetNGlyc 1.0 Server服务器(http://www.cbs.dtu.dk/services/NetNGlyc/)预测糖基化位点;使用Expasy服务器(https://www.expasy.org/)计算Serpin的理论分子量大小和等电点。
1.2.8 系统进化树分析 在NCBI的蛋白质数据库中检索Serpin家族蛋白序列,包括镰形扇头蜱丝氨酸蛋白酶抑制分子(R. haemaphysaloidesSerpin,RhS)、附尾扇头蜱丝氨酸蛋白酶抑制分子(R.appendiculatusSerpin,RaS)、微小扇头蜱丝氨酸蛋白酶抑制分子(R. microplusSerpin,RmS)、美洲钝眼蜱丝氨酸蛋白酶抑制分子(Amblyomma americanumSerpin,Lospin)、肩突硬蜱丝氨酸蛋白酶抑制分子(Ixodes scapularisSerpin,Ispin)和篦子硬蜱丝氨酸蛋白酶抑制分子(I. ricinusSerpin,IrS)。应用分子进化遗传分析软件MEGA 6.0对本研究所得的序列进行比对分析,统计氨基酸使用频率,采用Neighbor-joining法构建分子进化树,对空位采用完全删除(complete deletion),并用“bootstrap”1000次自举检测表明各分支的置信度。
1.2.9 RhS二级结构序列比对 首先使用Clustalx进行Serpin氨基酸序列比对,在PROTEIN DATA BANK服务器(http://www.rcsb.org/pdb/home/home.do)下载人α1-抗胰蛋白酶(human α1-antitrypsin,PDB 1HP7))空间结构文件,然后使用SEPript 3.0服务器(http://espript.ibcp.fr/ESPript/ESPript/index.php)以1HP7为参考模板,构建蛋白质二级结构比对图。
1.2.10 构建Serpin空间结构模型 首先使用SWISSMODEL服务器(https://swissmodel.expasy.org/)上传RhS氨基酸序列,进行蛋白质同源建模,然后使用PyMOL 2.0.6分析软件分析RCL区、β-sheet、α-helix等信息。
2 结果
2.1 卵巢转录组数据库和serpin分子群的发现 使用Illumina Hiseq平台一共测得40.29 Gb数据。组装并去冗余后得到51 106个Unigene,平均长度1496 bp,N50为3186 bp以及GC含量为50.44%。将Unigene与7大功能数据库进行比对注释,最终分别有25 901个(NR 50.68%)、16 710个(NT 32.70%)、21 123个(Swissprot 41.33%)、11 279个(COG 22.07%)、21 039个(KEGG 41.17%)、9267个(GO 18.13%)以及19 427个(Interpro 38.01%)个Unigene获得功能注释。根据注释结果共检测出25 845个CDS,未注释上的Unigene使用ESTScan预测后获得3865个CDS,同时还检测出11 760个SSR分布于8004个Unigene中。构建好的转录组数据库根据注释关键词“serine protease inhibitor”搜库,将符合关键词的序列在NCBI上进行Blast序列比对和ORF区查询,用于后续研究。
2.2 镰形扇头蜱Serpin基因克隆 通过镰形扇头蜱转录组数据库搜库和查找Serpin基因的ORF区,设计特异性引物进行PCR扩增,得到了10条Serpin家族基因序列(图 1),并进行了基因克隆。

图1 镰形扇头蜱Serpin基因的PCR扩增结果Fig. 1 PCR analysis of ten Serpin gene from R. haemaphysaloides
2.3 生物信息学分析结果 通过NCBI的Blastx、Blastp等在线分析工具对镰形扇头蜱的10条cDNA序列进行比对分析,结果显示10条基因序列属于Serpin超家族,都具有Serpin家族基因的保守结构域。使用Signal4.1、NetNGlyc 1.0 Server、Expasy等服务器分析Serpin基因的理化性质和特征,所有的RhS均有糖基化位点,RhS4、RhS5、RhS8和RhS11有信号肽(表 2)。

表 2 镰形扇头蜱Serpin家族基因序列特征Table 2 Polypeptide features of R. haemaphysaloides serpins sequences
2.4 Serpin基因活性中心环序列比对 通过NCBI的Conserved Domains等在线分析工具分析镰形扇头蜱10条Serpin基因的活性中心环(reactive center loop,RCL),然后通过ClustalX和Jalview比对氨基酸序列,发现10个Serpin都具有活性中心环,P1位置的氨基酸残基分别由不同的氨基酸组成(图 2)。

图2 镰形扇头蜱Serpin基因活性中心环序列比对Fig. 2 Sequence alignment of Rhipicephalus haemaphysaloides Serpin putative reactive center loops(RCL)
2.5 进化树分析 所有的RhS和其他蜱Serpin的氨基酸序列均用于分析蜱Serpin之间的系统发育关系。分析表明主要存在两个蜱的Serpin组:A组和B组。A组包含由A-E簇形成的潜在细胞内的Serpin;B组包含由F-H簇形成潜在的分泌Serpin。这8个系统聚类的自举值为A簇均为100%(图3)。
A组:A簇包含RhS2、RaS2和RmS2,这3个Serpin在RCL的P1位置显示Y(酪氨酸)残基,氨基酸序列相似度大于85%;B簇包含RhS3、RaS1、RmS11,他们在RCL的P1位置显示C(半胱氨酸)残基,RhS3与RmS11的序列相似度大于80%;C簇由RhS6和RmS8组成,序列相似度为88%,在RCL的P1位置显示G(甘氨酸)残基;D簇由RhS10和RmS18组成,序列相似为90%,在RCL的P1位置显示R(精氨酸)残基;E簇由RhS7、Ispin2和RmS12组成,在RCL的P1位置显示Y(酪氨酸)残基,RhS7和RmS12序列相似为95%。RhS9与其他蜱种的Serpin同源性较低。
B组:在F簇中,RhS4与RaS3和RmS3的序列相似度均大于90%,他们在RCL的P1位置显示L(亮氨酸)残基;G簇由RhS5和RmS6组成,在RCL的P1位置显示R(精氨酸)残基,序列相似度为90%;H簇由RhS8、IrS8、Ispin8和RmS15组成,RCL区氨基酸序列完全相同,P1位置显示R(精氨酸)残基,RhS8与RmS15序列相似度大于90%。RhS1为唾液腺特异表达,在卵巢转录组数据库中未发现该基因序列。
RhS11与其他蜱相比相关性较远,单独构成一个分支。

图3 蜱Serpin家族系统进化树Fig. 3 Phylogenetic tree constructed from tick Serpin family
2.6 基于结构的序列比对 通过ClustalX进行序列比对,以人的α1-antitrypsin(α1-抗胰蛋白酶,PDB 1HP7)三级结构为参考模型,使用SEPript 3.0服务器分析镰形扇头蜱10个Serpin基因的二级结构。hA~hI为9个α-螺旋,sA~sC为3个β-片层,结果如图4。
2.7 建立分子模型 通过建立分子模型,挑选了RhS3和RhS10(图5),所有的RhS均有3个β片层、8~9个α螺旋和RCL组成。其中,RhS6、RhS9和RhS10的RCL区暴露在外端C-β片层上(图5 A),RhS2、RhS3、RhS4、RhS5、RhS7、RhS8和RhS11的RCL区在A-β片层中(图5B)。

图4 以α1-抗胰蛋白酶(1HP7)为模型的镰形扇头蜱Serpin基因二级结构序列比对Fig. 4 Structure-based sequence alignment R.haemaphysaloides Serpin gene with human α1-antitrypsin(PDB 1HP7) as modeling template
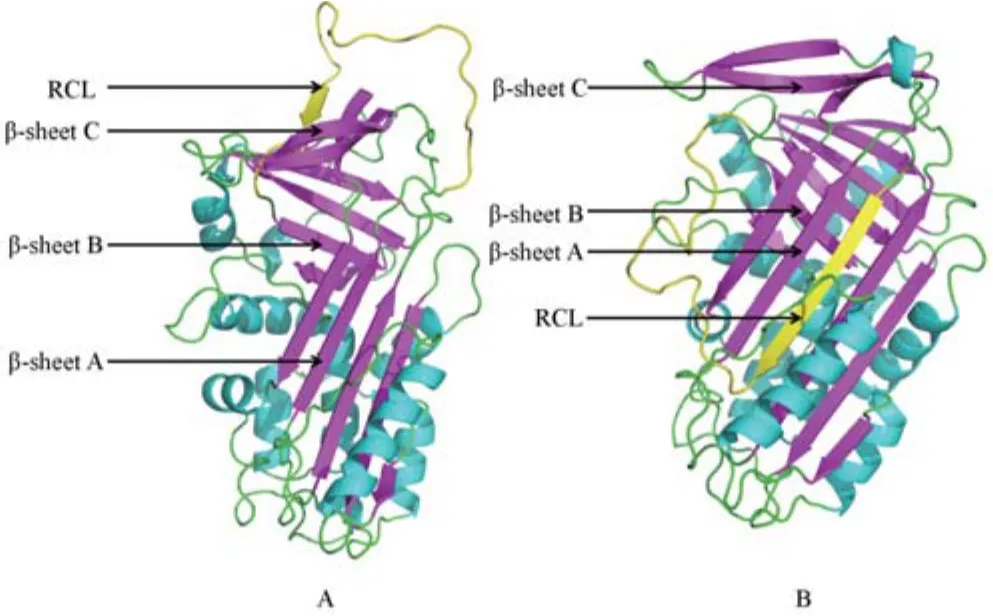
图5 RhS3(A)和RhS10(B)分子模型Fig. 5 Molecular modeling of RhS3(A) and RhS10(B)
3 讨论
大多数Serpin超家族成员属于抑制型,胞外Serpin可以调节蛋白质水解级联反应的一系列生化反应过程,如抗凝血酶抑制血液凝集,抗胰蛋白酶、抗胰凝乳蛋白酶、抗弹性蛋白酶等在炎症反应中起作用;胞内Serpin的作用一般是保护细胞和抵御不当释放的蛋白酶[9]。
系统发育进化树表明,Serpin分为细胞内和细胞外两组,RhS与RmS具有较高的相似性。同一簇的Serpin具有相同或相似的RCL区,主要是P1位点的残基,决定了Serpin的特异性。蜱Serpin基因分析显示,初级、二级、三级结构高度保守。RCL区P1位点的氨基酸残基对Serpin的特异性至关重要。例如,人的α1-抗胰蛋白酶的P1位点为M(甲硫氨酸),α1-抗血纤维蛋白溶酶、抗凝血酶、蛋白C抑制剂和C1抑制剂在P1位点具有碱性氨基酸残基R(精氨酸)或K(赖氨酸)[10]。他们参与凝血、炎症和补体活化等,并在抑制宿主抵御吸血寄生虫方面是非常重要的[11]。Iris是特异性弹性蛋白酶抑制剂,在RCL区的P1位点的氨基酸残基是M,将M突变为R,IrsS便不具有弹性蛋白酶抑制活性,但却具有很强的Xa因子和凝血酶活性[12-13]。因此,在Serpin的P1位点有不同的氨基酸残基,会对不同的丝氨酸蛋白酶和半胱氨酸蛋白酶等产生抑制作用,在凝血、炎症等方面会抑制宿主免疫应答,促进蜱的吸血和发育。
没有信号肽的Serpin可能在蜱的细胞内发挥重要作用,在蜱的发育、细胞内消化和卵黄发生过程中具有重要的调节作用[14]。秀丽隐杆线虫的SRP2在所有发育阶段均表达,过表达可导致其发育缺陷或停止发育[15]。RmS3可以抑制胰凝乳蛋白酶和弹性蛋白酶的活性,大量分泌到蜱叮咬部位,抑制炎症反应,保护蜱的生殖细胞免受进入血腔的消化蛋白酶损伤[16-17]。可见,蜱卵巢中的Serpin与蜱的营养发育和生殖产卵有关。
大多数节肢动物Serpin参与先天性免疫反应和宿主免疫反应[7]。微小扇头蜱RmS15具有抗凝血功能,抑制凝血酶活性,是凝血途径中重要的Serpin分子[18]。篦子硬蜱的Iris(Ixodes ricinusimmunosuppressor)的靶向蛋白是白细胞弹性蛋白酶,可干扰接触相凝血途径,纤维蛋白溶解并破坏血小板粘附。Iris具有调节先天免疫和适应性免疫的能力,影响T淋巴细胞和巨噬细胞的反应性,并诱导Th2型应答和抑制促炎性细胞因子的产生[19-20]。篦子硬蜱唾液腺分泌的IrS-2,通过损伤IL-6/STST-3信号通路来抑制Th17分化,IrS-2选择性的抑制螺旋体刺激树突状细胞IL-6的分泌,从而导致STAT-3磷酸化水平降低,最终抑制Th17的分化,调节宿主免疫反应[8]。斯氏按蚊的AsSPRN6参与蚊子体内杀伤寄生虫的过程,而冈比亚按蚊AgSPRN6通过抑制黑化反应或促进虫体溶解来杀灭寄生虫[21]。下调SRPN6会导致中肠和唾液腺中疟原虫的数量增加[21-22]。可见,Serpin参与自身的先天免疫调节,杀伤外来病原体。卵巢Serpin可能与蜱传病原体的垂直传播有关,如某些病毒将病原体通过卵传给子代,继而下一代幼蜱、若蜱、成蜱也携带病原体[23]。
目前研究共报道了两条来自镰形扇头蜱唾液腺吸血前后消减文库Serpin,分别是RhS1和RhS2,均为胰凝乳蛋白酶抑制剂Serpin。其中RhS1在唾液腺特异表达,RhS2在蜱中肠特异表达[24]。本研究在镰形扇头蜱的卵巢组织转录组数据库中发现了10条编码Serpin基因序列,RhS2也在其中,而RhS1却没有发现,说明RhS1可能参与蜱正常的吸血和抑制宿主免疫应答,RhS2可能参与细胞内消化和生殖产卵。
总之,通过生物信息学分析,有利于全面详细了解镰形扇头蜱卵巢Serpin的特性、结构、功能等信息,对深入研究镰形扇头蜱Serpin的功能和抗蜱疫苗具有一定的理论指导意义,也为今后研究其生物学与免疫学功能提供理论基础和科学依据。
