沉积物中的得克隆在中华圆田螺体内的积累及氧化应激效应
2019-06-11
(浙江工业大学 环境学院,浙江 杭州 310014)
1970年以前,灭蚁灵作为杀虫剂和添加型阻燃剂而被广泛使用,但后来由于其生物毒性而被禁用[1-3]。得克隆( Dechlorane plus,简称 DP) 作为灭蚁灵的替代品而被研发生产,并广泛应用于各类电子产品、电线电缆、尼龙和计算机外壳等材料中 。DP有顺式-DP(syn-DP)和反式-DP(anti-DP)两个异构体组成。DP的主要生产商为美国OxyChem公司和我国江苏安邦电化学公司。两个公司的DP产量分别450~4 500 t[11]以及300~1 000 t[4-5]。研究表明:在大气、水体、沉积物、灰尘和树皮等多种环境介质中,以及在生物、人体内均检测到DP[6-12]。由于DP极高的疏水性(logKow=9.3),水体环境中的DP将会吸附在悬浮颗粒物上,并下沉到沉积物中。我国各大水系,如长江流域、松花江流域、珠江流域和钱塘江流域等沉积物中均检测到DP的残留。对底泥中DP的直接利用可能是它们进入生物体的主要途径之一。所以,有关底泥中DP的生物可利用性及生态毒理性研究,对于预测该类化合物的生物富集、食物链传递及健康风险均至关重要。但到目前为止,相关研究仍然非常匮乏。
中华圆田螺(Cipangopaludinachinensis),生活在水系底部,属于杂食性淡水甲壳类软体动物,在我国分布广泛。由于田螺生活在水系底部、移动缓慢,且其食物主要来源于底泥中的腐殖质,田螺能够基本反映这一水域的污染情况,因此常被选用于生物积累及毒性实验。因此本研究以中华圆田螺为模式生物,通过生物-沉积物积累因子(Bio-sediment accumulation factors,BSAFs)、过氧化氢酶(CAT)和丙二醛(MDA)等研究底泥中DP的生物可利用性及氧化应激效应。
1 材料与方法
1.1 标准样品与试剂
顺式-DP(syn-DP,99.8%)和反式-DP(anti-DP,99.8%)标准品购自美国Accustandard公司;13C-PCB 141,13C-PCB 208,13C-PCB 202购自美国剑桥同位素实验室;CAT测试盒、MDA测试盒和蛋白质定量测试盒购自南京建成生物工程研究所;色谱纯正己烷、丙酮及二氯甲烷购自百灵威科技有限公司。
1.2 染毒底泥的制备
实验所用底泥参考本实验室之前研究[14]。
湿法染毒:用丙酮制备质量浓度为100 mg/L的DP贮备液。称取10g石英砂均匀平铺于500 mL烧杯中,然后用微量进样针依次加入3 mL DP贮备液、10 mL丙酮使溶剂能浸没石英砂,待丙酮挥发至0.5 mL左右时,加入20 g土壤,并用不锈钢勺搅拌均匀,重复这一步骤至500 g土壤全部放入烧杯中。最后加适量去离子水,保证土壤含水率约为30%。将烧杯放于自动搅拌器上搅拌72 h,期间每日查看含水率,适时补充去离子水。待搅拌结束后,将土壤转移至不锈钢盆中,将剩余2 500 g土壤逐渐加入,充分搅拌。搅拌完成后置于室温下,避光保存15 d,用于后续实验。
1.3 中华圆田螺的养殖和暴露实验
实验所用中华园田螺购自浙江省杭州市三塘小区菜市场,大小基本一致。培养水温为20~25 ℃,昼夜光照比为6 h∶18 h的循环水系统中。培养所用水均为去氯自来水。
中华圆田螺暴露实验方法具体如下:田螺置于底部平铺有1 500 g染毒沉积物的36 L玻璃水槽內,沉积物和上覆水的体积比为1∶3,采用氧气泵曝气供氧,以使培养过程中上覆水中溶解氧保持3.0 mg/L以上。在第2,4,8,16,32天分别取样。待处理的田螺先放置在清水里24 h,使其吐尽肠道里的沉积物,随后将其解剖,依据组织不同分为肌肉和肝脏两个组,放入聚四氟乙烯封口袋中,贴好标签,置于-20 ℃冰箱里待测。
1.4 样品的处理和净化
1) 沉积物的前处理。称取2 g沉积物于玻璃纤维滤筒中,加入0.5 g铜粉,加入示踪标13C-PCB 141和13C-PCB 208,用140 mL二氯甲烷索氏提取48 h;提取液旋转蒸发,并加入适量正己烷替换二氯甲烷,并最终浓缩至1 mL;浓缩后的提取液经层析柱净化,层析柱填料从下至上分别为2 g无水硫酸钠、2.5 g氧化铝、3 g中性硅胶、2 g无水硫酸钠,淋洗液为80 mL二氯甲烷;将淋洗液旋转蒸发至2 mL,正己烷溶剂替换2次再次旋转蒸发浓缩至2 mL;浓缩液经氮吹定容至1 mL,加入内标13C-PCB 202,保存在-20 ℃冰箱内待GC-MS分析测定。
2) 中华圆田螺的前处理。称取2 g冷冻干燥后的中华圆田螺样品于研钵中,并加入2 g无水硫酸钠,充分研磨至田螺样品呈粉末状;置于玻璃纤维滤筒中,加入0.5 g铜粉,示踪标13C-PCB 141和13C-PCB 208,用140 mL二氯甲烷索氏提取48 h;提取液经浓硫酸酸洗3次去脂肪,将酸洗后的提取液经沉积物相同净化方法处理,最后待GC-MS分析测定。
1.5 仪器分析
目标化合物的仪器分析采用Agilent-7890气相色谱仪-5973N质谱仪。
色谱条件:进样口温度设置为280 ℃,进样方式为不分流模式,载气为高纯氦气,流量为1.0 mL/min,进样量为1.0 μL;色谱柱选用DB-5MS毛细管柱(30 m×250 mm×0.25 μm);升温程序:初始温度80 ℃保持3 min,然后以10 ℃/min升至300 ℃并保持20 min。
质谱条件:离子源为负离子化学电离源(ECNI),能量为70 eV;离子源、传输线和四极杆温度分别设置为150,280,150 ℃;甲烷为反应气体,采用选择离子(SIM)模式进行目标化合物的定性定量分析;syn-DP和anti-DP检测离子为653.8/651.8/655.8,示踪标13C12-PCB 141和13C12-PCB 208的检测离子为372/370/374和475.8/473.8/477.8,内标13C12-PCB202的检测离子为441.8/439.8/443.8。
1.6 质量控制和保证
采用8点标准曲线内标法定量目标物,DP每种物质标准曲线的相关系数R2>0.998,示踪标13C-PCB 141,13C-PCB 208和内标13C-PCB 202的线性相关系数R2>0.999。将10倍信噪比对应的目标物浓度作为实验方法检出限,得到目标物syn-DP,anti-DP在沉积物中的检出限(以干重计)分别为0.03,0.027 ng/g,两个化合物在中华圆田螺体内的检出限(以干重计)分别为0.02,0.016 ng/g。syn-DP和anti-DP在沉积物中的回收率为113.3%和120.3%,在生物样品中的回收率为101.5%和105.2%。
2 结果与讨论
2.1 DP的生物积累效应
经过32 d的暴露实验,DP在中华圆田螺体内不同时间的积累浓度如图1所示:高(1 000 ng/g)、低(100 ng/g)两个暴露水平下anti-DP(积累浓度曲线,高暴露水平:C=0.370t-0.174,R2=0.971,p<0.05;低暴露水平:C=0.149t-0.101,R2=0.948,p<0.05)和syn-DP(积累浓度曲线,高暴露水平:C=0.077t+0.272,R2=0.921,p<0.05;低暴露水平:C=0.04t+0.424,R2=0.652,p>0.05)在中华圆田螺体内的积累浓度随暴露时间的增加而增加,但32 d暴露后,anti-DP和syn-DP在中华圆田螺体内的浓度未达平衡。低浓度暴露水平下,syn-DP和anti-DP的生物-沉积物积累因子(BSAF=CB/Cs,CB为化学品在生物体内浓度,Cs为化学品在沉积物中浓度)分别为0.82和0.40,显著高于高浓度暴露水平(0.19和0.06)。此结果与Jia等[9]研究结论相似:由于DP的浓度分配未达到平衡,相对较低DP浓度的生物积累中BSAFs较高。数值上与Wang和Shen的研究结果有所区别但整体上相似。Wang等[5]研究了中国东北地区大连一河流的沉积物和鱼类,得到syn-DP和anti-DP的BSAFs值为0.88(0.33~2.8),0.33(0.086~1.0),Shen等[15]得到安达略湖水生物的syn-DP和anti-DP的平均BSAFs值为0.8和0.3。可能原因是中华圆田螺属于低营养级生物,Tomy等[16]研究表明anti-DP容易在高营养级鱼类积累而syn-DP则更倾向积累于低营养级鱼类。
许多研究用fsyn=syn-DP/(syn-DP+anti-DP)来描述异构体的相对丰度。工业品中fsyn为0.20~0.35[17],本实验暴露底泥中fsyn是0.24,基本和工业品的相对丰度相似。生物样品暴露4 d时fsyn分别为0.41(低浓度组)和0.38(高浓度组),随着暴露时间的增加,低暴露组fsyn为0.57(第8天)、0.35(第16天)和0.25(第32天),高暴露组则为0.38,0.19及0.18。可以发现两组的fsyn值均随时间增加先变大后变小,且高浓度组的下降幅度大于低浓度组。结果说明anti-DP在中华圆田螺体内更容易积累或者syn-DP更容易代谢,即中华圆田螺会对DP异构体选择性积累或者代谢。此结果与先前李亦玮[18]和Tomy[16]的研究相似。

图1 DP在田螺体内的生物积累情况Fig.1 Bioaccumulation of DP in the mudsnail
2.2 DP对中华圆田螺的毒性效应
生物的生化反应被用作环境污染物的早期预警指标,而酶活性可以作为环境污染物的生物标记物。CAT酶活力能够反映生物体内氧化还原程度,揭示生物受胁迫程度。MDA的量可以反映机体的脂质过氧化程度,从而间接反应细胞受到氧化损伤的程度。本实验测量了暴露1,3,7,10 d的CAT酶和MDA含量,研究DP对中华圆田螺的毒性效应。
田螺体内CAT酶变化情况如图2所示,整个暴露期间,空白组的肝脏和肌肉CAT酶浓度基本没有发生变化(P>0.05),实验组的肝脏CAT酶浓度(每克蛋白中的酶活力单位)在同一时段远大于空白组(差值2.18~39.34 U/g),实验肌肉组除了暴露第3 天也呈现一样结果但差值没有这么大(差值0.41~3.01 U/g),此结果表明DP会导致田螺体内活性氧增加破坏机体,从而分泌大量CAT酶来保持正常的新陈代谢,同时由于肝脏组织比肌肉组织对外源性化学物质有更加强烈的代谢功能,所以肝脏中CAT酶浓度高于肌肉。对比高低两个暴露浓度中肝脏内CAT酶变化可以发现:低暴露组CAT酶浓度随时间的增加而增大,高暴露组CAT酶随时间的增加先增大后降低,除了最后一天,同时段高暴露组CAT酶浓度大于低暴露组,说明DP浓度越高对机体毒性就越大。
丙二醛浓度可以反映机体的脂质过氧化程度,从而间接反映细胞受到氧化损伤的程度。MDA具体变化如图3所示,前三天实验组与空白组的MDA浓度(每毫克蛋白中MDA的摩尔数)差异不明显(P>0.05),第7天开始实验组MDA浓度明显大于空白组,且两者之差达到最大值,其中高暴露浓度下,肝脏和肌肉组中分别相差12.98,2.74 nmol/mg。对比暴露实验中肝脏肌肉的MDA发现:与CAT酶浓度类似,肝脏中MDA浓度大于肌肉,高浓度组大于低浓度组。

图2 CAT酶浓度随时间的变化Fig.2 Variation of CAT level in different exposure time
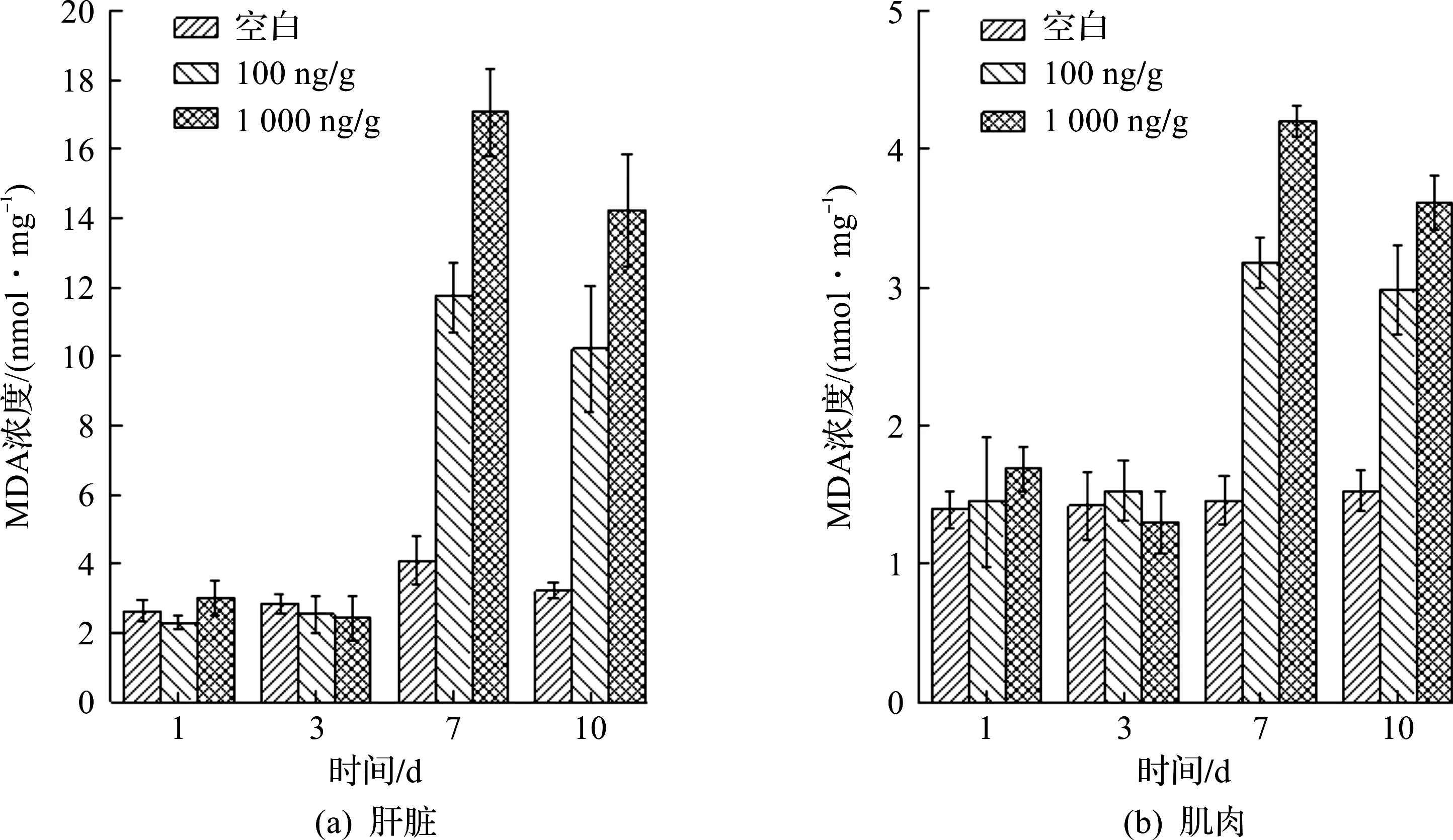
图3 MDA浓度随时间的变化Fig.3 Variation of MDA level in different exposure time
综上所述,CAT酶活性在暴露初期的升高,说明DP能够启动中华圆田螺的抗氧化系统,产生抗氧化防御,但是随着暴露时间的延长,由于产生了脂质过氧化产物导致氧化损伤,CAT酶呈现出下降趋势。与其他研究对比也发现相似的规律,Zhang等[6]指出:蚯蚓暴露在DP中,随着暴露时间的延长和浓度的增加,超氧化物歧化酶持续增加,使得天然的抗氧化系统崩溃。脂质过氧化产物MDA在暴露期间,呈现出先增加后减少再增加的趋势。Yang等[19]将蚯蚓作为受试生物,将其暴露在不同浓度DP下,发现经过28 d的暴露,DP并不能对蚯蚓产生直接毒性,但是对其产生的氧化损伤却不容忽视,酶的活性显著降低。在DP质量分数超过0.5 mg/kg后,CAT也受到了显著抑制。
3 结 论
以中华圆田螺为模拟生物,研究了DP的生物积累性和生物的氧化应激效应。计算所得BSAFs值和不同暴露时间的fsyn,发现DP生物积累性不强,但DP异构体在生物体内发生选择性积累或代谢。通过分析不同时段的CAT酶和MDA的浓度,发现DP会对生物体造成氧化损伤。
