单壁碳纳米管对太平洋牡蛎(Crassostrea gigas)的毒性效应及生物体防御机制研究
2019-06-10杨占宁丁光辉于源志李西山张楠楠李瑞娟张晶崔福旭
杨占宁,丁光辉,*,于源志,李西山,张楠楠,李瑞娟,张晶,崔福旭
1. 大连海事大学 环境科学与工程学院,大连 116026 2. 武汉大学 生命科学学院,武汉 430072 3. 大连大学 环境与化工学院,大连 116622
单壁碳纳米管(Single-Walled Carbon Nanotubes, SWCNTs)是一种典型的碳纳米材料,其几何结构可以视为由单层石墨烯卷曲而成。SWCNTs具有巨大的比表面积和优异的电子、机械、力学等性能,在电子、化工、医学以及环境保护等方面展现出巨大的应用价值[1]。随着碳纳米科技领域的迅速发展,在其生产、使用和处置等过程中不可避免地产生环境排放,其潜在的生态安全及健康风险日益受到研究者的重视[2]。
海洋是地球上位势最低的地方,也是污染物的汇聚地,能够通过废水排放、地表径流、大气沉降等多种方式汇聚各种污染物。受海水高离子强度和碳纳米材料易团聚性质的共同作用,沿海地区将成为碳纳米材料的最终聚集地和高暴露风险区域。细菌、藻类、甲壳类动物及鱼类的急性毒性实验数据表明,纳米颗粒(nanometer particles, NPs)对水生物种具有一定的毒性效应[3-5]。已有的毒理学研究表明,碳纳米材料暴露能够在生物体内形成超氧阴离子等氧自由基[6],进而发生歧化反应产生额外的活性氧(reactive oxygen species, ROS),致使生物体内抗氧化系统失衡,引起生理生化过程的异常[7],即所谓的氧化应激。Canesi等[8]发现富勒烯(C60)和纳米TiO2暴露导致海洋贻贝消化腺中的溶酶体膜失衡及脂褐质的堆积。Ringwood等[9]将美洲牡蛎暴露于C60,发现牡蛎的肝胰腺组织中出现大量的溶酶体,并产生较高的内吞作用。
海洋双壳贝类具有高度发达的微纳米级颗粒的细胞内化系统,其强大的吞噬作用可以滤过大量的水、微藻、细菌及沉积物,使得其组织中累积大量的纳米颗粒[10]。太平洋牡蛎(Crassostreagigas)是一种典型的海洋底栖双壳类生物,其运动能力较弱,沿海分布广泛,对盐度的适应性较强,易受水体中碳纳米颗粒的暴露影响,是研究NPs毒性效应的理想模式生物。因此,本研究采用太平洋牡蛎作为受试生物,研究SWCNTs暴露对其造成的毒性效应以及牡蛎自身的防御行为,以期为碳纳米管的海洋生态风险评价提供科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
实验用太平洋牡蛎购于大连环洲水产市场。实验前,筛选体长5~8 cm、健康的牡蛎于实验室海水循环养殖系统中驯养一周以适应实验环境。驯养条件为:温度17~18 °C;盐度34 PSU;驯养期间定时投喂单孢藻粉。
SWCNTs(Purity: >95 wt%, OD: <2 nm, Length: 1~3 μm)购自中国科学院成都有机化学有限公司。
实验用总超氧化物歧化酶(superoxide dismutase, SOD)试剂盒、过氧化氢酶(catalase, CAT)试剂盒、丙二醛(malondialdehyde, MDA)试剂盒以及总蛋白定量试剂盒均购自南京建成生物有限公司;P-gp蛋白抑制剂Tariquidar(XR9576)购自MedChem Express (MCE)公司;总RNA提取试剂(RNAiso Plus)和反转录试剂盒(PrimeScriptTMRT reagent Kit with gDNA Eraser)购自宝生物工程有限公司;荧光定量PCR染料(SYBR Green)购于罗氏(Roche)诊断产品有限公司。
1.2 实验方法
SWCNTs采用混酸(硫酸∶硝酸=3∶1)酸化24 h,超声分散于天然海水中。SWCNTs的暴露浓度设为0、0.1、1及10 mg·L-1。每个浓度组3只牡蛎,暴露于2 L的SWCNTs海水溶液中,暴露时长设为48 h和96 h。
为分析P-gp蛋白抑制剂在牡蛎防御外源污染物的毒性效应中的作用,开展了P-gp蛋白抑制剂Tariquidar和SWCNTs复合暴露的实验。该部分实验设置空白对照组(CK)、0.3 mg·L-1的Tariquidar暴露组、0.1 mg·L-1的SWCNTs暴露组、以及0.1 mg·L-1的SWCNTs和0.3 mg·L-1的Tariquidar复合暴露组,暴露时长为96 h。
暴露终点时,分别解剖并采集牡蛎的鳃和消化腺组织样品进行抗氧化酶活性测定、氧化损伤和基因相对表达量分析。采用试剂盒测定牡蛎鳃和消化腺中SOD和CAT抗氧化酶活性及脂质过氧化物MDA含量的变化。采用实时荧光定量PCR(q-PCR)测定cat基因、热休克蛋白70(heat shock protein 70,hsp70)基因、交替氧化酶(alternative oxidase,aox)基因及细胞凋亡基因(caspase-7)的相对表达量变化。相关基因的引物设计信息如表1所示。

图1 太平洋牡蛎组织中抗氧化酶活性变化注:字母相同表示没有显著性差异,字母不同表示差异显著,P≤0.05。Fig. 1 Changes of activities of antioxidant enzyme in Crassostrea gigas tissuesNote: The same letters mean no significant difference; the different letters indicate significant difference, P≤0.05.
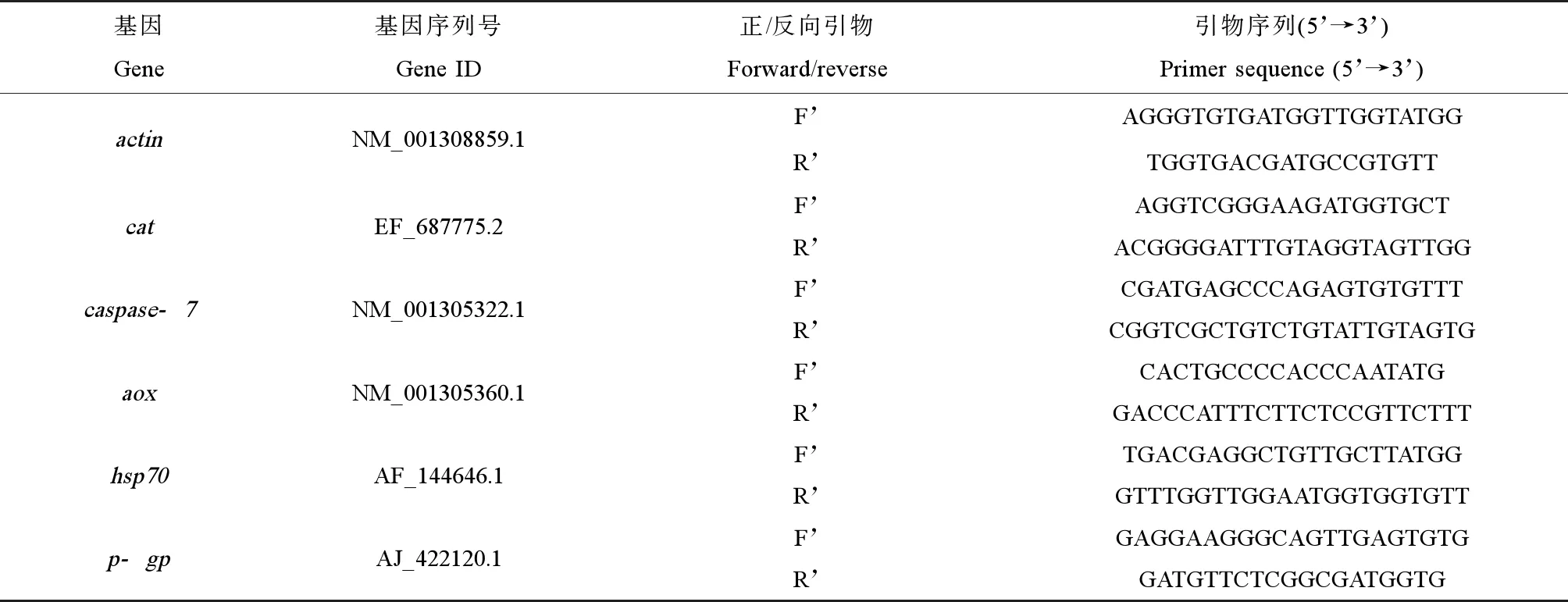
表1 相关基因的引物设计信息Table 1 The primer information of genes studied
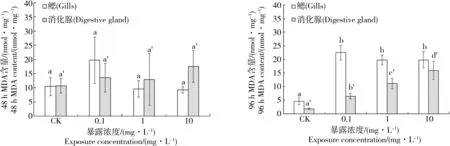
图2 太平洋牡蛎组织中MDA含量变化注:字母相同表示没有显著性差异,字母不同表示差异显著,P≤0.05。Fig. 2 Changes in the MDA content in tissues of C. gigasNote: The same letters mean no significant difference; the different letters indicate significant difference, P≤0.05.

图3 太平洋牡蛎组织中抗氧化基因相对表达量变化注:字母相同表示没有显著性差异,字母不同表示差异显著,P≤0.05。Fig. 3 The relative expression of antioxidant genes in C. gigas tissuesNote: The same letters mean no significant difference; the different letters indicate significant difference, P≤0.05.

图4 太平洋牡蛎组织中caspase-7相对表达量的变化注:字母相同表示没有显著性差异,字母不同表示差异显著,P≤0.05。Fig. 4 The relative expression of caspase-7 in C. gigas tissuesNote: The same letters mean no significant difference; the different letters indicate significant difference, P≤0.05.
本研究采用SPSS 13.0软件(SPSS Inc.)对实验数据进行统计学分析。不同处理组间的比较采用单因素方差分析,P≤0.05表示差异显著。
2 结果与分析(Results and analysis)
2.1 SWCNTs暴露对太平洋牡蛎的氧化损伤
2.1.1 太平洋牡蛎鳃和消化腺中抗氧化酶活性变化
SWCNTs暴露后,太平洋牡蛎鳃和消化腺中SOD和CAT酶活性变化如图1所示。暴露48 h后,暴露组牡蛎组织中抗氧化酶活性与对照组相比,并没有显著性差异(P>0.05);但在暴露96 h后,暴露组牡蛎的2种组织中抗氧化酶活性较对照组均有显著性升高(P≤0.05),且呈现出随暴露浓度升高而升高的剂量-效应关系。鳃是牡蛎首先暴露于SWCNTs的器官,其SOD活性变化较消化腺明显;抗氧化系统中CAT是SOD的后续酶,其在消化腺中的酶活性变化较鳃中更明显。
2.1.2 太平洋牡蛎鳃和消化腺中MDA含量的变化
SWCNTs暴露后,太平洋牡蛎鳃和消化腺中MDA含量变化如图2所示。暴露48 h后,暴露组太平洋牡蛎组织中MDA含量与对照组并没有显著性差异(P>0.05);但是在暴露96 h后,暴露组牡蛎的2种组织中的MDA含量较对照组均有显著性升高(P≤0.05),且在消化腺中呈现出随暴露浓度升高而升高的剂量-效应关系。在鳃中,MDA含量即使在低剂量(0.1 mg·L-1)下,也与对照产生显著性差异,表明SWCNTs暴露在太平洋牡蛎鳃组织中容易产生氧化损伤。
2.2 太平洋牡蛎鳃和消化腺中相关基因相对表达量的变化
2.2.1 太平洋牡蛎鳃和消化腺中抗氧化系统相关基因相对表达量的变化
SWCNTs暴露后,太平洋牡蛎鳃和消化腺中cat、hsp70、aox基因相对表达量变化如图3所示。太平洋牡蛎鳃和消化腺中cat基因的相对表达量呈现出与CAT活性相似的变化趋势。hsp70基因的相对表达量在暴露48 h和96 h后呈现相似的变化趋势,即在低浓度(0.1 mg·L-1)时与对照组没有显著性差异(P>0.05),而在相对较高的浓度(1~10 mg·L-1)下呈现出显著的上调(P≤0.05)。aox基因的相对表达量呈现出随暴露浓度升高而显著上调的趋势,而且随暴露时间增长,aox基因的相对表达量上调越显著(P≤0.05)。这些基因表达的变化与抗氧化酶活性的变化相一致。
2.2.2 太平洋牡蛎鳃和消化腺中caspase-7基因相对表达量的变化
如图4所示,SWCNTs暴露48 h后,牡蛎2种组织中caspase-7基因的相对表达量在0.1 mg·L-1的暴露浓度下呈现显著的下调(P≤0.05)。随着暴露浓度的升高,caspase-7基因的相对表达量持续升高,在10 mg·L-1的暴露浓度下呈现出显著的上调(P≤0.05)。随暴露时间延长到96 h,caspase-7基因的相对表达量呈现出单调上升的剂量-效应关系。
2.3 太平洋牡蛎对SWCNTs的防御机制
2.3.1 太平洋牡蛎鳃和消化腺中p-gp蛋白基因相对表达量的变化
经过96 h的SWCNTs暴露,太平洋牡蛎鳃和消化腺中p-gp蛋白基因相对表达量呈现出随暴露浓度升高而逐渐升高的剂量-效应关系,且消化腺中的表达量略高于鳃(图5)。这一方面表明随外源污染物暴露浓度的增加,牡蛎的外排机制不断增强;另一方面也表明,即使在10 mg·L-1的暴露浓度下,太平洋牡蛎防御机制还在起积极作用,能够耐受较高浓度的SWCNTs的暴露。
2.3.2 复合暴露下太平洋牡蛎鳃和消化腺中MDA含量的变化
复合暴露实验中,太平洋牡蛎鳃和消化腺中MDA含量变化如图6所示。0.1 mg·L-1的SWCNTs和0.3 mg·L-1的Tariquidar单独暴露均导致太平洋牡蛎组织中MDA的含量显著升高(P≤0.05)。0.1 mg·L-1的SWCNTs和0.3 mg·L-1的Tariquidar的复合暴露使MDA含量相对于空白和单独暴露均产生显著性升高(P≤0.05)。这表明Tariquidar的加入显著抑制了P-gp蛋白活性,导致太平洋牡蛎排出外源污染物的能力降低,致使更多的SWCNTs富集于组织细胞内,进而造成更严重的氧化损伤。
3 讨论(Discussion)
3.1 SWCNTs暴露对太平洋牡蛎的损伤作用
目前,关于SWCNTs的毒理学研究多集中于陆生哺乳生物及淡水生物,对海洋生物研究较少,其毒性作用机制也尚未明确[11]。已有毒理学研究表明,SWCNTs所产生毒性主要表现为:①氧化损伤:由于材料表面的电子活性位点(给电子或受电子基团)能与氧分子发生作用,生成大量的ROS,这些ROS作用于细胞膜表面的多不饱和脂肪酸,产生脂质过氧化,进而引起细胞膜结构和功能受损;②蛋白及DNA损伤:当机体氧化损伤程度严重时,细胞膜被破坏,大量的纳米颗粒侵入细胞内,造成严重的蛋白质变性及DNA损伤。
MDA含量可以作为机体受到氧化损伤程度的一个指标[12]。SWCNTs暴露48 h后,太平洋牡蛎鳃和消化腺内未产生显著性的MDA含量增加。而在暴露96 h后,2个组织中的MDA含量均显著升高。这表明,在本研究的暴露剂量下,短期48 h的暴露并未产生明显的氧化损伤,但是随着暴露时间延长到96 h,SWCNTs暴露在牡蛎鳃和消化腺中产生了一定程度的氧化损伤,且鳃和消化腺的损伤程度表现出一定的差异。当暴露对太平洋牡蛎产生效应时,鳃所受到的氧化损伤程度明显高于消化腺;随暴露浓度升高,消化腺所受到的氧化损伤随之显著升高,而鳃所受到的损伤已经达到了较高水平,并未随暴露浓度升高而升高。导致这种现象的主要原因是由于鳃是牡蛎首先暴露于污染物的器官,SWCNTs最先在鳃中诱导氧化应激。随着SWCNTs逐渐被消化腺所吸收和富集,才逐渐在消化腺中造成氧化损伤。Trevisan等[13]的研究结果表明短期暴露于纳米氧化锌的太平洋牡蛎并没有表现出明显的氧化应激,但是在相对长时间的暴露下,牡蛎体内的抗氧化酶水平显著升高;而且鳃是纳米氧化锌产生毒性效应的初始靶器官,而消化腺则呈现出延迟的毒性效应。D'Agata等[14]的研究则表明贝类消化腺中纳米二氧化钛的累积量是鳃中的10倍以上。因此,随着暴露时间的延长,消化腺可能成为纳米颗粒暴露的主要靶器官。

图5 太平洋牡蛎组织中p-gp相对表达量的变化注:字母相同表示没有显著性差异,字母不同表示差异显著,P≤0.05。Fig. 5 The relative expression of p-gp in tissues of C. gigasNote: The same letters mean no significant difference; the different letters indicate significant difference, P≤0.05.

图6 太平洋牡蛎组织中MDA含量变化注:字母相同表示没有显著性差异,字母不同表示差异显著,P≤0.05。SWCNTs表示单壁碳纳米管。Fig. 6 Changes in the MDA content in tissues of C. gigasNote: The same letters mean no significant difference; the different letters indicate significant difference, P≤0.05. SWCNTs stands for single-walled carbon nanotubes.
细胞凋亡是一种细胞程序性死亡,是生物体对各种应激源反应的重要防御机制[15]。通过对太平洋牡蛎细胞凋亡基因家族中caspase-7相对表达量的测定发现相对长时间和较高浓度的SWCNTs暴露诱导太平洋牡蛎组织产生显著性的细胞凋亡(P≤ 0.05),表明SWCNTs暴露已经对太平洋牡蛎产生了一定的毒性效应,诱导机体通过调控细胞凋亡基因的表达以清除受到损伤的细胞[16]。
3.2 太平洋牡蛎对SWCNTs的防御机制
太平洋牡蛎体内有多种抗氧化酶类可以清除ROS,如SOD、CAT和谷胱甘肽等。这些酶的活性可以反映机体受到的氧化损伤程度[17]。SOD可以将体内的ROS催化生成H2O2,CAT则能够清除过量的H2O2[18],从而降低SWCNTs诱导产生的ROS。本研究结果表明,牡蛎在受到SWCNTs的刺激下,体内的SOD和CAT活性增加以帮助其防御氧化损伤,牡蛎鳃作为最先接触SWCNTs的组织,为了清除过量的ROS,SOD活性相应的上调;SWCNTs被吸收进入消化腺需要一定的时间,因此消化腺中SOD活性相对于鳃中偏低。在暴露96 h后,鳃和消化腺内CAT活性显著升高(P≤0.05)。Tedesco等[19]的研究发现纳米金颗粒可诱导贻贝体内抗氧化酶活性增加。Canesi等[20]报道纳米二氧化钛和nC60使紫贻贝消化腺中CAT等一系列抗氧化酶活性升高。Pan等[21]的研究结果也证实纳米颗粒可以在贝类体内诱导抗氧化酶活性增加,从而更加有效地清除过多的ROS。
根据Michaelis-Menten方程,在一定条件下,酶促反应速度与酶分子的浓度成正比。暴露96 h后,CAT活性与cat的相对表达量都随着SWCNTs暴露浓度的升高而升高。由于cat的表达调控着机体内CAT的含量,因此太平洋牡蛎体内CAT作用的底物,即H2O2的浓度足够大。这也间接证实了太平洋牡蛎在受到SWCNTs的暴露后,机体产生了氧化应激。
AOX是线粒体交替途径末端的氧化酶[22],可以使分子氧和还原醌发生相互作用,从而降低生物体内ROS含量[23],起到防御氧化损伤的作用。本研究结果表明,当SWCNTs的暴露浓度升高时,aox的相对表达量随之升高,调控AOX含量升高以帮助其抵御氧化损伤。Maxwell等[24]的研究表明,当aox超量表达以应对氧化胁迫时,体内ROS的含量随之降低,反之则ROS升高。Zhou等[25]也发现AOX在抗氰呼吸途径中起到了清除ROS的重要作用。
热休克蛋白家族(HSPs)是生物体内广泛存在的应激蛋白[26],能够抑制产生ROS的关键酶(还原型辅酶Ⅱ, NADPH)以及增强抗氧化酶的代谢水平[27],在受到环境胁迫时起到保护机体的重要作用。HSP70是热休克蛋白家族中一种被广泛认为是各种水体污染物的高效生物标志物[28]。太平洋牡蛎在高浓度SWCNTs的刺激下调控hsp70超量表达,表明此暴露条件下的SWCNTs对牡蛎造成了一定程度的氧化胁迫,诱导牡蛎细胞调节hsp70的表达来维稳机体相关蛋白的合成。Hamdoun等[29]的研究表明,太平洋牡蛎发生氧化应激时hsp70的表达水平会显著提高。Cicchetti等[30]也发现HSP70能够保护人口腔细胞防御SWCNTs的侵害。
3.3 P-gp蛋白的清除功能
多外源性物质抗性机制(Multixenobiotic Resistance Mechanism, MXR)是双壳贝类体内的一种重要的防御机制,是其对抗外源污染物时的“第一道防线”[31]。P-gp蛋白是贝类MXR系统中重要的跨膜转运蛋白,它通过ATP供能将各种异物排出细胞[32]。通过对p-gp的测定,发现鳃和消化腺中p-gp的相对表达量都随着SWCNTs暴露浓度的升高而升高。Huang等[33]在研究利马原甲藻(Prorocentrumlima)对翡翠贻贝的MXR系统的调控机制时也发现,p-gp的表达量会显著的升高以清除毒素;当加入Tariquidar抑制剂之后,P-gp蛋白受到抑制,牡蛎所受到的氧化损伤程度显著升高。这表明太平洋牡蛎能够通过P-gp蛋白将部分SWCNTs排出体外,从而降低牡蛎所受到的氧化损伤,这与Palace等[34]的研究结果相一致。
本文研究了SWCNTs对太平洋牡蛎的毒性效应及太平洋牡蛎的防御机制。实验结果表明,在本研究的暴露条件下,SWCNTs对太平洋牡蛎所造成的毒性效应主要为氧化损伤,而牡蛎体内的抗氧化系统和多外源性物质抗性机制系统在防御SWCNTs的过程中起到了至关重要的作用。鳃作为太平洋牡蛎先接触SWCNTs的器官,最先受到SWCNTs暴露的胁迫,诱导产生氧化应激;消化腺逐渐吸收并累积SWCNTs,其所产生的氧化应激随暴露时长和暴露浓度的升高而升高。太平洋牡蛎多外源性物质抗性机制系统中的P-gp蛋白在SWCNTs的细胞外排过程中起重要作用,因此在太平洋牡蛎的防御系统中起到至关重要的作用。
致谢:感谢国家自然科学基金(51479016; 51308083),辽宁省博士科研启动基金(20170520368)对本研究的资助。
