Orexin-A对脊髓腹角神经元基本电生理参数及尼古丁电流的作用
2019-06-10高凌云朱苏月张环环汪萌芽
黄 艳,高凌云,朱苏月,张环环,汪萌芽,郑 超
(皖南医学院 细胞电生理研究室,安徽 芜湖 241002)
Orexin(食欲素,也称为hypocretin),由来自同一前体蛋白水解酶加工的两种神经肽orexin-A(OXA)和orexin-B(OXB)组成[1],通过结合并激活两种独立的G蛋白耦联受体,即orexin-1受体(OX1R)和orexin-2受体(OX2R),产生对神经元的调节作用[1-2]。目前,有关orexin-A在脊髓上的分布及神经纤维投射的研究居多,但有关orexin-A对脊髓功能的研究较少见,尤其在脊髓腹角神经元的运动控制功能上。随着对orexin神经元的研究深入,有学者提出orexin能系统和胆碱能、单胺能系统之间存在交互作用[3],在orexin投射到腹侧被盖区、基底前脑等大脑多个区域都表现出与胆碱能神经元的协同作用,表现在成瘾、睡眠与觉醒等方面[4-5]。而在脊髓发育期,胆碱能传递与负责产生运动行为的神经回路相关。在生理学和行为学研究中,烟碱型乙酰胆碱受体(nAChR)的激活与调节胆碱能信号传导有关[6]。并且,nAChR亚型介导了乙酰胆碱对脊髓运动神经元的兴奋作用[7]。提示nAChR在脊髓运动控制中扮演着重要角色。这为我们的实验开展提供了理论依据,但是orexin是否对脊髓腹角神经元上的nAChR有调制作用,从而直接或间接地影响脊髓腹角的运动控制?尚未见报道。因此,本研究采用7~12 d的新生大鼠脊髓腹角神经元急性分离联合单细胞穿孔膜片钳记录技术研究OXA对脊髓腹角神经元上nAChR功能的影响,并进行初步的机制分析。为进一步深化对脊髓运动控制机制的认识提供一定的实验依据。
1 材料与方法
1.1 实验动物 选用7~12 d的新生Sprague-Dawley(SD)乳大鼠,雌雄不拘,母鼠乳喂养,购于江苏省南京市江宁区青龙山动物繁殖场。动物许可证号码SCXK(苏):2017-0001。
1.2 药品与溶液 参考实验室前期工作[8],配制用于脊髓切片制备和酶消化的人工脑脊液(artificial cerebrospinal fluid,ACSF),配方为(mmol/L):NaCl 124.0;NaHCO324.0;KCl 5.0;KH2PO41.2;CaCl22.4;MgSO41.3;Glucose 10.0;通入混合氧(95% O2+ 5% CO2)后使pH达到7.35~7.45。配制用于分离细胞和穿孔膜片钳记录的标准细胞外液,配方为(mmol/L):NaCl 150.0;KCl 5.0;MgCl21.0;CaCl22.0;HEPES 10.0;Glucose 10.0;用 Tris-base 调节pH至7.36。配制电极内液,配方(mmol/L):K-gluconate 120.0;KCl 20.0;MgCl22.0;EGTA 0.5;HEPES 20.0;Na2-ATP 2.0;Na-GTP 0.5;用KOH调节pH至7.26,并调节渗透压至290~300 mOsm /(kg·H2O),最后用滤头(Millex GV filter unit,0.22 μm)过滤后,于-20℃下保存。配制穿孔药Amphotericin B(AB)母液,浓度为40 g/L,冷冻备用;使用浓度为200 mg/L。烧制琼脂,冷藏备用。配制实验所需药品的母液:0.1 mol/L尼古丁(Nicotine,Nic),0.1 mmol/L orexin-A,10 mmol/L SB334867。除AB、SB334867需用二甲基亚砜(Dimethyl sulfoxide,DMSO)溶解外,其余配液皆用去离子水(Purelab Flex,ELGA LabWater,UK)配制并冷冻备用。其中,HEPES、Tris-base、K-gluconate、EGTA、Na2-ATP、Na-GTP、Nicotine均购于SIGMA公司;Amphotericin B(AB)、orexin-A、SB334867购于Tocris Bioscience公司;普通试剂购于国药集团化学试剂有限公司。将玻璃微电极毛坯(Sutter Instrument,Inc.,USA)利用微电极拉制仪(Model PC-10 Puller,NARISHIGE,Japan)拉制成实验所需微电极,再灌注含穿孔药的电极内液,入液电极电阻为5~10 MΩ。
1.3 急性分离脊髓腹角神经元 参考实验室前期工作[8],取7~12 d的新生乳大鼠,麻醉后,游离出含腰骶膨大的脊髓,修剪神经根,剪取合适长度,用琼脂固定于震荡切片机(Vibratome,Technical Products International Inc.,USA)上,切取4~5片厚度300~500 μm的切片,将脊髓切片置于室温(23~25℃)孵育30 min左右,从剥离脊髓至切片完成整个过程控制在15 min以内;将孵育好的切片移入含有木瓜蛋白酶(Papain)的ACSF中,并在33℃的恒温水浴锅中连续消化20~25 min;将消化好的脊髓切片再移入新鲜ACSF中置室温下孵育约1 h终止消化,全程通混合氧气(95 %O2+ 5 %CO2);在显微镜下沿中央管对半切取脊髓腹侧,置于含氧饱和的标准细胞外液的小培养皿(35 mm × 10 mm,Corning,NY,USA)中,并用自制的不同口径的巴斯德吹管机械吹打成单细胞,静置15 min使细胞贴壁。
1.4 穿孔膜片钳记录 将静置好的小培养皿放置在荧光倒置显微镜(Leica DMI 3000 B,Germany)下观察,选择状态良好、胞体较大、突起较多的神经元,调节显微镜使目标细胞位于视野中央,使用图像采集软件(LAS V3.8,Leica,Germany)拍摄记录细胞形态;在低倍镜下,调节给药管位置,使其冲洗管管口对准细胞;将拉制成形的玻璃微电极充灌含穿孔药的电极内液,并固定于微操纵仪(MP-225,Sutter Instrument,Inc.,USA)的电极夹持器上,调节微操纵仪,使电极尖端入液,测定电极电阻为5~10 MΩ可用于实验,调节电极使其尖端处于细胞附近;高倍镜下调节电极使其尖端处于神经元胞体的正上方,缓慢下电极,同时联合Multiclamp 700B和Clampex 10.6(Axon Instrument,Inc.,USA)软件观察,当电极尖端接触到细胞时,给予适当的负压,使电极电阻达到GΩ,形成高阻封接后,给予电容补偿,在电流钳模式下,记录神经元的自发放电情况;再转换成电压钳模式,钳制电位为-70 mV,在穿孔药的作用下,待细胞自动破膜,观察接入电阻Ra等参数,当Ra<60 MΩ时,可进行膜片钳记录( patch clamp recording);通过快速灌流给药系统(SF-77B Perfusion Fast-step,Warner Instrument Corporation,USA)[8],给予nAChR激动剂尼古丁,记录所钳制神经元的电流变化,在此基础上,给予神经肽orexin-A,记录其对尼古丁诱导的内向电流的影响,并使用OX1R选择性阻断剂SB334867分析orexin-A对尼古丁电流影响的作用机制。
1.5 数据采集与分析 用图像采集软件拍摄细胞形态;使用Clampex 10.6软件记录保存数据,并用Clampfit 10.6软件、SPSS 18.0对数据进行分析和制图。数据以均数±标准差表示,统计方法为配对t检验和单因素方差分析,P<0.05为差异有统计学意义。
2 结果
2.1 形态学观察 采用酶消化、机械吹打法急性分离脊髓腹角神经元,在显微镜下观察到神经元胞体形状多样化,从极端发出的突起多,形态完整且有分支,细胞状态良好(图1)。
2.2 急性分离脊髓腹角神经元的自发放电 在显微镜下找到可钳制细胞,使用玻璃微电极进行高阻封接,进行电容补偿后,在电流钳模式下,记录其自发动作电位,放电稳定且连续,放电频率为(10.71 ± 7.04)Hz(n=9,典型图见图2A)。
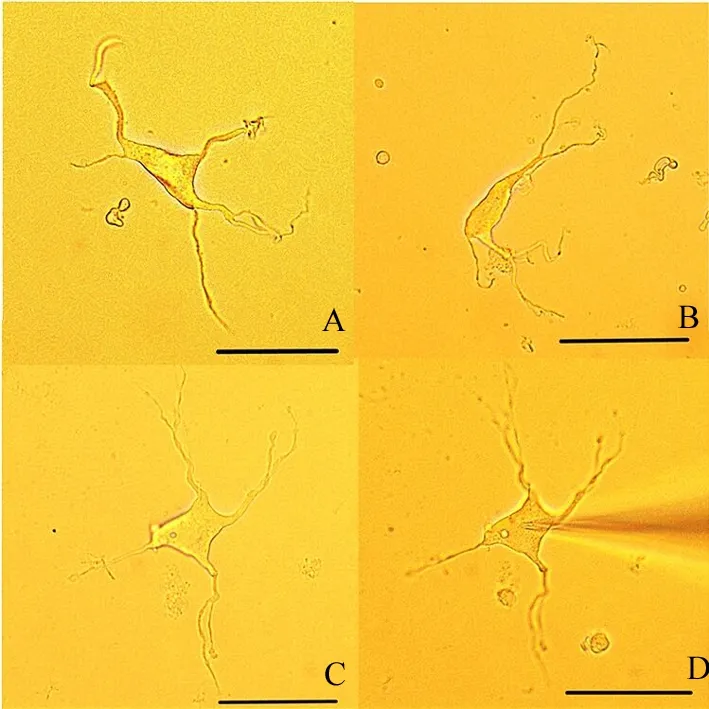
A:胞体呈菱形的神经元,从极端发出五条突起,并有分支;B:胞体呈梭形的神经元;C:胞体呈四边形的神经元,从极端发出4条突起,且分支多而完整;D:是C细胞在玻璃微电极钳制时的状态。图中所有标尺均为50 μm。
图1 显微镜下脊髓腹角神经元的形态
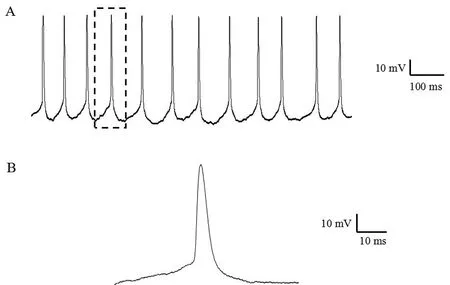
A:单个神经元连续放电1 s,放电频率为12 Hz,动作电位的幅度为71.83 mV;B:由(A)选取放大的典型动作电位。
图2 急性分离的脊髓腹角神经元的自发动作电位
2.3 Orexin-A对脊髓腹角神经元自发动作电位的影响 操作如上,记录到4个脊髓腹角神经元在1 min内持续的自发放电,其动作电位幅度为(63.90 ± 23.33)mV,放电频率为(5.75 ± 2.49)Hz;持续灌流orexin-A (100 nmol/L)2min后,动作电位幅度为(72.00 ± 12.51)mV,与灌流前相比差异无统计学意义(P>0.05),但放电频率增加至(16.25 ± 7.95)Hz,较灌流前增加(63.64 ± 5.25)%,差异有统计学意义(P<0.05);最后用标准细胞外液灌流冲洗2 min后,动作电位幅度为(54.14 ± 9.86)mV,放电频率为(5.00±4.69)Hz,较灌流前差异无统计学意义(P>0.05)。结果见图3和表1。
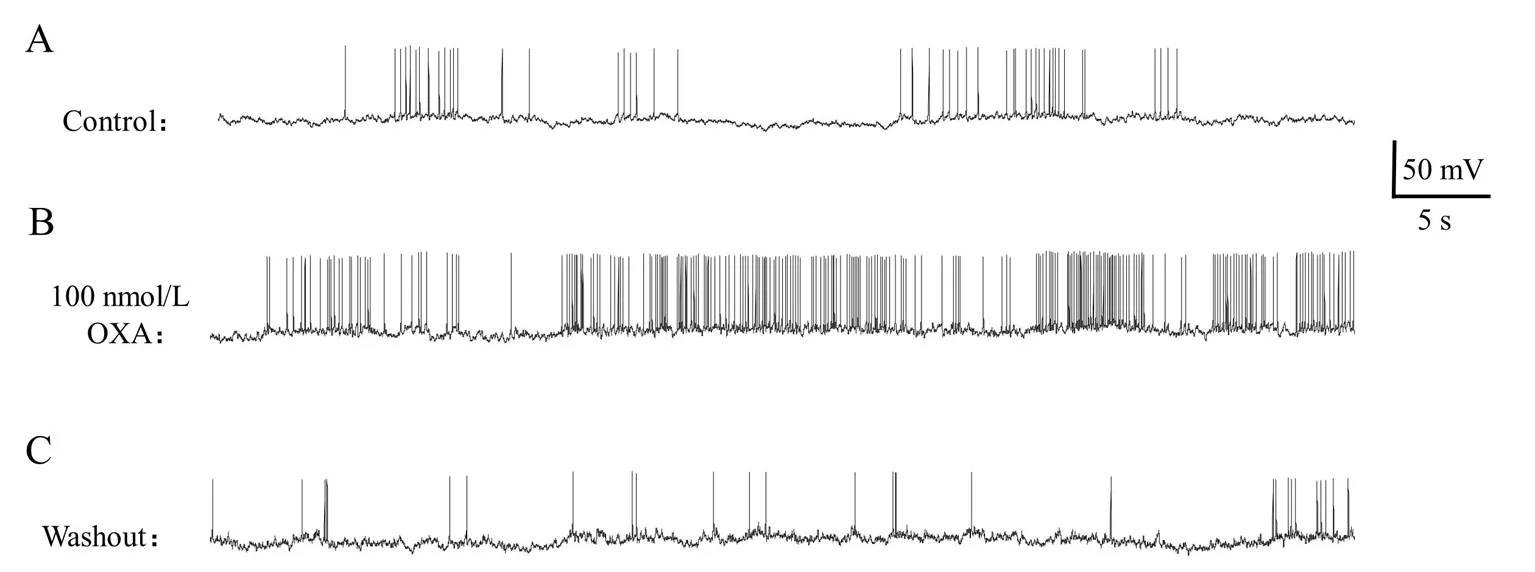
A:1 min内神经元的自发放电;B:Orexin-A灌流2 min后,同一神经元的自发放电;C:用标准细胞外液冲洗2 min后同一神经元的自发放电。
图3 Orexin-A对脊髓腹角神经元自发动作电位的影响
表1 新生大鼠脊髓腹角神经元在orexin-A灌流前后的电生理参数比较
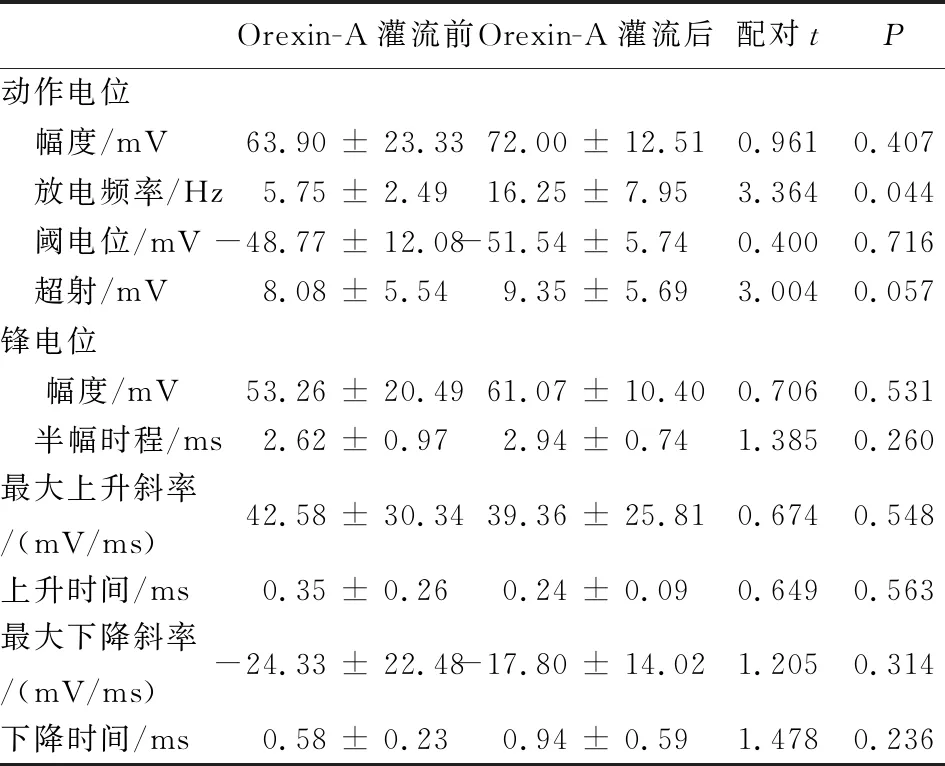
Orexin-A灌流前Orexin-A灌流后配对tP动作电位 幅度/mV63.90 ± 23.3372.00 ± 12.510.9610.407 放电频率/Hz 5.75 ± 2.49 16.25 ± 7.953.3640.044 阈电位/mV-48.77 ± 12.08-51.54 ± 5.740.4000.716 超射/mV 8.08 ± 5.549.35 ± 5.693.0040.057锋电位 幅度/mV53.26 ± 20.4961.07 ± 10.400.7060.531 半幅时程/ms2.62 ± 0.972.94 ± 0.741.3850.260最大上升斜率/(mV/ms)42.58 ± 30.3439.36 ± 25.810.6740.548上升时间/ms0.35 ± 0.260.24 ± 0.090.6490.563最大下降斜率/(mV/ms)-24.33 ± 22.48-17.80 ± 14.021.2050.314下降时间/ms0.58 ± 0.230.94 ± 0.591.4780.236
2.4 Orexin-A对脊髓腹角神经元尼古丁电流的作用 在记录的15个神经元中的12例细胞,首先应用0.3 mmol/L尼古丁在脊髓腹角神经元上诱发的电流幅度为(142.97 ± 75.02)pA;再给予100 nmol/L orexin-A 预处理2 min后,可显著抑制尼古丁电流至(69.07 ± 61.07)pA(P<0.001),抑制率为(54.75 ± 22.62)%;使用标准细胞外液灌流冲洗2 min后,再次记录尼古丁电流幅度为(108.59 ± 62.95)pA,与给予orexin-A后记录的尼古丁电流相比,差异有统计学意义(P<0.01)。各组间尼古丁电流幅度均值差异有统计学意义(F=3.598,P=0.039),结果见图4。
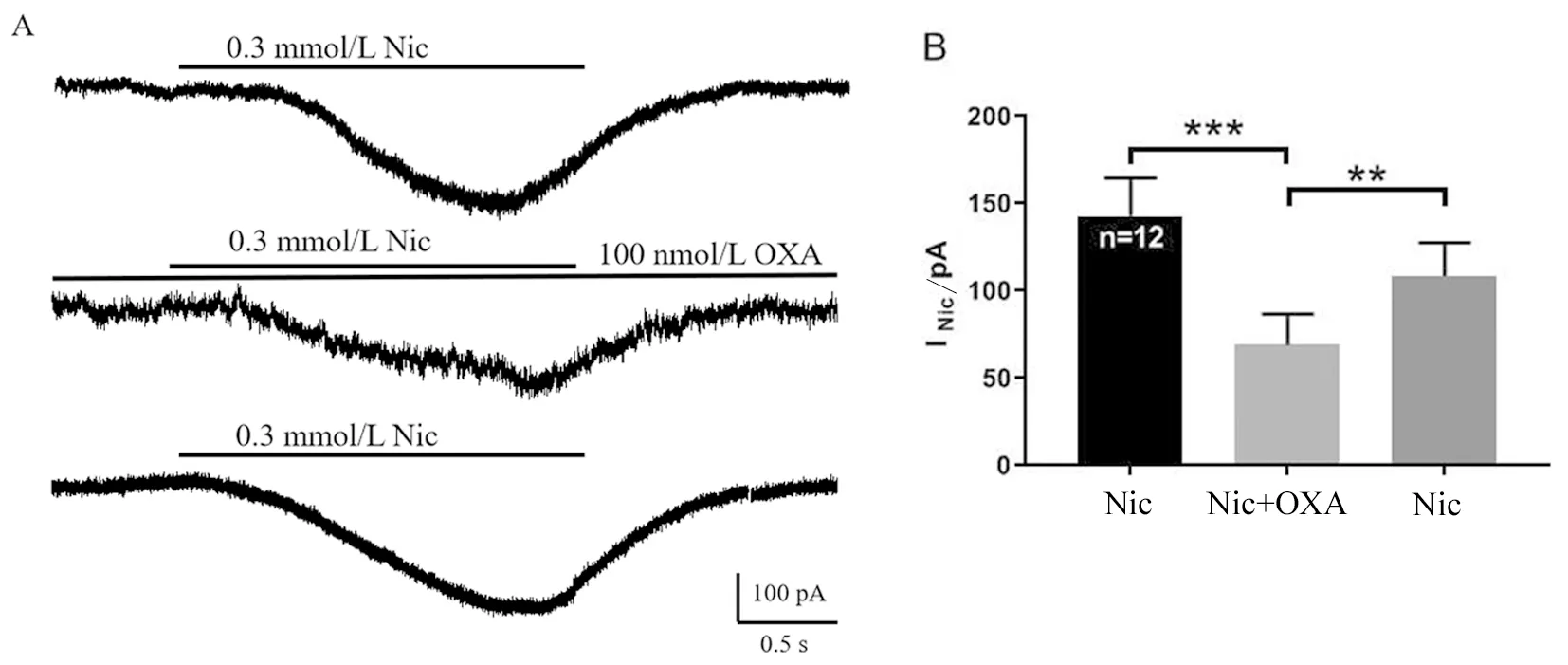
A:典型记录图显示orexin-A(100 nmol/L)对尼古丁电流的作用;B:Orexin-A对尼古丁电流的影响(n=12,**P<0.01,***P<0.001)。
图4 脊髓腹角神经元上orexin-A对尼古丁电流的影响
2.5 SB334867对orexin-A抑制尼古丁电流的影响 如图5所示,在9个细胞中记录到7个脊髓腹角神经元,应用0.3 mmol/L尼古丁诱发的全细胞电流平均幅度为(129.31 ± 69.38)pA;给予100 nmol/L orexin-A后电流被抑制到(68.61 ± 34.98)pA(P<0.01);使用标准细胞外液冲洗2 min后,尼古丁电流平均幅度恢复至(104.67 ± 55.72)pA(P>0.05);在此基础上,给予OX1R选择性阻断剂SB334867,使得orexin-A对尼古丁电流的抑制作用消失,电流幅度为(93.46 ± 56.45)pA,与使用含SB334867的标准细胞外液灌流冲洗2 min后所记录的尼古丁电流幅度(101.33 ± 54.72)pA相比,差异无统计学意义(P>0.05)。各组间尼古丁电流幅度均值差异无统计学意义(F=1.090,P=0.379)。
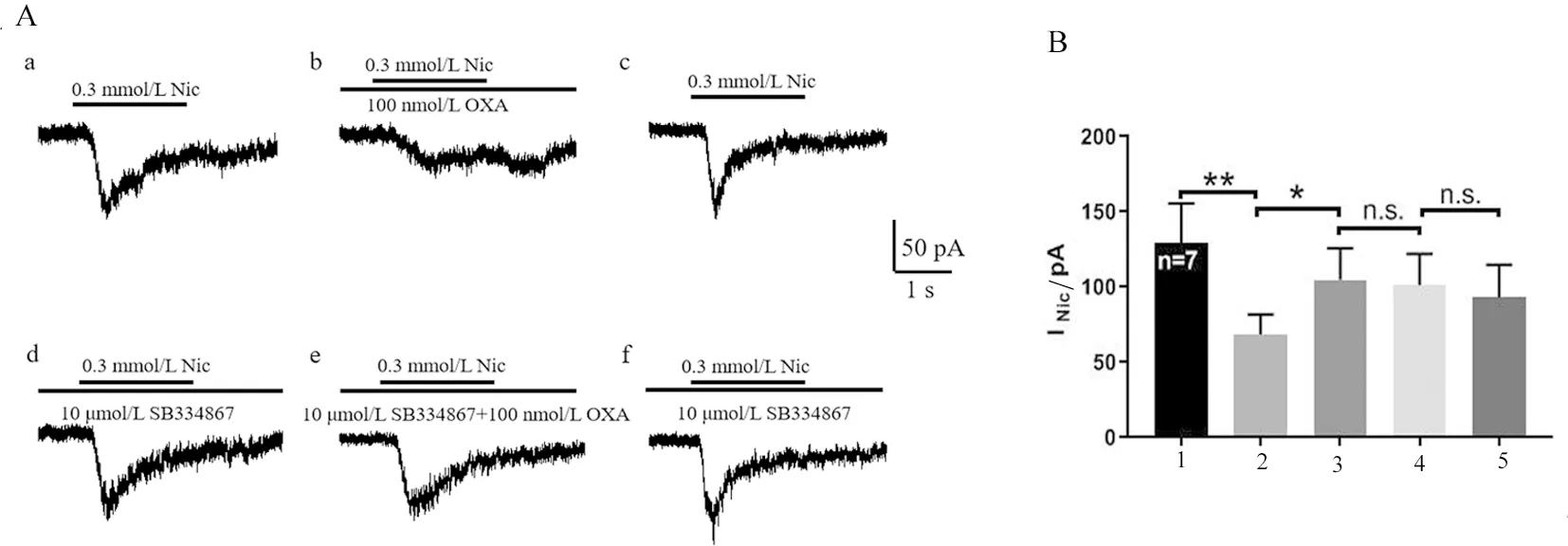
A:a.0.3 mmol/L尼古丁诱发的内向电流;b.给予100 nmol/L orexin-A对尼古丁电流有抑制作用;c.用标准细胞外液冲洗后,尼古丁电流得以恢复;d.给予10 μmol/L SB334867对尼古丁电流幅度无影响;e.同时给予orexin-A与SB334867后,尼古丁电流无明显改变;f.用含SB334867的外液冲洗后,以d为参照,尼古丁电流无明显变化。B:SB334867与orexin-A对尼古丁电流幅度影响的统计图(n=7,*P<0.05,**P<0.01)。
1.Nic;2.Nic+OXA;3.Nic;4.Nic+SB334867;5.Nic+OXA+SB334867。
图5 SB334867对orexin-A抑制尼古丁电流的作用
3 讨论
脊髓腹角神经元中nAChR在运动控制中扮演重要角色。本研究发现orexin-A主要通过OX1R介导,对大部分脊髓腹角神经元尼古丁电流具有抑制作用。提示orexin-A可通过OXR对脊髓运动控制发挥调制作用。实验所记录的急性分离的脊髓腹角神经元形态、自发动作电位及其电生理参数与本实验室前期报道基本一致[8]。实验结果显示,orexin-A能增加脊髓腹角神经元的放电频率,这与之前报道的结果类似[9-10]。研究表明,OXR在神经元胞体、树突等突触后结构中表达并发挥效应[11-12]。该分离细胞的研究中,orexin-A对脊髓腹角神经元的兴奋效应可能源于直接作用于突触后膜上OXR;但在脊髓切片,即存在完整突触的情况下,orexin还可以通过突触前膜上的OXR易化谷氨酸释放来发挥效应,从而引起脊髓运动神经元的放电频率和兴奋性的提高[10]。为了明确orexin-A对脊髓腹角神经元的作用是否还存在突触前机制,仍需进一步开展研究。
虽然大多数实验表明orexin-A是一种兴奋性的神经肽,并能在多种神经元上诱发出内向电流[12-14],但也有学者提出orexin也具有抑制性作用[15]。本实验观察到单独给予orexin-A并不能在脊髓腹角神经元诱发全细胞电流(数据未显示),但可抑制大部分的脊髓腹角神经元上尼古丁电流,这与之前的报道既有相同之处,也有不同之处,提示orexin-A在脊髓腹角神经元上的作用具有特殊性。此外,本研究还发现orexin-A能增加腹角神经元的自发放电频率,这似乎与压抑尼古丁电流自相矛盾,其实不然。首先,这可能与不同的胞内信号转导通路有关。OXR是G蛋白耦联受体,研究发现orexin-A可通过OX1R激活Gi/o/PI-PLC/IP3/Ca2 +/PKC抑制大鼠视网膜神经节细胞上AMPA电流[16],但是又可以通过Gq/PI-PLC/IP3/Ca2 +/PKC信号转导增加神经节细胞上的L型钙电流[17]。这说明在同一类神经元上也可能存在不同的信号转导途径而产生不同的调节效应。其次,取决于对Ca2+的依赖性。Orexin-A与OX1R结合后能激活PLC,生成三磷酸肌醇(IP3)和二酰甘油(DAG)等第二信使,进而促使胞内钙库释放引起胞浆中Ca2+浓度和PKC活性升高[18],使神经元细胞膜上的受体发生磷酸化,从而改变了受体功能,这与近期研究报道类似[19]。目前,尚未有研究发现orexin-A在其他脑区下调尼古丁电流的机制,所以orexin-A提升腹角神经元的放电频率,或许是其作用于不同受体、通道等后产生的综合效应,而对尼古丁电流的压抑可能只是其中的一个方面。
为分析orexin-A对nAChR的作用机制,本实验应用OX1R选择性阻断剂SB334867作用于脊髓腹角神经元上,实验结果显示,在SB334867单独存在的情况下并不影响背景尼古丁电流,进一步实验发现在灌流SB334867后能完全取消orexin-A对尼古丁电流的抑制作用,说明在这7个细胞orexin-A完全是通过OX1R来发挥作用。但实验中还有2例神经元无明显的变化,即在这2个细胞上可能不是通过OX1R来介导,或许存在OX2R或者通过腺苷酸环化酶耦联而不是PLC发挥作用的第 3 种orexin受体,尽管这种假定的受体仅在大鼠嗜铬细胞瘤细胞系PC12中提出[20]。根据目前的实验结果来看,orexin-A通过OX1R介导对脊髓大部分腹角神经元上的尼古丁电流有抑制作用。
