氧桥联双核铁配合物的催化水氧化性质研究
2019-06-09柯文姗李其军吴敏黄利江李波邓学良黄玉珍张华新
柯文姗,李其军,吴敏,黄利,江李波,邓学良,黄玉珍,张华新*,2
(1.广西大学化学化工学院, 广西南宁530004;2.广西高校应用化学技术与资源开发重点实验室, 广西南宁530004)
0 引言
随着人们生活方式的改变和社会经济的不断发展,社会对能源的需求越来越大。煤炭、石油、天然气等不可再生的传统能源正日益枯竭,而且,传统能源的使用造成了严重的环境污染问题,如温室效应、酸雨等。在未来的几十年,人类将面临严重的能源短缺以及环境污染等问题。因此,新能源和清洁能源的研究开发及合理使用成为世界经济可持续发展的重要保证。氢气作为最简单的燃料,能够以化学键的形式稳定地储存能量,是最理想的环境友好的可再生清洁能源之一[1]。氢气可以由水制取,而地球上具有丰富的水资源,可以实现自然物质的循环利用以及持续发展。

目前,在非贵金属催化剂方面存在着催化效率和稳定性低、催化条件苛刻以及催化反应的机理尚未清楚等一系列问题。结合水氧化催化剂的研究现状,本研究工作中合成了氧桥联的双核铁配合物[Fe2(μ-O)(L)4(H2O)2](ClO4)4(L=4,4′-二甲基-2,2′-联吡啶)(1),并研究其在醋酸钠—醋酸缓冲体系中对水氧化反应的催化活性。
1 材料与方法
1.1 试剂与仪器
试剂:六水合高氯酸铁(AR,百灵威科技有限公司)、4,4′-二甲基-2,2′-联吡啶(AR,成都科龙化工试剂厂)、醋酸钠(AR,广东省光华化学厂有限公司)、冰醋酸(AR,广东省光华化学厂有限公司)、甲醇(AR,成都科龙化工试剂厂)。
仪器:FL-990气相色谱(浙江福立有限责任公司)、PHS-25型数显pH计(上海仪电科学仪器股份有限公司)、Chi660e电化学工作站(上海辰华仪器有限公司)。
1.2 配合物(1)的合成
按照文献[15]的方法合成配合物(1)[Fe2(μ-O)(L)4(H2O)2](ClO4)4(L=4,4′-二甲基-2,2′-联吡啶),其结构式如图1所示。称取4,4′-二甲基-2,2′-联吡啶(184.2 mg,1.0 mmol) 于烧杯(25 mL)中,加入5 mL 甲醇溶解后进行中速搅拌,再将5 mL含有Fe(ClO4)3·6H2O (231.2 mg,0.50 mmol)的甲醇溶液加入4,4′-二甲基-2,2′-联吡啶溶液中,立即有沉淀生成,溶液颜色由黄色变为深棕色最后转至墨绿色。1.5 h后,停止搅拌并过滤,收集滤液置于干净的烧杯中,静置并且保存在密封避光条件下,约1 d左右长出了大量绿色片状晶体。约7 d后,收集墨绿色亮片状晶体,用少量甲醇洗涤后自然风干,所得产物重量为248 mg,产率为76.3 %。
IR (KBr pellets, cm-1): 3 542, 1 620, 1 244, 1 253(vs), 837, 629, 527。
1HNMR (D2O) : δ 1.97 (s, 4H), 2.7 (s, 24H), 7.63 (s,8H), 8.2 (s, 8H), 8.56 (s, 8H)。
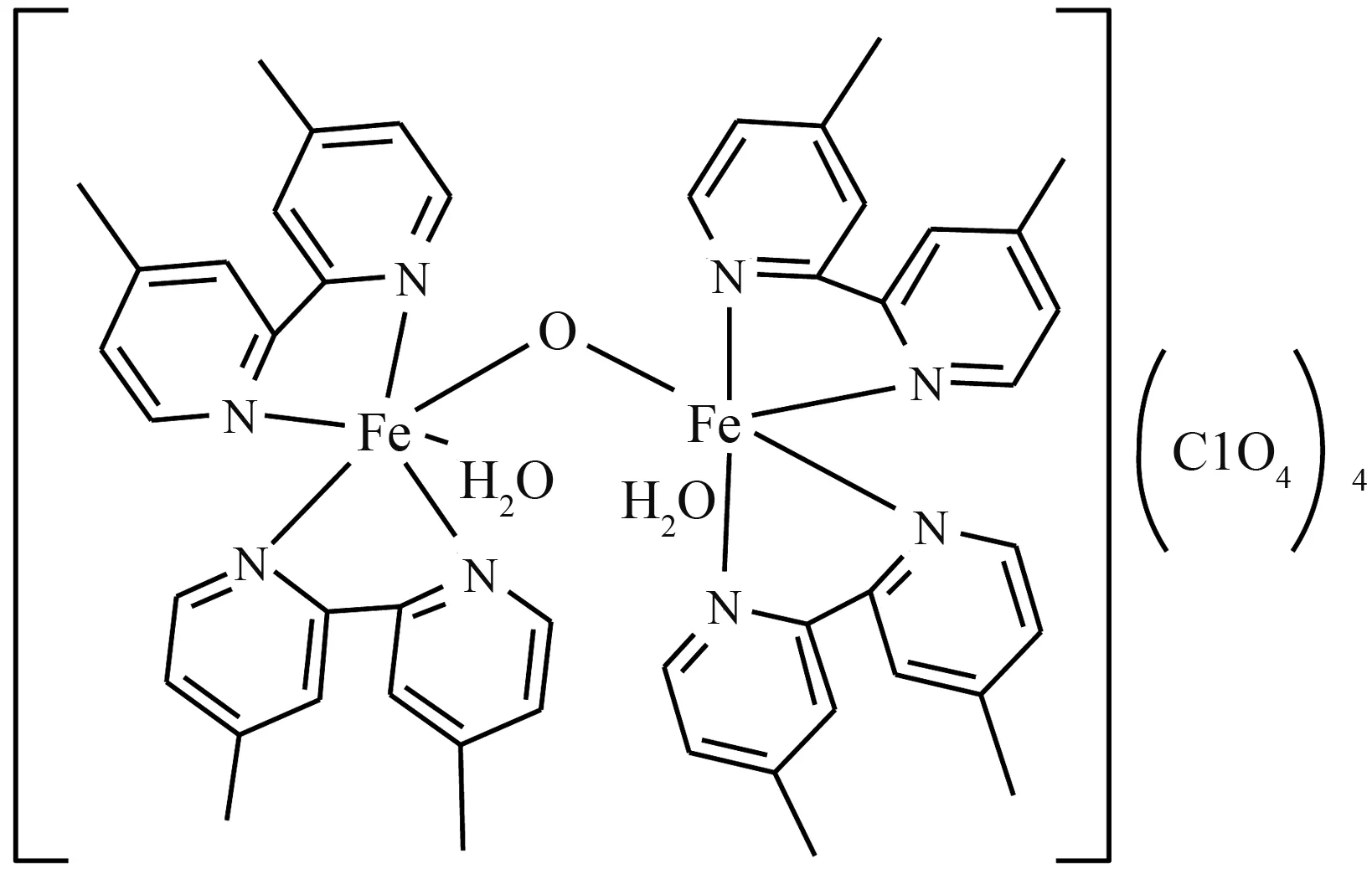
图1 配合物(1)的结构式Fig.1 Structure of complex (1)
1.3 催化实验条件
实验所用缓冲溶液均为0.1 mol醋酸钠—醋酸缓冲溶液,溶液的pH值均由pH计测定。
1.3.1 化学氧化实验条件
① 在室温下,称取适量的配合物(1)于25 mL的两口烧瓶并溶解于10 mL缓冲溶液(pH 3.00~7.50)中。向溶液中通入高纯氮气,当体系中的氧气含量达到零时(用气相色谱监测),加入过硫酸氢钾固体颗粒并迅速用橡胶塞密闭体系,实时监测体系中的氧含量,待氧含量在1 h之内趋于稳定且在反应瓶中观察不到气泡的产生时停止实验。
气相色谱条件:用氩气作载气,气相色谱填充柱,柱箱温度设为80 ℃,气化室温度120 ℃,每次手动进样量为500 μL。催化产氧量为同一测试条件下,含有催化剂时的产氧量减去空白溶液的产氧量,即净产氧量。
② 测定配合物(1)(0.75 mmol)在pH为7.50、7.00、6.50、5.50、4.50、3.45的缓冲溶液中的催化活性。
③ 在pH 7.00条件下,固定氧化剂浓度为150 mmol,将配合物浓度调整为0.50、0.25、0.10、0.05、0.02、0.01 mmol进行催化活性测试,测试过程同上。
④ 在pH 7.00条件下,固定催化剂浓度为0.75 mmol,将氧化剂浓度调整为37.5、75、112.5、187.5 mmol进行催化活性测试,测试过程同上。
1.3.2 电化学催化测定条件
在室温下,称取适量的配合物(1)溶解于pH为6.00、7.00、8.00的缓冲溶液中,使配合物的浓度达到0.50 mmol。向缓冲溶液中通入高纯氮气直至体系中的氧气含量为零。采用三电极体系进行测量,工作电极为玻璃碳电极(直径3.0 mm)或ITO电极(电极面积1.00 cm2),辅助电极为铂电极,参比电极为银—氯化银电极。利用循环伏安法及控制电位电解法测定配合物的电化学行为及催化活性。
2 结果与讨论
2.1 化学催化
配合物(1)(0.75 mmol)在缓冲溶液(pH=7.00)中完全溶解后,溶液呈粉红色,往其中加入过硫酸氢钾(150 mmol)后,溶液里立即有大量气泡产生。用气相色谱监测反应产生的气体,证实产生的是氧气。反应约40 min后,溶液为无色,体系中的氧含量趋于稳定。在反应2 h后,使用气相色谱检测反应体系中的气体成分所得到的谱图如图2所示。该催化反应的转化数(turnover number, TON)约为15。为了探究溶液的 pH 对于催化活性的影响,测定了在pH为7.50、6.50、5.50、4.50 和3.45 的缓冲溶液中的产氧量。由图3的产氧量曲线可知,改变缓冲溶液的 pH 值,以过硫酸氢钾(150 mmol)为氧化剂,配合物(1)(0.75 mmol)的活性发生了变化,在 pH=7.00时的催化性能最好。

图2 配合物(1)为代表性的气相色谱实验曲线
Fig.2 GC traces for a representative experiment

图3 配合物(1)(0.75 mmol)在不同pH的缓冲溶液中的放氧曲线
Fig.3 Oxygen-evolution curves in buffer solutions of (1) (0.75 mmol) at various pH conditions
在pH=7.00醋酸钠—醋酸缓冲溶液中固定配合物(1)的浓度为0.75 mmol,将过硫酸氢钾的浓度改为37.5、75.0、112.5、150.0、187.5 mmol,用气相色谱监测体系所产生的氧气的含量。溶液的产氧量与过硫酸氢钾浓度的关系如图4所示。实验结果表明,当氧化剂浓度在75.0~185.0 mmol范围时,配合物(1)的催化活性变化不大。
在pH=7.00的醋酸钠—醋酸缓冲溶液中,将硫酸氢钾的浓度固定为150 mmol,配合物(1)的浓度改为0.01、0.02、0.05、0.10、0.25、0.50、0.75 mmol。使用气相色谱监测各个浓度的缓冲溶液中产生的氧气的含量,并计算不同浓度下反应的TON值。如图5所示,当催化剂浓度为0.01 mmol时,TON值达到最大值89。随着配合物(1)的浓度增大,催化性能呈下降趋势。当配合物(1)的浓度达到0.10~0.75 mmol,活性变化不大。

图4 配合物(1)(0.75 mmol)在pH=7.00时产氧量与过硫酸氢钾浓度关系
Fig.4 Plot of oxygen amount vs.concentrations of oxone in buffer solutions with complex (1) (0.75 mmol) at pH=7.00

图5 含不同浓度的配合物(1)(0.01~0.75 mmol)在缓冲溶液中的放氧曲线
Fig.5 Oxygen-evolution curves in buffer solutions of (1) at various concentrations (0.01~0.75 mmol)
2.2 电催化水氧化
对配合物(1)的氧化还原行为和电催化活性进行了研究。在醋酸钠—醋酸缓冲溶液(pH=7.00)中,以玻璃碳作为工作电极进行循环伏安测试。当扫描速率为100 mV/s时,得到如图6所示的循环伏安曲线。在0.7~1.0 V范围内出现了一对氧化还原峰,将其归属为FeⅣ/Ⅲ氧化还原过程。为探索配合物的催化活性,将扫描的电压范围扩大为-0.60~1.60 V。此时,在0.0 V附近出现一对还原峰,归属为FeⅢ/FeⅡ氧化还原过程。在1.20 V附近开始出现很强的电流,其中包含了水的氧化电流。进一步测定了配合物(1)(0.5 mmol)在不同pH酸缓冲溶液(pH=6.00, 7.00, 8.00)中的循环伏安曲线。实验结果表明,尽管在中性溶液的催化电流较强,在所测的缓冲溶液中,催化水氧化反应的起始电位均在~1.20 V vs.Ag/AgCl。

图6 配合物(1)(0.5 mmol)在pH 6.00~8.00缓冲溶液中的循环伏安曲线Fig.6 Cyclic voltammograms of complex (1) (0.5 mmol) in buffer solutions at pH 6.00~8.00
为了进一步研究配合物(1)在电压作用下对水氧化反应的催化活性,对其缓冲溶液进行了控制电位电解实验。以ITO电极作为工作电极,将电压设定为1.40 V vs.Ag/AgCl连续进行电解超过4 h,得到如图7和8所示电流和库仑曲线。从实验结果可知,在pH=6.00,7.00,8.00的缓冲溶液中,催化电流以及库仑值相差不大。电流值均在0.15 mA/cm2附近,库仑值为2.2 C 左右。

图7 配合物(1)(0.5 mmol)在pH 6.00~8.00缓冲溶液中的电流曲线
Fig.7 Current traces in buffer solutions of complex (1) (0.5 mmol) at pH 6.00~8.00

图8 配合物(1)(0.5 mmol)在pH 6.00~8.00缓冲溶液中的库仑曲线
Fig.8 Charge traces in buffer solutions of complex (1) (0.5 mmol) at pH 6.00~8.00
3 结论
本研究工作测定了氧桥联双核铁配合物(1)在醋酸钠—醋酸缓冲溶液中对水氧化反应的催化活性。以过硫酸氢钾为氧化剂,配合物(1)在pH值为7.00的醋酸钠—醋酸缓冲溶液中的催化性能最好。同时,研究了配合物(1)在pH值为6.00、7.00、 8.00的醋酸钠—醋酸缓冲溶液中的水氧化电催化性质。在所测的条件下,pH对催化电流和库仑值的影响不大。为了获得催化活性更好的铁催化剂,在进一步的研究工作中,将对有机配体进行结构改进和修饰。
