多孔淀粉负载青蒿素微球的抗肿瘤活性研究
2019-06-06杨逢建张圆圆葛云龙邓怡平隋广超
赵 雪 杨逢建 钟 晨 张圆圆 葛云龙 邓怡平 隋广超
(东北林业大学,哈尔滨 150040)
青蒿素是从药用植物黄花蒿(ArtemisiaannuaL.)中分离纯化的一种内含过氧桥基团的倍半萜内酯化合物[1~2]。近年来研究表明,青蒿素及其衍生物不仅可以抗疟,而且在治疗其他疾病也具有显著效果,尤其在抗肿瘤方面表现出的低毒和与其他化疗药物无交叉耐药的特点,已成为国内外学者研究的热点。青蒿素及其衍生物能够使癌细胞周期停滞,从而抑制癌细胞生长,抑制血管生成,破坏癌细胞迁移,控制癌细胞核受体的响应,导致癌细胞调亡[3~8]。在我国,原发性肝癌主要以肝细胞发生为主,为常见的恶性肿瘤之一,发病呈逐年上升的趋势,其死亡率在全球恶性肿瘤中排第三位,目前尚未发现较好的治疗手段[9~12]。肿瘤细胞的生长和增殖以及在血管的形成过程中,需要大量的铁离子作为其生理功能所必需的营养物质,在肿瘤细胞膜的表面,转铁蛋白受体处于过表达状态,因此可以携带更多的铁离子进入肿瘤细胞中为其生长增殖所需。而在正常的细胞表面,转铁蛋白受体表达水平正常,对铁离子的需求也处于正常状态。青蒿素及其衍生物可以靶向Fe离子含量远高于正常细胞的肿瘤细胞,通过Fe离子催化青蒿素的过氧桥断裂产生自由基,进而诱导癌细胞死亡或抑制血管生成[13~16]。本文在前期研究中,选取一种新型药物载体多孔淀粉,其由淀粉改良后具有许多微米级孔隙,可以产生巨大的吸引力,能把药物吸附到小孔中,使药物不容易脱离[17~24]。通过多孔淀粉与青蒿素原药进行负载,成功制备多孔淀粉负载青蒿素微球,以提高青蒿素原药的水溶性。全铁转铁蛋白是通过人工处理后,在转铁蛋白上已携带了饱和的铁离子(即两个铁离子),通过在培养液中加入全铁转铁蛋白后,可以在离体环境下,为肿瘤细胞的增殖提供过量的其所必需的营养物质铁离子。本文以肝癌细胞为模型,探讨多孔淀粉负载青蒿素微球(ART-PS)与青蒿素原药(ART)在不同浓度下的抗肿瘤活性,以及分别联合全铁转铁蛋白后对肿瘤细胞的生长抑制作用。
2 材料与方法
2.1 主要试剂及仪器
青蒿素(西安通泽生物科技有限公司,98%,批号140705),多孔淀粉(辽宁立达生物科技有限公司,玉米淀粉为原料,批号170624);多孔淀粉负载青蒿素微球(实验室自制),盐酸阿霉素(美国Sigma公司),全铁转铁蛋白(购于Sigma公司),噻唑蓝(MTT,美国Amresco公司),1640培养基(赛默飞世尔科技公司),高塘MEM培养基(赛默飞世尔科技公司),胎牛血清(赛默飞世尔科技公司)。XD-202型培养倒立显微镜(南京江南永新光学有限公司),GT10-2型高速台式离心机(北京时代北利离心机有限公司),DK-8D型电热恒温水浴锅(上海森信实验仪器有限公司),Multiskan Ascent全自动酶标仪(芬兰Thermo Labsysterms公司),MCO-18AIC型二氧化碳培养箱(松下健康医疗器械株式会社),FLC-3型超净工作台(哈尔滨市东联公司)。
2.2 多孔淀粉负载青蒿素微球的制备工艺
多孔淀粉又称微孔淀粉,是通过机械、化学或生物方法作用于生淀粉,使其内部形成微米级孔径的一种新型辅料,具有安全、无毒、高效、生物可降解以及廉价易得等优点,是一类极具开发潜力的新型药物载体,在国内外已被广泛研发并应用于医药卫生领域[25]。多孔淀粉具有优良的吸附性能,是由于表面吸附和孔径吸附的共同作用结果。多孔淀粉具有许多小孔一直延伸到淀粉颗粒中心附近,形成蜂窝状的内部中空结构,可以产生巨大的吸引力,能将药物吸附到小孔中,使药物不容易脱离,而且仍保持颗粒基本形状[20~22,26]。多孔淀粉本身不溶于水,但由于具有较大的比表面积,因此在吸附药物后,它可以有效提高药物的溶出速度与溶出率。多孔淀粉已成功用于制备多种化学药物,如洛伐他汀[23]、卡马西平[26],普罗布考[27]和环丙沙星[24]等。本文在前期的工作中,以青蒿素为原料,多孔淀粉为载体(订购),制备了多孔淀粉负载青蒿素微球,并且进行了制备工艺优化、理化性质的表征和水溶性的测试。
多孔淀粉负载青蒿素微球(ART-PS)是采用物理吸附方法使多孔淀粉微粒吸附青蒿素原药,通过单因素法优化,从而确定了最佳制备工艺条件:在10 mL的丙酮反应体系中,青蒿素原药的加入浓度为80 mg·mL-1,多孔淀粉的加入量为2 560 mg,多孔淀粉吸附青蒿素的最佳吸附时间为30 min,最佳搅拌时间为2 h,反应温度为37℃。在最优条件下制备得到的多孔淀粉负载青蒿素微球的载药量为20.37%。通过扫描电镜检测(SEM)、比表面积的测定(BET)、红外光谱检测(FTIR)、X射线衍射检测(XRD)、差示扫描量热法(DSC)和热重量分析(TG)检测分别对多孔淀粉负载青蒿素微球的理化性质进行了表征分析,成功检测到青蒿素原药被负载在多孔淀粉的孔隙中形成的青蒿素微球。在比表面积(BET)的测定结果中,多孔淀粉的比表面积为5.11 m2·g-1,而多孔淀粉负载青蒿素微球的比表面积为0.12 m2·g-1,说明多孔淀粉孔隙已被青蒿素填充,使其孔隙变小,成功负载。在红外(FTIR)结果分析中,青蒿素原粉经过多孔淀粉的吸附过程,其表面化学结构没有变化,青蒿素主要被吸附于多孔淀粉内部孔径之中,在表面有少量分布。X射线衍射检测(XRD)、差示扫描量热法(DSC)和热重量分析(TG)检测结果也分别再次验证,青蒿素原药已经成功被多孔淀粉负载。多孔淀粉负载青蒿素微球的饱和溶解度显著提高,在水、人工胃液和人工肠液中分别是青蒿素原药的3.77、1.64和1.72倍。
2.3 细胞及细胞的培养
人肝癌细胞(HepG2、SMMC-7721)和人正常肝细胞(HL-7702)都引自国家细胞实验资源共享平台(北京总部)。细胞于含10%的小牛血清、100 U·mL-1青霉素和100 μg链霉素的MEM和RPMI-1640培养液中,置37℃、5% CO2饱和湿度的细胞培养箱中培养,每2 d更换培养液1次,待细胞长满至培养瓶底,以0.25%胰酶消化传代,取对数生长期细胞进行实验。
2.4 实验分组
本实验分为实验组:多孔淀粉负载青蒿素微球(ART-PS)组、青蒿素原药(ART)组、多孔淀粉负载青蒿素微球联合全铁转铁蛋白(ART-PS+Tf)组、青蒿素原药(ART+Tf)联合全铁转铁蛋白组以及阳性对照实验组:盐酸阿霉素(DOX)组和盐酸阿霉素联合全铁转铁蛋白组(DOX+Tf)组,共6组。
2.5 细胞的处理和检测
本实验分别对实验组:多孔淀粉负载青蒿素微球(ART-PS)组、青蒿素原药(ART)组、多孔淀粉负载青蒿素微球联合全铁转铁蛋白组(ART-PS+Tf)、青蒿素原药联合全铁转铁蛋白(ART+Tf)组以及阳性对照实验组:盐酸阿霉素(DOX)组和盐酸阿霉素联合全铁转铁蛋白组(DOX+Tf)组,培养于96孔板中的共6组细胞在生长状态良好的情况下,对每组细胞进行处理,浓度依次为多孔淀粉负载青蒿素微球(ART-PS)组的浓度为0、50、100、150和200 μmol·L-1;青蒿素原药(ART)组的浓度为0、50、100、150和200 μmol·L-1;多孔淀粉负载青蒿素微球联合全铁转铁蛋白(ART-PS+Tf)组为在1 μmol·L-1的全铁转铁蛋白溶液中浓度为0、50、100、150和200 μmol·L-1;青蒿素原药联合全铁转铁蛋白(ART+Tf)组为在1 μmol·L-1的全铁转铁蛋白溶液中浓度为0、50、100、150和200 μmol·L-1;以及阳性对照实验组:盐酸阿霉素(DOX)组的浓度为0、50、100、150和200 μmol·L-1和盐酸阿霉素联合全铁转铁蛋白组(DOX+Tf)组为在1 μmol·L-1的全铁转铁蛋白溶液中浓度为0、50、100、150和200 μmol·L-1。各组细胞在处理24 h后,在每组细胞的96孔板的每孔中,分别加入浓度为5 mg·mL-1的MTT试剂20 μL,在二氧化碳培养箱温浴4 h后,分别弃去每孔中的上清液体,在每孔中加入150 μL的二甲基亚砜(DMSO),在器中振荡作用10分钟后,使用酶标仪在波长吸光度值(OD)为490 nm下对96孔板进行检测,每组重复实验3次。细胞的生长抑制率=(对照组的OD值-空白组的OD值)/(实验组的OD值-空白组的OD值);细胞的增殖率=1-细胞的生长抑制率。
3 结果
3.1 多孔淀粉负载青蒿素微球与青蒿素原药对人肝癌细胞株的增殖抑制作用
3.1.1 人肝癌细胞HepG2
MTT结果显示(图1),在对肝癌细胞HepG2处理24 h后,多孔淀粉负载青蒿素微球(ART-PS)组与青蒿素原药(ART)组在不同浓度下,都表现出了对肝癌细胞HepG2不同程度上的抑制其增殖的作用,但在同等浓度下多孔淀粉负载青蒿素微球对肝癌细胞HepG2的抑制效果都相对没有盐酸阿霉素(DOX)组显著。当加入细胞中的浓度为50 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为19.43%,青蒿素原药(ART)组的抑制率为7.84%,盐酸阿霉素(DOX)组的抑制率为23.73%。当加入细胞中的浓度为100 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为25.22%,青蒿素原药(ART)组的抑制率为14.24%,盐酸阿霉素(DOX)组的抑制率为30.23%。当加入细胞中的浓度为150 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为34.91%,青蒿素原药(ART)组的抑制率为17.93%,盐酸阿霉素(DOX)组的抑制率为50.13%。当加入细胞中的浓度为200 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为39.55%,青蒿素原药(ART)组的抑制率为25.93%,盐酸阿霉素(DOX)组的抑制率为53.71%。分别在各处理浓度组间比较分析后,已标注出P<0.05或者P<0.01的实验组,结果具有统计学意义。在MTT的实验结果中,同等加入浓度的处理条件下,多孔淀粉负载青蒿素微球对人肝癌细胞HepG2的抑制作用显著高于青蒿素原药,并且抑制作用随着加入浓度的增大而明显增强,这是因为多孔淀粉负载青蒿素微球的颗粒粒径比青蒿素原药的颗粒粒径更小,在细胞培养液中的溶解度更高,溶出效果更好,因此在与青蒿素原药同等浓度下对细胞处理后,多孔淀粉负载青蒿素微球对肝癌细胞起到了更大的抑制效果。而多孔淀粉负载青蒿素微球在与已应用于临床的抗肿瘤药物盐酸阿霉素对肝癌细胞HepG2的抑制效果进行比较时,发现盐酸阿霉素对肝癌细胞HepG2的抑制作用更强,在低浓度50 μmol·L-1时,盐酸阿霉素对肝癌细胞HepG2的抑制率分别高于青蒿素原药和多孔淀粉负载青蒿素微球15.89%和4.3%,在高浓度200 μmol·L-1时,盐酸阿霉素对肝癌细胞HepG2的抑制率高于青蒿素原药和多孔淀粉负载青蒿素微球27.78%和14.16%。青蒿素本身是在植物中提取分离出的一种有效的生物活性分子,并不具备毒性,但当青蒿素进入癌细胞并与癌细胞中的大量的铁离子发生氧化还原反应后,产生有毒的自由基导致肿瘤细胞死亡。而盐酸阿霉素作为已经应用于肿瘤的临床治疗药物,不仅对肿瘤细胞具有很高的杀伤作用,而且对正常细胞和器官也会造成损伤,因此,对机体产生较强的毒副作用,青蒿素虽抑制效果低于盐酸阿霉素,但青蒿素对机体的毒副作用很低,并不会产生如盐酸阿霉素用药后造成的生殖毒性和遗传毒性,也不会造成其他化疗药物所带来的痛苦,因此具有很好的开发前景,对抗肿瘤生物活性分子的研发与应用具有重要的参考价值。

图1 多孔淀粉负载青蒿素微球、青蒿素原药和盐酸阿霉素在不同浓度下分别对人肝癌细胞HepG2细胞的增殖率 与空白对照组相比:*P<0.05,**P<0.01;ART与ART+Tf相比:△P<0.05,△△P<0.01;ART-PS与ART比较:#P<0.05,##P<0.01;ART+Tf与ART-PS+Tf相比:▲P<0.05,▲▲P<0.01;ART-PS与ART-PS+Tf相比:▽P<0.05,▽▽P<0.01;DOX与DOX+Tf相比:◆P<0.05,◆◆P<0.01 下同。Fig.1 The proliferation rate of hepatocellular carcinoma cells(HepG2) was determined by ART,ART-PS and DOX at different concentrations Compared with blank control group:*P<0.05,**P<0.01; Compared with ART and ART+Tf:△P<0.05,△△P<0.01; Compared with ART-PS and ART:#P<0.05,##P<0.01; Compared with ART+Tf and ART-PS+Tf:▲P<0.05,▲▲P<0.01; Compared with ART-PS and ART-PS+Tf:▽P<0.05,▽▽P< 0.01; Compared with DOX and DOX+Tf:◆P<0.05,◆◆P<0.01 The same as below.
3.1.2 人肝癌细胞SMMC-7721
MTT结果显示(图2),对人肝癌细胞SMMC-7721加入不同浓度多孔淀粉负载青蒿素微球、青蒿素原药和盐酸阿霉素处理细胞24 h后的抑制增殖作用,并对结果进行了比较和分析。多孔淀粉负载青蒿素微球(ART-PS)组与青蒿素原药(ART)组在对细胞SMMC-7721处理24 h后,也都表现出了对肝癌SMMC-7721产生了一定的抑制作用,但抑制效果明显低于阳性对照盐酸阿霉素(DOX)组,人肝癌细胞SMMC-7721的细胞增殖率随着浓度的不断增大,而呈现降低趋势,通过加入不同浓度的多孔淀粉负载青蒿素微球(ART-PS)组、青蒿素原药(ART)组与盐酸阿霉素(DOX)组对细胞的抑制强度依次是盐酸阿霉素(DOX)组>多孔淀粉负载青蒿素微球(ART-PS)组>青蒿素原药(ART)组,当加入浓度为50 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为11.31%,青蒿素原药(ART)组的抑制率为9.14%,盐酸阿霉素(DOX)组的抑制率为19.11%。当加入浓度为100 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为15.68%,青蒿素原药(ART)组的抑制率为13.97%,盐酸阿霉素(DOX)组的抑制率为24.23%。当加入浓度为150 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为20.23%,青蒿素原药(ART)组的抑制率为15.82%,盐酸阿霉素(DOX)组的抑制率为30.70%。当加入浓度为200 μmol·L-1时,多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为24.37%,青蒿素原药(ART)组的抑制率为19.62%,盐酸阿霉素(DOX)组的抑制率为45.25%。分别在各处理浓度组间比较分析后,已标注出P<0.05或者P<0.01的实验组,结果具有统计学意义。在对人肝癌细胞SMMC-7721的处理结果中,不同浓度多孔淀粉负载青蒿素微球与青蒿素原药对人肝癌细胞SMMC-7721的处理后,也都表现出了不同程度上的抑制作用,但结果与盐酸阿霉素处理后的细胞相比较,抑制作用都相对更低一些。尤其在盐酸阿霉素(DOX)组加入浓度为200 μmol·L-1时,此时对细胞的抑制效果分别高于青蒿素原药(ART)组与多孔淀粉负载青蒿素微球(ART-PS)组25.63%和20.88%。青蒿素虽然在细胞毒性方面低于现已应用与临床的药物盐酸阿霉素,但作为一种从纯天然植物中提取分离出的有效抗肿瘤生物活性分子,青蒿素原药和多孔淀粉负载青蒿素微球对人肝癌细胞SMMC-7721表现出的抑制效果,对于青蒿素在抗肿瘤活性成分的应用领域,提供了一定的理论依据。
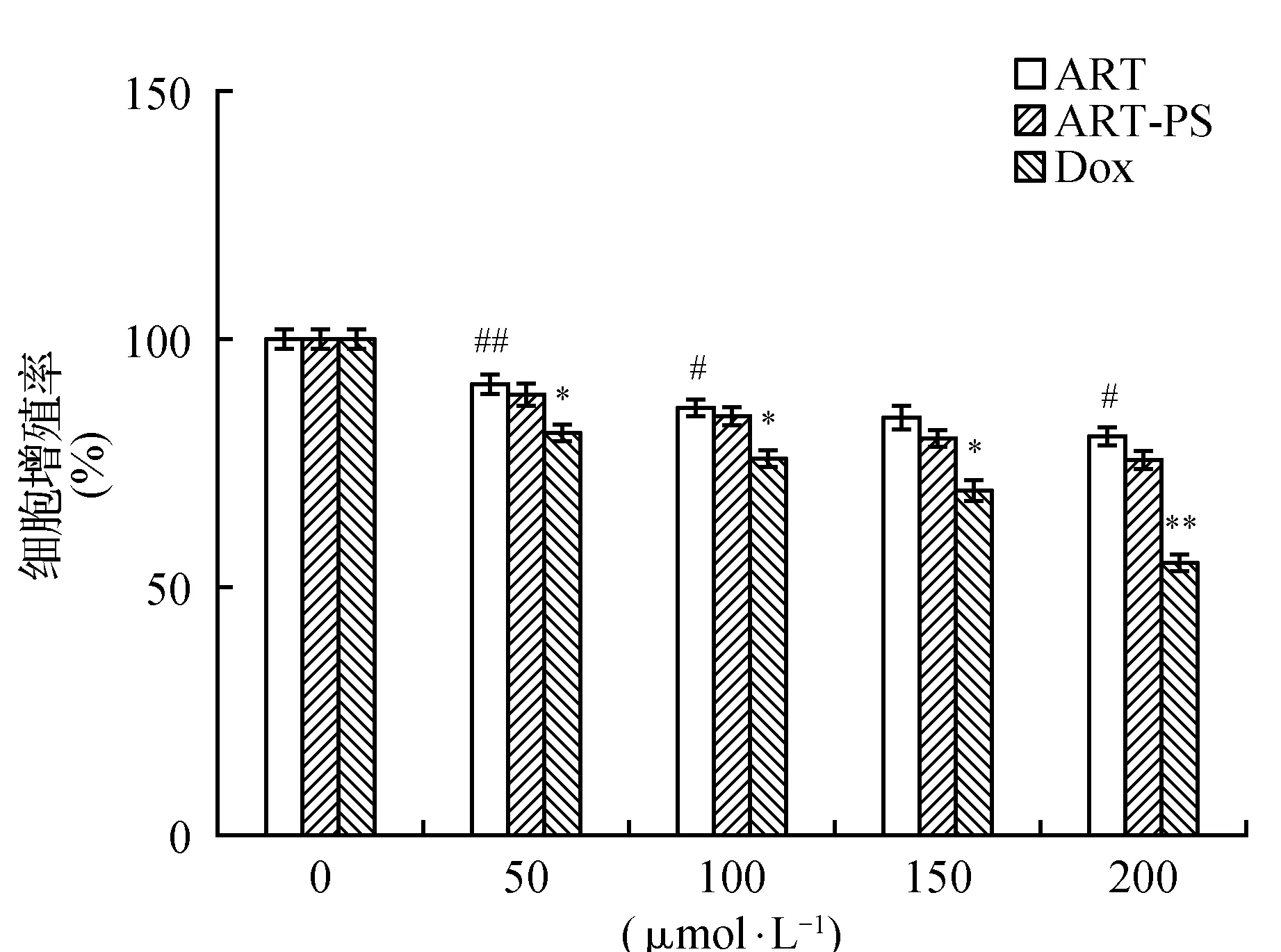
图2 多孔淀粉负载青蒿素微球、青蒿素原药和盐酸阿霉素在不同浓度下分别对人肝癌细胞SMMC-7721细胞的增殖率Fig.2 The proliferation rate of hepatocellular carcinoma cells(SMMC-7721) was determined by ART,ART-PS and DOX at different concentrations
3.1.3 人正常肝细胞HL7702
MTT结果显示(图3),对人正常肝细胞HL-7702加入多孔淀粉负载青蒿素微球、青蒿素原药和盐酸阿霉素处理24 h后的抑制增殖作用的结果进行了比较和分析。阳性对照盐酸阿霉素(DOX)组在加入细胞中的浓度为50 μmol·L-1时,对正常肝细胞HL-7702抑制率为29.11%,而此时的多孔淀粉负载青蒿素微球(ART-PS)组的抑制率为4.84%,青蒿素原药(ART)组的抑制率为4.68%。有此结果可以看出,在低浓度下,盐酸阿霉素对人正常肝细胞HL-7702具有很强的抑制作用,而当加入最大浓度200 μmol·L-1时,盐酸阿霉素(DOX)组的抑制率已经高达55.66%,而青蒿素原药(ART)组和多孔淀粉负载青蒿素微球(ART-PS)组的抑制率分别为9.99%,8.39%,都显著低于盐酸阿霉素(DOX)组,说明盐酸阿霉素确实对肝癌细胞具有较强的抑制效果,但同时对正常的肝细胞的抑制效果也非常明显,即盐酸阿霉素在治疗肿瘤的同时,对机体的正常细胞也带来了一定的毒副作用。而多孔淀粉负载青蒿素微球与青蒿素原药在加入浓度分别为50、100、150和200 μmol·L-1时,对细胞HL-7702的抑制效果分别为4.84%、5.76%、5.67%和8.39%(多孔淀粉负载青蒿素微球组),4.68%、3.74%、5.17%和9.99%(青蒿素原药组),并没有呈现出随加入浓度的增大,抑制效果增强的规律。而当加入浓度为100 μmol·L-1时,盐酸阿霉素(DOX)组的抑制率为36.10%。当加入浓度为150 μmol·L-1时,盐酸阿霉素(DOX)组的抑制率为38.47%,都显著高于同等浓度下,青蒿素原药组与多孔淀粉负载青蒿素微球的抑制效果。分别在各处理浓度组间比较分析后,已标注出P<0.05或者P<0.01的实验组,结果具有统计学意义。这一结果说明,因为正常细胞不能特异性地过量表达转铁蛋白受体,因而缺乏靶向性,使青蒿素对于正常细胞的杀伤作用非常低。这一结论,对青蒿素作为一种新型的抗肿瘤生物活性分子应用于抗肿瘤的研究中提供了重要的科学依据。

图3 多孔淀粉负载青蒿素微球、青蒿素原药和盐酸阿霉素在不同浓度下分别对人正常肝细胞HL-7702细胞的增殖率Fig.3 The proliferation rate of human normal hepatocellular cells(HL-7702) was determined by ART,ART-PS and DOX at different concentrations
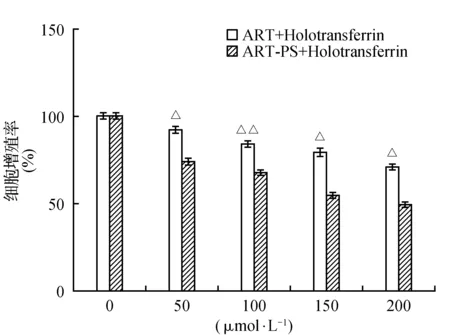
图4 青蒿素原药联合全铁转铁蛋白(ART+Tf)组和多孔淀粉负载青蒿素微球联合全铁转铁蛋白(ART-PS+Tf)组在不同浓度下分别对人肝癌细胞HepG2的增殖率Fig.4 The proliferation rates of HepG2 in human hepatocellular carcinoma cells in the ART+Tf group and the ART-PS+Tf group at different doses were determined

图5 多孔淀粉负载青蒿素微球联合全铁转铁蛋白(ART-PS+Tf)组和青蒿素原药联合全铁转铁蛋白(ART+Tf)组在不同浓度下分别对人肝癌细胞SMMC-7721的增殖率Fig.5 The proliferation rates of SMMC-7721 in human hepatocellular carcinoma cells in the ART+Tf group and the ART-PS+Tf group at different doses were determined
3.2 多孔淀粉负载青蒿素微球与青蒿素原药分别联合全铁转铁蛋白对人肝癌细胞的增殖抑制作用
3.2.1 人肝癌细胞HepG2
MTT结果显示(图4),分别对人肝癌HepG2细胞处理24 h后,将多孔淀粉负载青蒿素微球联合全铁转铁蛋白和青蒿素原药联合全铁转铁蛋白的抑制增殖作用的结果进行了比较和分析。多孔淀粉负载青蒿素微球联合全铁转铁蛋白组与青蒿素原药联合全铁转铁蛋白组相比较,当加入浓度为150 μmol·L-1时,多孔淀粉负载青蒿素微球联合全铁转铁蛋白的抑制为45.87%,而青蒿素原药联合全铁转铁蛋白的抑制率为22.02%,同样在联合全铁转铁蛋白的情况下,多孔淀粉负载青蒿素微球对肿瘤细胞的抑制效果明显强于青蒿素原药。这是因为通过多孔淀粉包合后的青蒿素,粒径变小,水溶性增大,可以更好地溶解在培养液中,与细胞中的铁离子发生氧化还原发应,产生了有毒的自由基(ROS),最终导致肿瘤细胞死亡。
3.2.2 人肝癌细胞SMMC-7721
MTT结果显示(图5),分别检测多孔淀粉负载青蒿素微球联合全铁转铁蛋白和青蒿素原药联合全铁转铁蛋白对人肝癌SMMC-7721细胞处理24 h后的抑制增殖作用,并对结果进行了比较和分析。多孔淀粉负载青蒿素微球联合全铁转铁蛋白组与青蒿素原药联合全铁转铁蛋白组相比较,当加入浓度为200 μmol·L-1时,多孔淀粉负载青蒿素微球联合全铁转铁蛋白的抑制为39.56%,而青蒿素原药联合全铁转铁蛋白的抑制率为17.94%,由数据比较可知,同样在联合全铁转铁蛋白的情况下,多孔淀粉负载青蒿素微球对肿瘤细胞的抑制效果明显强于青蒿素原药。
3.2.3 人正常肝细胞HL7702
MTT结果显示(图6),分别将多孔淀粉负载青蒿素微球联合全铁转铁蛋白和青蒿素原药联合全铁转铁蛋白对人正常肝细胞HL-7702处理24 h后的抑制增殖作用的结果进行了比较和分析。多孔淀粉负载青蒿素微球联合全铁转铁蛋白组与青蒿素原药联合全铁转铁蛋白组相比较,多孔淀粉负载青蒿素微球与青蒿素原药对人正常肝HL-7702细胞抑制作用基本相同,在浓度为200 μmol·L-1时,多孔淀粉负载青蒿素微球联合全铁转铁蛋白组的抑制率为8.34%,而青蒿素原药联合全铁转铁蛋白组的抑制率为0.76%。并没有较大差别。而当浓度为150 μmol·L-1时,可以看到,青蒿素原药联合全铁转铁蛋白后,细胞的增殖率反而升高,浓度为50 μmol·L-1时,多孔淀粉负载青蒿素微球联合全铁转铁蛋白对细胞的抑制率为0.92%,即对正常肝细胞HL-7702的生长增殖没有任何影响。结果再次表明,青蒿素对正常细胞的毒性非常低,在为正常细胞生长提供营养物质铁离子后,正常肝细胞HL-7702的生长状态较好。

图6 多孔淀粉负载青蒿素微球联合全铁转铁蛋白(ART-PS+Tf)组和青蒿素原药联合全铁转铁蛋白(ART+Tf)组在不同浓度下分别对人正常肝细胞HL-7702的增殖率Fig.6 The proliferation rates of HL-7702 in human normal hepatocellular cells in the ART+Tf group and the ART-PS+Tf group at different doses were determined
4 讨论
本文在前期研究中,选取一种新型药物载体多孔淀粉,通过多孔淀粉与青蒿素原药进行负载,成功制备多孔淀粉负载青蒿素微球,以提高青蒿素原药的水溶性。在探究多孔淀粉负载青蒿素微球的抗肿瘤活性研究中,选取肝癌细胞为模型,对比多孔淀粉负载青蒿素微球(ART-PS)与青蒿素原药(ART)在不同浓度下的抗肿瘤活性,以及分别联合全铁转铁蛋白后对肿瘤细胞的生长抑制作用。MTT结果显示,同等处理浓度下,多孔淀粉负载青蒿素微球对肿瘤细胞HepG2和SMMC-7721的抑制效果都高于青蒿素原药,但与盐酸阿霉素相比,都具有较低的细胞毒性,对正常细胞HL7702的毒副作用非常低。这是因为青蒿素作为一种纯植物提取的生物活性分子,与盐酸阿霉素不同,青蒿素具有较低的细胞毒性,在正常情况下,对细胞的毒副作用非常低,而青蒿素进入肿瘤细胞中,与细胞中高浓度的铁离子发生氧化还原反应,产生有毒的自由基(ROS),最终导致肿瘤细胞死亡,这一机制与青蒿素的抗疟机理相同。这一结果与以往的研究结果相比表现出了更好的抑制效果,本文在肿瘤细胞的基础上,加入正常细胞的抑制效果作为对比,为深入分析和探讨青蒿素的抗肿瘤生物活性提供了可靠的理论基础和实验依据[14,28]。在分别联合全铁转铁蛋白后对肿瘤细胞的生长抑制作用的结果中,多孔淀粉负载青蒿素微球的抑制效果强于青蒿素原药的抑制效果。这是因为肿瘤细胞的生长和增殖需要大量的营养物质铁离子,因此在肿瘤细胞的表面,转铁蛋白受体的表达量处于过表达状态,在离体培养的环境下,人为地在细胞培养液中添加全铁转铁蛋白(即携带着饱和的铁离子的转铁蛋白),可以使肿瘤细胞在培养液中摄入更多的铁离子进入细胞中,因此,多孔淀粉负载青蒿素微球与青蒿素原药可以与细胞中高浓度的铁离子发生反应,从而增强了多孔淀粉负载青蒿素微球与青蒿素原药对两种肝癌细胞HepG2和SMMC-7721的抑制效果。而在正常的细胞中,铁离子的含量水平远低于肿瘤细胞,因此,青蒿素不会对正常细胞造成较大的杀伤效果。
