P119驱动amiRNA介导的PL基因沉默对草莓果实硬度的影响
2019-06-06刘玥秀王小蓉汤浩茹
周 敏 蒋 丹 刘玥秀 王小蓉 汤浩茹 陈 清
(四川农业大学园艺学院,成都 611130)
草莓(Fragaria×ananassaDuch.)为蔷薇科(Rosaceae)多年生草本果树,原产于南美,在我国及世界许多国家广为栽培,资源十分丰富[1]。果实含有丰富的糖、有机酸、游离氨基酸、多种维生素及微量元素等,尤其是人体铁、钾元素的优质来源。果实中大量的多酚类化合物在抗菌、抗肿瘤、抗HIV病毒等方面具有一定的效果[2]。草莓果实是典型的非呼吸跃变型果实,它们必须在亲本植株上发育成熟,并且在完熟期或接近完熟期采摘才能达到最佳的食用品质。但其果实属浆果,柔软多汁,果皮薄,组织娇嫩,极易腐烂变质,且其生产周期短,集中上市期间室温存放2~3天就会失去商品价值。虽然生产上可采用提前采摘,但延缓草莓果实成熟软化,适当增加果实硬度,延长其货架寿命,仍是草莓生产中亟需解决的问题。
果实的硬度主要由细胞本身的机械强度以及细胞与细胞之间的相对稳定性来决定的。植物细胞壁具有刚性和弹性,在Tucker等人[3]提出的细胞壁结构“经纬”模型中:纤维素的微纤丝以平行于细胞壁平面的方向沉积,且不同层次方向各异,构成了细胞壁的“经”;结构蛋白(富含羟脯氨酸的蛋白)由异二酪氨酸交联成结构蛋白网,垂直于细胞壁平面排列,构成细胞壁的“纬”。半纤维素和果胶等胶体填充于经纬网络中,与次生壁共同作用,保持细胞与细胞之间的相对位置,使植物细胞与细胞间具有高稳定性。其中,果胶主要由同聚半乳糖醛酸聚糖(Homogalacturonan,HG),Ⅰ型鼠李糖半乳糖醛酸聚糖(RhamnogalacturonanⅠ,RGⅠ)和Ⅱ型鼠李糖半乳糖醛酸聚糖(RhamnogalacturonanⅡ,RGⅡ)三类聚糖组成,在确定细胞壁孔隙度、控制细胞离子转运和渗透性方面起着重要作用,也能调节细胞生长和分化,定位和抑制植物病原体进入细胞[4~5]。Uluisik等人[6]的最新研究进一步丰富了果胶的作用:果胶形成的聚合物呈主链、支链交叉状,使其与纤维素微纤丝紧密结合在一起,更利于纤维素微丝在细胞壁中的交联。另外的研究也表明,果实成熟软化主要是由于皮层薄壁组织细胞壁胞间层的降解增加了果胶释放[7],从而允许细胞间相对空间位置发生滑动。在这一生理过程中,果胶酶包括果胶酯酶(Pectin Methyl Esterase,PME)、聚半乳糖醛酸酶(Polygalacturonase,PG)和果胶裂解酶(Pectate lyase,PL),通过一种可控的方式以及一系列有序的调节过程分解果胶[8]。因此,影响这些酶活性的条件在一定程度上均能影响果实的硬度和软化的进程。而果胶裂解酶不同于其他降解果胶的酶,它主要通过β-转移和消除机制作用于果胶,优先裂解高等植物中胶层和初生细胞壁的β-1,4-半乳糖醛酸残基,被认为是通过分子改良果实硬度、阻止果实软化的优秀候选酶之一[9~10]。
在延缓草莓果实软化进程的研究中,Jimenez-bermudez等[11]采用35S启动子驱动PL基因进行反义RNA的转录,获得了41个转反义PL基因的草莓株系,果实中PL基因表达量下降30%,但有33个株系的产量显著下降。以Pel1和Pel3两个株系对其成熟果实进行组织学切片观察,与对照相比,转基因草莓的细胞间隙更小,而细胞与细胞间的接触面积更大,因此硬度更大。而这41个株系中有3株草莓没有结实,与果胶裂解酶的活性与花粉粒萌发以及花粉管的伸长有关相一致[12]。因此,组成型表达进行系统性PL基因的沉默必然带来不利的影响。遗憾的是,在非呼吸跃变型果实(如草莓)中,关于成熟相关的启动子区域信息的研究相当有限。目前大多数应用的果实特异性启动子都是从番茄中分离鉴定的。比如,P119果实特异性启动子在番茄中驱动RNAi介导PL基因沉默时取得了显著的成效:在不影响产量和果实品质的基础上,增加了番茄果实硬度的同时延长了其货架寿命[6,13]。
由于稳定遗传转化耗时较长,目前在果实发育机理的研究中,瞬时基因表达技术的应用日益广泛,但瞬时表达技术受到的限制因素较多,虽已有不少报道成功利用草莓果实进行了瞬时表达基因功能验证[14~15],但多利用传统的组成型启动子表达。若应用于稳定转化,对植株的自然生长发育有一定影响。番茄果实是典型的呼吸跃变型果实,与草莓有很大的差异,因此这些时空特异性启动子的应用仍有待验证。
本研究选取番茄P119时空特异性启动子,驱动草莓果实amiRNA介导PL基因沉默,通过沉默后果实硬度变化,着色过程观察,并综合果实发育过程中的大绿期、白熟期、转色期、片红期、全红期的果胶裂解酶活性变化,分析amiRNA干扰PL基因在延缓草莓果实软化中的作用,为p119果实特异性启动子在草莓中的应用打下基础。
1 材料与方法
1.1 植物材料
‘红颜’草莓(Fragaria×ananassaDuch ‘Benihoppe’)为栽培较广的优良品种,成熟后果实品质好,但硬度低,质地绵软,不耐储运,是研究果实软化进程的典型材料。于2017年12月从四川农业大学崇州教学科研实习基地,参考Fait等[16]的方法,选取大绿、白熟、转色、片红以及成熟期5个不同发育阶段果实。保证发育期相同,无机械损伤、无病虫害,于冰盒中1 h内运回实验室进行测定。
1.2 果胶裂解酶活性及果实硬度的测定
果胶裂解酶测定参考Payasi等[17]的方法。果肉用0.05 mol·L-1磷酸钠缓冲液,0.02 mol·L-1盐酸半胱氨酸和1% Triton X-100进行匀浆,14 000 r·min-14℃离心30 min,上清液为粗酶液。取2.5 mL 1%多聚半乳糖醛酸酶溶液,1.0 mL 0.01 mol·L-1CaCl2,1.5 mL酶液,混匀后37℃保温3 h,加0.4 mL ZnSO4·7H2O缓冲液(9%)与0.3 mL 0.5 mol·L-1NaOH终止反应。将混合液3 000 r·min-1离心15 min,取2.5 mL上清,加入1.5 mL 0.04 mol·L-1硫代巴比妥酸,0.75 mL 0.1 mol·L-1HCl和0.25 mL水,沸水浴30 min,冷却后在550 nm下测定吸光度值。
果实硬度采用GY-B型果实硬度计测定,每个时期测定20个果实,每个果实测定两次。以果实赤道外缘为基准,取点1或2处测定果皮硬度,取平均值。
1.3 P119基因的启动子获得
参照Chen等改良的CTAB法[18]提取micro-Tom番茄叶片总DNA。根据番茄p119基因启动子序列设计两条引物p119、f119(表1),采用PCR进行启动子扩增。反应体系为50 μL,包括模板DNA 0.5 μL,GXL polymerase 1 μL,5×GXL Buffer 10 μL,dNTP mixture 4 μL,上下游引物各1 μL。PCR扩增程序为98℃预变性10 s;98℃变性10 s,60℃退火15 s,68℃延伸150 s,30个循环;68℃再延伸5 min,12℃保存。按照产品说明书使用SanPrep柱式PCR产物纯化试剂盒进行PCR产物回收。
1.4 amiFaPL载体的构建
1.4.1 amiRNA靶点的设计
栽培草莓为八倍体,基因组中可能存在多个编码PL的位点。以NCBI登录的栽培草莓PL转录本(DQ076239)为种子序列,在课题组转录组测序[19]获得的‘红颜’草莓Unigene中进行同源搜索(blastN,e-value<0.00001,匹配长度>200 bp)。比对上的序列作为候选基因转录本。于WMD3(http://wmd3.weigelword.org)在线软件进行靶点筛选设计(Fragaria×ananassaPUT v183,minimum number of included targets=1)。挑选设计好的amiRNA靶序列,能靶向上一步获得的所有PL序列即为所得的amiRNA序列。
1.4.2 amiFaPL前体设计及结构预测
草莓Pre-amiFaPL的序列设计根据AtMIR390a前体序列(Accession:MI0001000)的碱基偏好性进行替换:Forwar doligonucleotide链的X1-X21用设计好的amiRNA替换;Reverse doligonucleotide的X1-X19与Forwar doligonucleotide链X21-X1互补配对,其中X9与Forwar doligonucleotide链的X11配对具有碱基偏好性(G-A,C-U,A-G,U-C)。分别在序列两端增加KpnⅠ和BamHⅠ两个酶切位点后,由上海生物工程(生工)公司进行合成。合成的序列保存到pUC57载体上,并于ViennaRNA Services(RNAfold server)预测设计pre-amiFaPL序列的二级结构。
1.4.3 amiFaPL沉默载体的获得
将pUC57-amiRNA载体通过KpnⅠ和BamHⅠ双酶切获得amiRNA片段,接入中间载体pCambia1301-35SN;再以KpnⅠ和EcoRⅠ双酶切pCambia1301-35SN-amiFaPL载体,接入pMDC83-35S-egfp载体以替换酶切位点;用HindⅢ和SalⅠ双酶切pMDC83-35S-amiFaPL载体,以去除35S启动子,最后采用同源重组的方式接入p119基因的启动子(ClonExpress Entry One Step Cloning Kit),获得最终目标载体。检测正确的质粒送上海生工生物工程有限公司检测确认。
1.5 瞬时转染白熟期草莓果实
测序确认的重组质粒通过冻融法转化根癌农杆菌GV3101,经过菌液PCR检测确认后(菌液PCR检测体系为:菌液1 μL,上下游引物M13FOR-L、amiRNA-FaPL各1 μL,2×PrimeStar Mix 10 μL,ddH2O补足至20 μL。程序为98℃预变性5 min;98℃变性30 s,60℃退火30 s,72℃延伸150 s,35个循环;72℃再延伸10 min,12℃保存),参考Chen等[20]的方法,离体注射白熟期草莓果实。农杆菌于YEB培养基中培养至OD600=1,室温下4 000 r·min-1离心15 min,去上清。加入相同体积的MMG(1 mol·L-1MgCl20.5 mol·L-1MES(pH=5.6),0.2 mol·L-1Acetosyringone)于黑暗中孵育4 h。室温下4 000 r·min-1离心15 min后,将菌体调至OD600=0.8~1.0后进行果实注射,每果实0.5 mL,以注射清水为对照。重复3组,每组10个果实。注射后的果实25℃,14 h光照8 000 lx,10 h黑暗进行正常培养,拍照记录果实变化情况。
1.6 注射后草莓采样及保存
以果实表皮100%着色为商品成熟度标准,当对照组果实达到100%着色时,以GY-B型果实硬度计测定果实硬度。将草莓果实纵切,一半用于硬度的测定,随机选取两点测定果实皮层硬度;另一半液氮速冻后保存在-80℃用于后续试验的开展。
1.7 RT-PCR分析PL基因相对表达量
采用改良CTAB法[18]提取沉默处理和H2O处理草莓果实总RNA,经电泳检测及核酸蛋白测定仪测定浓度后,参照反转录试剂盒(宝生物)说明书合成cDNA用于后续PCR试验。根据克隆得到的草莓PL核酸序列,在miRNA靶点外设计半定量引物PL-1F和PL-1R,并以actin-smF和actin-smR(表1)为内参引物。同时采用实时荧光定量PCR技术进行PL表达量分析(表1)。半定量PCR体系为:稀释10倍的cDNA作为模板,上、下游引物各1 μL,2×Taq Master Mixture 10 μL,ddH2O 7 μL。扩增程序为94℃ 5 min;94℃ 30 s,58℃ 30 s,72℃ 35 s,设置梯度循环数寻找最佳循环。在最佳循环数下进行处理组和对照组的PCR扩增,每个处理3组,每组重复3次。于QuantityOne(v4.6.2)软件中计算灰度值。定量PCR在CFX96(BioRad,美国)荧光定量PCR上进行,反应体系为20 μL,含10 μL SYBR Green mix(上海生工,含2 mmol·L-1MgCl2),上游引物PL-RTF 10 μmol·L-1,下游引物PL-RTR 10 μmol·L-1。采用三步法进行扩增:95℃预变性2.5 min,40个循环扩增(95℃变性15 s,52℃退火30 s,72℃延伸30 s)。每循环延伸结束进行荧光采集。最后95℃维持15 s,65℃起按0.5℃步进升温至95℃,每步维持5s并采集荧光信号。内参采用actin-RTF和actin-RTR为引物。采用2-ΔΔCt进行表达量计算。

表1 试验所用引物
注:引物序列中小写字母为同源重组接头序列。
Note:The adaptor sequences for recombinationreaction were showed as lowercase letters in the primer.

图1 果实成熟过程中果胶裂解酶活性及硬度的变化BG.大绿期;W.白熟期;TR.转色期;PR.片红期;FR.全红期Fig.1 The changes of the Pectate lyase activity andfirmness in fruit ripening process BG.Big green; W.White; TR.Turning red; PR.Partial red; FR.Full red
2 结果与分析
2.1 草莓果实果胶裂解酶活性及硬度的相关性
草莓果实中PL的活性变化与果实硬度变化的结果如图1所示:果胶裂解酶活性总体上呈增加的趋势。果实在大绿到白熟果胶裂解酶活性低,随着草莓果实的发育,果胶裂解酶活性逐渐增加,尤其在转色期后,果胶裂解酶活性急剧增加,于全红期达最大。与之相反,果实硬度在果实发育过程中逐渐降低,尤其在大绿到转色期这一过程中。随后硬度降低的速度减缓。值得注意的是,果胶裂解酶活性在果实前期(转色期之前)虽然有轻微波动,但总体差异较小,而这个时期的果实硬度呈迅速下降趋势,反而在后期果胶裂解酶活性增加迅速,但果实硬度减小放缓。因此可以推断果胶裂解酶对果实发育后期的软化起着重要的推动作用,但除果胶裂解酶活性外,还有其他因素参与果实前期的果实软化的过程。

图2 FaPL序列多重比对及amiFaPL靶点预测(*为靶位点)Fig.2 Multiple sequence alignment of FaPLs and amiFaPL target prediction(indicated with asterisk marks)
2.2 amiRNA-PL靶点的选择和载体构建
以DQ076239.1为种子序列比对转录组Unigenes共获得了2条PL转录本序列。其中DN83964_c4_g9_i1长度为1 581 bp,DN83964_c4_g9_i2长度为1 484 bp。多重序列比对显示(图2),该转录本包含有109 bp 5′UTR区,具有15个SNP位点。相较DQ076239,DN83964转录本3′端多编码了43个氨基酸。而两条转录本之间,i1比i2多一个长度为97 bp的内含子保留(intron retention)。
通过WMD3在线软件,设计得到amiRNA靶序列:5′-ATGGCTGATGGTGATGGTATA-3′。该靶点可以同时靶向这2个PL转录本(图2)。根据碱基偏好性以AtMIR390a前体序列将人工合成的amiRNA进行替换,再利用ViennaRNA Services预测设计好的amiFaPL前体序列结构。如图3A所示,所选择的miRNA前体基因序列转录后可以形成典型的颈环结构。通过中间载体的替换,最后成功构建了干扰载体P119::amiFaPL(图3B)。
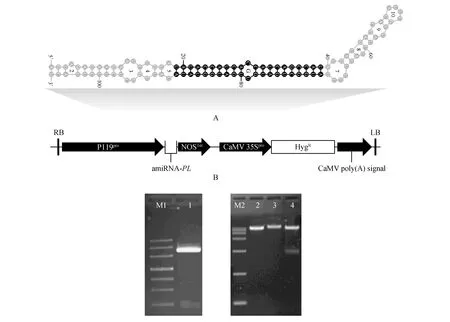
图3 amiFaPL前体二级结构预测(A)及amiFaPL重组载体构建(B) M1.对应条带大小分别为200,500,800,1 200,2 000,3 000,4 500 bp;泳道1.P119启动子PCR扩增产物电泳结果;M2.D15000 marker,对应条带大小分别为250,1 000,2 500,5 000,7 500,10 000,15 000 bp;泳道2.pMD83空载;泳道3.重组质粒;泳道4.重组质粒BamHⅠ酶切鉴定Fig.3 The predicted secondary structure of amiFaPL transcript(A) andthe T-DNA region of the constructed amiFaPL plasmid(B) M1.DNA marker III,the size for each band equals to 200,500,800,1 200,2 000,3 000,4 500 bp respectively; Lane 1.Amplification of P119 promoter; M2.DNA marker D15000,the bands correspond to 250,1 000,2 500,5 000,7 500,10 000,15 000 bp in size; Lane 2.Empty vector of pMD83; Lane 3.The recombinant plasmid DNA; Lane 4.BamHⅠ digested recombinant plasmid DNA

图4 PL沉默对草莓果实着色及果实硬度的影响 A.PL沉默对果实着色进程的影响;B.实时荧光定量PCR检测amiRNA介导的PL基因沉默相对于对照(清水注射)的相对表达量;C.PL基因沉默对草莓果实硬度的影响 **表示t检验极显著差异(P<0.01);*表示t检验差异显著(P<0.05)Fig.4 Effects of PL silencing on the appearance and fruit firmness of strawberry A.Coloring process of strawberry fruits subjected pectate lyase gene silencing; B.Relative expressions of PL genes in fruits with P119::amiRNA-PL infiltration detected by Real-time quantitative PCR; C.Affection of PL gene silencing on fruit firmness ** and * indicate significantly different(P<0.01) or different(P<0.05) through student’st test respectively
2.3 PL沉默对草莓果实颜色发育及果实硬度的影响
为进一步确认PL在草莓果实成熟软化过程中的作用,我们对P119驱动下离体瞬时表达amiFaPL的果实进行了分析。从沉默处理开始,处理组和对照组果实转色集中在注射后的第3~4天,两者并没有出现显著性差异(图4A)。至注射后第4天,对照组果实96.7%全红,而处理组也达到96.7%果实全红。因此,PL的沉默并不会干扰果实中花青素苷的积累。与对照组相比,半定量PCR结果表明amiRNA介导的基因沉默后PL的表达量显著下降,这一结果也得到了定量PCR结果的验证(66.5±18.6%)(图4B)。该结果表明,P119这一果实特异性启动子在草莓果实中仍然具有活性。虽然两组处理在颜色变化上同步,但果实全红时,PL沉默组的果实硬度显著高于对照组(图4C)。以上结果表明,沉默PL可以延缓草莓果实软化进程,但不会影响草莓成熟的着色过程。
3 讨论
果实的软化是果实成熟的重要标志,同时也是影响果品货架期以及果品商品价值的重要因素[9]。对多数水果而言,通过有序的,适当的软化,伴随着复杂的生理和生化变化如糖酸的变化,挥发性物质的代谢等,从而形成特有的品质特征。而过快的软化限制了果品的运输和销售范围。如何能控制果实软化的进程,同时又不会干扰果实成熟过程中的其他变化,如色泽的积累、香气的形成和营养成分的汇聚是很多相关育种工作者努力的方向。
果实硬度是反应果实成熟软化的指标,主要取决于细胞的膨压以及细胞壁的完整性[21],而细胞壁组分的有序变化和结构的重构是其中的关键因素。在果实发育过程中,多聚半乳糖醛酸酶PG、果胶酯酶PE、果胶裂解酶PL、纤维素酶(Cellulases,Cel)以及膨胀素(Expansin,EXP)等在细胞壁的变化中起着不同的作用。PE水解果胶分子链上半乳糖醛酸羧基上的酯化基团,形成可供PG消化的果胶酸,PG随机切除果胶分子的1,4-2-D-半乳糖苷键从而使得果实软化。同样的,PL则随机裂解中胶层和初生细胞壁的β-1,4-半乳糖醛酸,主要是影响了由果胶紧密链接纤维素微丝、半纤维素形成的稳定结构,从而达到果胶结构的裂解促进果实软化。这些酶通过程序化的产生,促进了果实的软化。因此这些酶及其编码基因都是作为成熟软化调控的靶标。在‘丰香’草莓中,PG在果实的白果期已有表达,并在后期迅速升高,全红期又开始下降[22]。而反义抑制PG表达,可以明显降低草莓软化程度[23~24]。相反,PE则在多数情况下被认为不是果实软化的关键酶[25]。近期的研究表明,PL在果实软化过程中的作用超过了PG和PE。RNAi引发的PL基因沉默可以非常有效的延缓番茄的软化过程,而其他的生长以及果实品质形成均不受影响[6]。但这一结论在不同的物种中表现并不一致。在草莓中,PL的沉默确实会显著增加果实的硬度,但果实普遍较对照减小,座果率也不同程度的受到影响,产量锐减[7]。其主要原因可能是PL参与的细胞壁的结构调节过程除了在果实中以外,还在诸如幼嫩器官的生长,花粉的活力等方面发挥作用。因此组织特异性干扰PL的表达可能是解决该问题的途径之一。
在周鹤莹等的研究中,森林草莓基因组编码了至少3个果胶裂解酶基因:PLA,PLB和PLC,并且在草莓各器官中均有表达[26]。在本研究中,因为栽培草莓基因组序列的不完整,尚不能获得准确的编码基因数目。但在栽培草莓‘红颜’中的PL至少有两个转录本,两个转录本之间是否存在组织特异性或功能分化目前尚不清楚。但同森林草莓一致的是,PL的活性随着果实的成熟而增加,同时伴随着果实硬度的减小(图1),进一步证明PL在草莓果实软化中起重要作用。通过人工设计miRNA同时靶向这2个PL基因,沉默效率为35%左右,较报道的amiRNA效率低[27],究其原因可能是因为试验采用的是瞬时表达系统。同时,也可能与番茄的P119启动子的活性在草莓果实中并不高有关。试验中采用了清水对照,该处理在前期的试验中与空载农杆菌并没有表现出显著差异。尽管如此,在草莓果实中沉默PL可以显著增加果实硬度,同时不会对果实正常着色产生影响,这与Jiménez-Bermúdez等[11]的结果一致,进一步证明PL是一个良好的调控靶标。在果实特异性启动子的驱动下,PL的沉默是否会影响植株的营养生长和坐果等,有待于稳定的遗传转化研究。
