可降解多孔纯锌支架表面Mg-P生物活性涂层的制备与表征
2019-06-05贾高智袁广银
侯 懿,贾高智,黄 华,袁广银
(上海交通大学 轻合金精密成型国家工程研究中心,上海 200240)
近几年,锌合金作为一种新型可降解医用金属材料受到了广泛的关注[1-4].锌是人体所必需的微量元素之一,对细胞生长和分化、免疫系统以及神经系统都起着重要的调节作用[5-6].此外,相比于镁合金,锌合金因拥有更适中的低降解速率而更适于用作可降解多孔支架的材料.但是,由于多孔结构对降解的加速作用导致Zn2+快速大量释放,多孔锌表现出较强的体外细胞毒性.而理想的骨组织工程支架材料,必须具备良好的生物相容性[7-8],以保证前期种子细胞的体外黏附、铺展、增殖、分化等基本细胞活动以及后续组织的长入.因此,为了成功地将多孔锌应用于骨组织工程,必须进一步地提高多孔锌的细胞相容性.
表面涂层是一种有效改善材料表面耐腐蚀性能和生物相容性的技术,其在生物医用可降解镁合金表面已经取得了显著成效.Wang等[9]采用脉冲电化学沉积法在Mg-Zn-Ca合金表面制备了一层缺钙型的羟基磷灰石(HA)涂层,HA涂层与镁合金基体的结合强度高达41.8 MPa.涂层覆盖后,合金的耐腐蚀性能显著提高,极限抗拉强度高于裸金属,合金的服役时间得到延长.Niu等[10]利用化学转化法在JDBM(Jiao Da Bio-Magnesium)镁合金表面制备了一层二水磷酸氢钙(DCPD)涂层,涂层与基体的结合力超过10 MPa.DCPD涂层不仅能够有效增强JDBM镁合金在 Hank’s 溶液中的抗腐蚀性能,还显著降低了合金表面的溶血率,提高了合金对成骨细胞的相容性.同时,动物实验结果也证实了Ca-P涂层能够显著降低前期JDBM镁合金骨板、骨钉的降解速率和氢气释放量,使骨板、骨钉的力学完整性延长10周以上.此外,与磷酸钙类涂层相似,磷酸镁类涂层也具有良好的生物相容性,并且能够激活成骨细胞的分化与功能、促进新骨的形成,是很有前景的骨科植入材料的表面改性涂层[11-12].Ishizaki等[13]结合化学和低热处理方法在AZ31镁合金表面制备一层50 μm厚的磷镁石(MgHPO4·3H2O)涂层,涂层覆盖后AZ31合金的腐蚀电流密度下降了2个数量级,且涂层显示出良好的亲水性.
然而,现阶段对于可降解锌合金的研究大都还停留在对合金体系的开发上[4],鲜有关于可降解医用锌合金表面涂层的研究报道.显然,较高浓度的Zn2+所引起的较强的体外细胞毒性[14-15],是将多孔锌合金进一步推向骨组织工程的临床应用所必须要解决的问题之一.针对该问题,本文采用化学转化法在孔隙率为75%的多孔纯锌样品表面成功制备了一种Mg-P生物活性涂层,表征了涂层的形貌、厚度、成分和结合力,并且对有或无涂层覆盖的多孔纯锌样品的降解行为和细胞的相容性进行了系统的对比研究.
1 材料制备与试验方法
1.1 材料和涂层的制备方法
以渗流铸造法制备所得的孔隙率约为75%的多孔纯锌样品为研究对象,采用化学转化法在该多孔纯锌表面制备了具有生物活性的Mg-P涂层.具体操作过程如下:
(1)预处理.在超声条件下,将多孔纯锌样品用60 ℃ 的0.5 mol/L的NaOH和Na2CO3混合溶液清洗15 s,以去除表面的油脂和部分氧化皮,随后用去离子水和无水乙醇冲洗干净,晾干待用.
(2)将预处理好的多孔纯锌样品浸泡在Mg-P处理溶液中(配方见表1)12 h后,取出清洗并晾干,即获得覆盖有Mg-P涂层的多孔纯锌样品.

表1 Mg-P涂层处理溶液配方Tab.1 The composition of Mg-P treating solution
1.2 涂层的表征
采用扫描电子显微镜(SEM,FEI,美国)观察了Mg-P涂层覆盖后多孔纯锌的表面和截面形貌,并利用EDS能谱附件(Oxford INCA,英国)以及XRD衍射仪(D/MAX 2550 Rigaku,日本)分析了其表面化学元素和物相组成.随后,采用划痕法测试了Mg-P涂层与纯锌基体的结合力.根据阿基米德原理,利用密度天平测定了有无涂层的多孔锌样品的孔隙率.
1.3 浸泡试验
首先将尺寸为∅10 mm×2 mm的多孔纯锌样品用体积分数φ=75%的酒精消毒20 min以上,然后转移至超净台内,正反两面分别用紫外线照射 2 h.将消毒好的样品放置在12孔细胞培养板内,加入3 mL DMEM培养液,然后放入细胞箱中(37 ℃,φ(CO2)=5%).每0.5周更换一次培养液,测定浸提液的pH值、渗透压以及Zn2+浓度.
1.4 细胞毒性评价
利用有或者无涂层的多孔纯锌样品的浸提液间接地评价了其对MC3T3-E1细胞的细胞毒性.细胞培养采用DMEM培养基(Gibco,美国),并加入φ=10%的胎牛血清(FBS,Gibco,美国)和φ=1%的青霉素/链霉素(双抗P/S(Gibco,美国),原始浓度为 10 000 U/mL,配制后的浓度为100 U/mL,其中U是抗生素的效价单位),培养箱的环境温度为37 ℃,φ(CO2)=5%.试验使用第3~8代细胞,以保证细胞的活性.
浸提液的制取参照ISO 10993-5:1999标准进行.将消毒后∅10 mm×2 mm的多孔纯锌支架按照1.25 cm2/mL 的比例浸泡在DMEM培养液中(多孔样品的表面积按其等尺寸的块体样品表面积计算),放入培养箱中处理72 h.取上清液经0.22 μm孔径的无菌滤器过滤后,再加入φ=10%的FBS和100 U/mL的P/S,即得到浸提液(φ=100%).使用含FBS和P/S的DMEM可进一步将浸提液稀释至φ=10%.
试验过程:将细胞以2×104个/mL的浓度接种到96孔板内,每孔100 μL,置于细胞培养箱内培养24 h,使细胞充分贴壁.随后用100 μL的浸提液替换原来的培养液,培养到1、3、5 d时,每孔加入10 μL cck-8试剂(碧云天,中国),继续培养2 h后,用酶标仪测定试验组和对照组在450 nm波长处的吸光度(OD),根据吸光度结果计算细胞活性:
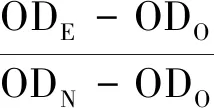
(1)
式中:下标N表示阴性组,为采用完全培养基培养的细胞;下标O表示空白组,为不含细胞的培养基;下标E表示试验组.

图1 Mg-P涂层覆盖前后多孔纯锌样品表面的微观形貌(SEM照片)Fig.1 The SEM micrograph of porous pure Zn scaffolds
1.5 细胞黏附试验
细胞黏附试验是将细胞直接种植在样品表面,通过观察细胞在材料表面的黏附与增殖情况,来研究材料表面的细胞相容性.首先将消毒后的多孔纯锌样品置于含FBS的DMEM培养基中浸泡2 h,使蛋白充分黏附在样品表面.随后将预泡好的多孔锌样品置于12孔板内,取100 μL配置好的MC3T3-E1细胞悬液(密度为1×106个/mL)滴加在样品表面,放入培养箱孵育20 min后,加入4 mL DMEM培养基,再放回细胞培养箱内继续培养12 h、3 d、7 d后,用Live/Dead试剂盒(Invitrogen,美国)对细胞进行染色,并在荧光显微镜(奥林巴斯IX71,日本)下观察细胞的黏附形态(Live/Dead染料配方:5 mL PBS+10 μL EthD-1+2.5 μL Calcein-AM).
2 结果与讨论
2.1 涂层的表征及其形成机制
图1所示为有无涂层的多孔纯锌样品的表面SEM形貌照片.由图可见:原始多孔纯锌样品呈现三维贯通的开孔结构且孔壁表面较为光滑,仅存在少量的氧化皮(图1(a)和(b));Mg-P涂层样品依旧保持原始多孔锌样品的开孔结构,但其表面均匀覆盖了一层结晶状涂层(图1(c)和(d));低倍SEM照片中(图1(c)),Mg-P涂层呈现团簇状结构,均匀地铺展在多孔纯锌样品表面;在高倍SEM照片中(图1(d))可以清晰地观察到每一簇都是由更为细小的条束状涂层晶粒以发散式取向堆积而成,团簇结构之间以相互抵触的方式衔接覆盖在整个多孔纯锌样品表面.

图2 显示Mg-P涂层与锌基体结合力的SEM照片Fig.2 The SEM micrograph for the adhesion of Mg-P coatings to zinc substrate
从 Mg-P涂层样品的截面SEM图片(见图2(a))可以发现:Mg-P涂层与多孔纯锌基体表面之间的结合十分致密,不存在明显孔隙;结合面凹凸不平,说明在涂层形成过程中多孔纯锌表面发生了溶解;涂层的厚度不完全均匀,平均厚度约为10 μm.无涂层多孔锌样品的孔隙率为(76.06±0.6)%,而涂层覆盖后样品的孔隙率变为(71.49±0.62)%,下降了约4.5%.图2(b)所示为采用划痕法测试涂层与纯锌基体之间结合力后的表面形貌,可以发现测试后在划痕附近的涂层依然与纯锌基体紧密结合,几乎没有涂层剥落的现象,说明Mg-P涂层与纯锌基体之间的结合力较强.采用化学转化法制备的涂层与基体能够形成化学结合,因而往往具备较强的结合力,而且Mg-P涂层与基体之间的结合部位十分致密,完全不存在任何的孔洞(见图2(a)),也能够保证其具备较强的结合力.
图3(a)所示为Mg-P涂层样品表面的EDS能谱分析结果,Mg-P涂层的主要成分为C、O、Mg、P以及Zn元素,涂层极有可能为含Mg的磷酸盐;图3(b)所示为Mg-P涂层的XRD谱图,进一步证实Mg-P涂层主要成分为(Mg0.62Zn0.38)Zn2(PO4)2·4H2O和Zn3(PO4)2·4H2O.
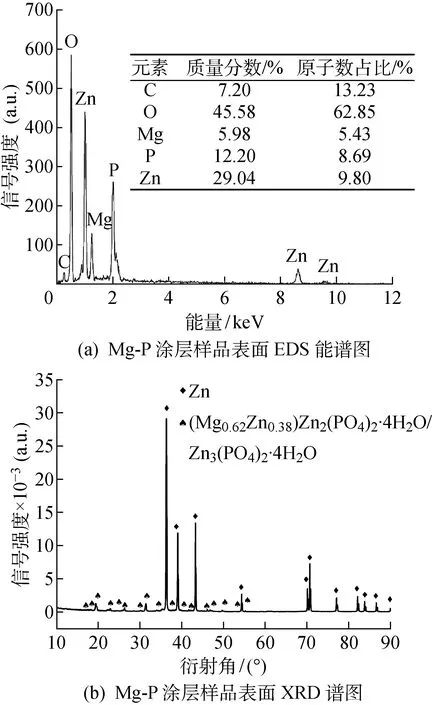
图3 Mg-P涂层样品表面的EDS能谱分析和XRD谱图Fig.3 The EDS and XRD spectra of the surface of Mg-P coated porous pure Zn sample
Kouisni等[16]使用Na2HPO4、H3PO4、NaNO3、NaNO2以及Zn(NO3)2的混合溶液处理AM60镁合金表面,在合金表面形成了一层结晶状的 Zn3(PO4)2·4H2O涂层,并研究了其形成机制.当AM60镁合金浸泡在磷酸盐处理溶液中后,随着其表面的Mg发生阳极溶解产生Mg2+,

(2)
在阴极位置发生如下反应:

(3)
从而导致局部的pH值上升,诱导Mg3(PO4)2和 Zn3(PO4)2·4H2O 分别以下述过程形核:
(4)
Zn3(PO4)2·4H2O+3H2↑
(5)
随着Mg的继续溶解,式(4)和(5)的形核过程向右方向进行,但只有Zn3(PO4)2·4H2O晶粒能够优先生长不断变大,随后相互接触在镁合金表面形成一层相对致密的Zn3(PO4)2·4H2O涂层.
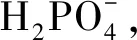

(6)
在阴极位置处H+被还原产生H2(式(3)),导致局部的pH值上升,这将有利于难溶磷酸盐的析出过程[17].此时,Zn3(PO4)2·4H2O依旧按照式(5)的方式析出形核,而溶液中存在的Mg2+能够参与到Zn3(PO4)2·4H2O的形核与长大过程中,从而在涂层中生成了(Mg0.62Zn0.38)Zn2(PO4)2·4H2O,

50(Mg0.62Zn0.38)Zn2(PO4)2·4H2O+119H2
(7)
随着反应的不断进行,涂层晶粒相互接触形成一层完整的涂层并不断地增厚,直到溶液中的反应离子浓度下降到平衡浓度时涂层停止生长.
2.2 涂层对多孔纯锌降解行为的影响
图4所示为有无涂层的多孔纯锌样品浸泡在DMEM培养液中的Zn2+质量浓度(ρZn2+)、pH和渗透压(p)随浸泡时间(t)的变化情况.由图4(a)可知,Mg-P涂层覆盖后多孔纯锌的Zn2+释放速率显著降低,尤其在第1周最为明显,其Zn2+释放量仅为无涂层多孔锌样品的0.2~0.3倍.这是因为Mg-P涂层覆盖后能够有效地将溶液与锌基体表面隔离开来[18],从而起到降低多孔锌基体表面溶解速率的作用.随着浸泡时间延长,无涂层的多孔锌样品的Zn2+释放速率逐渐降低,到第4周时约为最初的1/3,这表明浸泡在DMEM培养液中后,多孔锌表面能够逐渐生成一层腐蚀产物,起到一定的保护作用,且随着浸泡时间的延长,该保护层逐渐致密且不断加厚,使其保护效果越来越好[19].而Mg-P涂层样品的Zn2+离子释放速率一直保持在一个比较低的水平,呈现出良好的抑制腐蚀降解的效果.
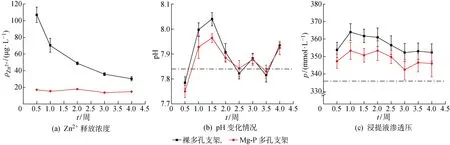
图4 有无涂层的多孔纯锌样品在DMEM培养液中的浸泡试验结果Fig.4 The immersion test of porous pure Zn scaffolds with and without Mg-P coating in DMEM
从图4(b)可以发现,浸泡过程中有无涂层样品浸提液的pH值都比原始DMEM培养液稍有升高,尤其在前2周较为明显,但最高时均未超过8.1.同时,有无涂层的多孔纯锌样品的浸提液渗透压也均较原始DMEM高(见图4(c)),渗透压的升高表明有离子或分子溶入DMEM中,无涂层样品的渗透压比Mg-P涂层处理后样品的更高,这正好与Zn2+的释放量相对应.
2.3 涂层对多孔纯锌细胞毒性的影响
采用浸提液法间接评价了有无涂层的多孔纯锌样品对MC3T3-E1细胞的细胞毒性.表2所示为有无涂层样品浸提液的pH、渗透压和Zn2+质量浓度.浸提液的pH值、渗透压以及Zn2+质量浓度都明显高于原始的DMEM培养液,且无涂层样品的相应参数值比Mg-P涂层支架更高,这与浸泡试验结果相对应.
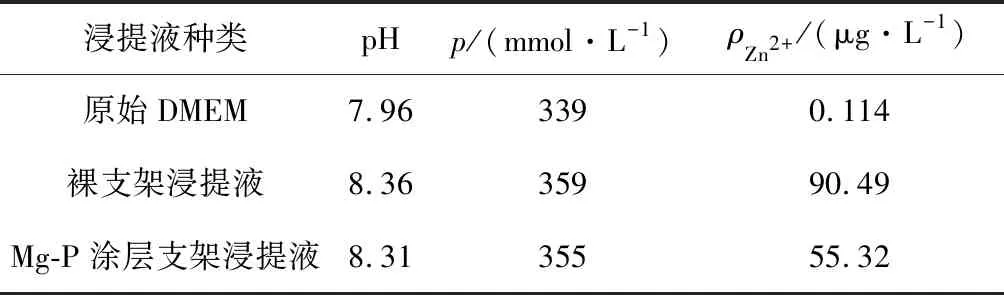
表2 多孔纯锌样品浸提液的相关参数Tab.2 The parameters of porous pure Zn samples
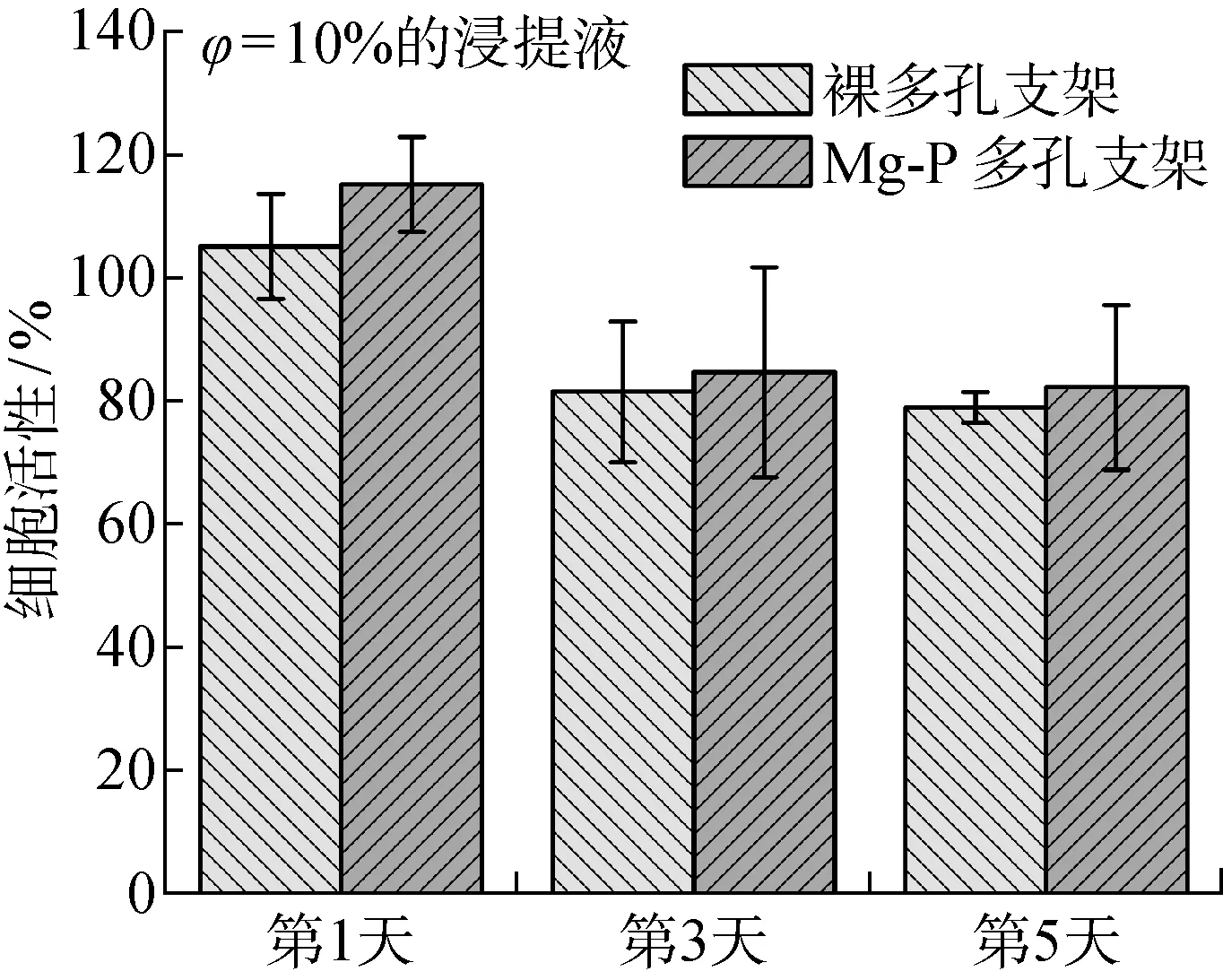
图5 多孔纯锌支架对MC3T3-E1细胞的细胞毒性Fig.5 The cytotoxicity evaluation of porous pure Zn scaffolds to MC3T3-E1 cells
有研究者提出采用浸提液法评价可降解材料的细胞毒性时,应适当地将其浸提液稀释6~10倍以更好地模拟体内环境[20].用φ=10%的浸提液培养MC3T3-E1细胞的细胞毒性的结果如图5所示,可见:无涂层多孔纯锌样品的细胞活性仅在第1天超过90%,第3天和第5天分别下降到了约50%和30%,说明无涂层样品φ=10%的浸提液依旧具有一定的细胞毒性;而Mg-P涂层样品的细胞活性在第1天超过了100%,虽然第3天和第5天稍有下降,但均在85%以上,说明φ=10%的Mg-P涂层样品浸提液基本无细胞毒性,Mg-P涂层显著提高了多孔纯锌的细胞相容性.现有研究结果表明低浓度的Zn2+能够促进成骨[21],但是较高浓度的Zn2+具有较强的细胞毒性[14].无涂层多孔纯锌样品和Mg-P涂层样品φ=10%的浸提液的Zn2+质量浓度分别为9 μg/L和5.5 μg/L,这说明当培养液中的Zn2+质量浓度小于5.5 μg/L时,对MC3T3-E1细胞不产生明显毒性.根据以上分析可知,具有生物活性Mg-P涂层能够有效降低多孔纯锌样品的Zn2+释放速率,从而大大提高其细胞相容性,具有潜在的应用价值.

图6 MC3T3-E1细胞在裸多孔纯锌支架上直接培养不同时间的Live/Dead染色照片Fig.6 The morphology of MC3T3-E1 cells adhering on the surface of the porous pure Zn samples without Mg-P coating by Live/Dead staining
2.4 涂层对多孔纯锌表面细胞黏附和增殖行为的影响
图6和7所示为MC3T3-E1细胞在有无涂层的多孔纯锌样品上直接培养12 h、3 d和7 d后的Live/Dead染色照片.在无涂层多孔锌表面,由于Zn2+释放较快,导致样品表面Zn2+浓度和pH值较高,细胞没能黏附到样品表面,培养到12 h时,细胞已全部呈球形且均已死亡.随着培养基的不断更换,死细胞被不断地带走,到第3天和第7天时,样品上已基本观察不到细胞.对于Mg-P涂层样品,培养12 h时,样品表面的大部分细胞还活着,且黏附形态不错,说明Mg-P涂层能够显著提高多孔纯锌表面的细胞相容性,但此时样品上已经出现少量死细胞;当培养到第3天时,样品表面细胞明显较12 h时少,且仅有少量细胞呈现铺展形态,大部分细胞呈现为球形;到第7天时,样品表面细胞全都呈现为球形且已经死亡.这表明尽管Mg-P支架提高了多孔纯锌表面的细胞相容性,但其表面的物理化学环境依旧不适合MC3T3-E1细胞的长期黏附与增殖.

图7 MC3T3-E1细胞在有Mg-P涂层的多孔纯锌支架上直接培养不同时间的Live/Dead染色照片Fig.7 The morphology of MC3T3-E1 cells adhering on the surface of the porous pure Zn samples with Mg-P coating by Live/Dead staining
通常,细胞的黏附、铺展和增殖行为会受到很多界面性能的影响,譬如表面化学性质和表面形貌[18].Mg-P涂层能够在一定程度上抑制Zn2+从多孔纯锌表面释放,从而降低多孔纯锌表面的局部Zn2+浓度,提高多孔纯锌的细胞相容性.同时,相比于光滑表面,成骨细胞在微米级的粗糙表面上的黏附行为和功能性更好,有研究发现当粗糙度Ra>2 μm时,随着粗糙度的增加,MC3T3-E1细胞的骨桥接蛋白表达随之上升[22].从SEM照片可见,Mg-P涂层的粗糙度明显大于5 μm,这也能对MC3T3-E1细胞的黏附起到一定的促进作用.但由于Mg-P涂层的厚度仅有10 μm,对多孔锌的保护作用依旧不足,其表面的Zn2+浓度还是不适宜MC3T3-E1细胞的长期黏附.因此,后期研究可以通过调整涂层的制备工艺来增加涂层的厚度和致密度,以更进一步地提高多孔纯锌的生物相容性,使其满足临床应用需求.
3 结论
利用化学转化法成功地在多孔纯锌表面制备了一层Mg-P生物活性涂层,系统地表征了涂层的形貌、成分、厚度和结合力,并研究了涂层对可降解多孔纯锌的降解行为和细胞相容性的影响.根据研究结果可以得出以下结论:
(1)Mg-P涂层由细小的条束状涂层晶粒以发散式取向堆叠而成的团簇构成,团簇之间相互抵触衔接,覆盖在整个多孔锌表面.
(2)涂层与纯锌基体之间形成致密的化学结合,结合力较强,涂层的平均厚度约为10 μm;涂层覆盖后多孔纯锌样品的孔隙率下降了约4.5%,但依旧保持良好的连通性.
(3)Mg-P涂层能有效降低多孔纯锌样品前期的Zn2+释放速率,从而提高多孔纯锌的细胞相容性,具有很好的应用前景.
