慢病毒载体介导miR-146a转染大鼠骨髓间充质干细胞的实验研究
2019-06-04买买提沙吾提阿吉麦麦提
买买提沙吾提阿吉·麦麦提, 马 原, 朱 旭
(新疆医科大学1第六临床医学院, 2第六附属医院脊柱外一科, 乌鲁木齐 830002)
椎间盘突出症(LDH)是造成腰腿痛的重要原因,继发于椎间盘突出的人体自身免疫反应、炎性刺激及机械压迫均与LDH的发生发展有着密切关系。细胞因子介导的炎症反应,影响着椎间盘退变。研究显示,突出的椎间盘髓核中基质金属蛋白酶3、白细胞介素1、白介素6、肿瘤坏死因子α等含量显著增加,且其含量的增加与疼痛评分显著相关[1-2]。随着分子生物学与基因工程的发展基因重组技术为LDH的预防和治疗带来希望。微小RNA 146a miR-146a是一种能通过下调靶基因IL-1受体相关激酶1(IRAK1)和TRAF6从而对促炎症因子的表达进行负反馈调节的microRNA[3-4]。本研究通过体外实验培养BMSCs并转染miR-146a慢病毒载体,以实现外源目的基因在BMSCs中持续稳定表达,为基因修饰干细胞治疗腰椎间盘突出症开创新的思路并提供实验依据。
1 材料和方法
1.1 实验动物SPF级健康的SD大鼠8只,雌雄不限,3~4周龄,体质量80~100 g,实验动物由新疆医科大学实验动物中心提供,所有实验过程均符合伦理学标准。
1.2 主要试剂与仪器miR-146a慢病毒载体(Lenti-miR-146a-EGFP)及miR-146a对照空白慢病毒载体(Lenti-EGFP)(上海吉凯基因化学技术有限公司);TRAF6兔抗鼠单克隆抗体,IRAK-1兔抗鼠多克隆抗体(Abcam,美国),Western Blot试剂盒,反转录试剂盒,CO2恒温培养箱(Thermo公司,美国),IX71荧光倒置相差显微(Olympus公司,日本),胎牛血清(美国Gibco公司),DEME低糖培养基(美国Cyclone公司),第一链合成试剂盒试剂盒(TIANGEN,北京),荧光定量检测试剂盒(SYBR Green,TIANGEN,北京)。
1.3 大鼠骨髓间充质干细胞(BMSCs)的分离、培养及鉴定采用贴壁筛选法获取大鼠BMSc将SD大鼠脱颈处死,75%乙醇浸泡15 min,无菌环境下取出两侧股骨及胫骨,剥离软组织,剪断骨骺端,用含10%的FBS的低糖DMEM培养液反复冲洗骨髓腔至髓腔发白,再用100目的细胞滤网过滤,1 000 r/min离心5 min,弃上清,用完全培养基(10%FBS,90%低糖DMEM,1%双抗)重悬细胞后接种于培养瓶内,置于37℃、5%CO2、100%饱和湿度的培养箱进行培养。48 h半量更换培养液,此后每3~4天更换一次培养液,贴壁细胞融合达80%时用0.25%的胰酶消化,按1∶2的比例进行传代接种培养至第3代后流式细胞技术鉴定表面标志物(CD45、CD90、CD106)。
1.4 慢病毒感染BMSCs的转染复数值(MOI)测定取处于对数生长期的第3代BMSCs,用0.25%胰酶消化,制成细胞重悬液,以细胞密度1×104/孔接种至96孔板。培养2~3 d,直至细胞融合度达50%左右,按3个不同MOI值(10、50、100)添加病毒液和终质量浓度为5mg/L的聚凝胺。阴性转染组只添加含有EGFP空病慢病毒液,按操作说明书进行转染,每个MOI值设3个复孔,共转染24 h后更换新鲜培养基。转染后每24小时在倒置荧光显微镜下观察各组细胞EGFP表达情况,在100倍下,每个样本随机选取5个视野,计数100个细胞,转染率=绿色荧光细胞数/细胞总数×100%。评估转染效率,筛选最适转染复数值。
1.5 携带miR46a-EGFP基因的慢病毒转染大鼠BMSCs取第3代BMSCs,按5×105个/孔密度接种于6孔板,将实验分为Lenti-miR-146a-EGFP基因转染组(A组)、Lenti-EGFP基因转染组(B组)及未转染组(C组)3组,每组设2个复孔。A、B组按最佳MOI值分别加入重组慢病毒液miR-146a-EGFP及Lenti-EGFP空病毒上清液,按说明书进行转染。C组加入2 mL完全培养液。
1.5.1 实时荧光定量PCR检测 转染完成7 d后使用E.Z.N.A. Total RNA Kit I试剂盒提取细胞的总RNA,用miRcute miRNA cDNA第一链合成试剂盒RNA转化成cDNA,然后应用miRcute miRNA荧光定量检测试剂盒配置20 μL 进行miRNA实时荧光定量PCR检测,最后使用Primix Ex TaqTM II(Tli RNaseH Plus)试剂盒miRNA靶基因实时荧光定量。应用荧光定量PCR仪进行检测。以未处理细胞作为对照,定量引物序列F-primer:TGAGAACTGAATTCCATGGGTT使用Primer6设计,由上海生工生物工程股份有限公司合成。使用2-△△CT计算miR146的表达量。
1.5.2 Western Blot检测miR-146a靶蛋白TRAF6及IRAk-1 转染14 d后,提取A、B、C 3组细胞的总蛋白,采用BCA法进行蛋白定量,制备SDS-PAGE凝胶,电泳将蛋白质转移至PVDF膜上。将PVDF膜转移至封闭液中,封闭90 min: 加入一抗IRAk-1稀释至1∶1 000,TRAF6稀释至1∶2 000,4℃,过夜。次日以TBST稀释二抗,PVDF膜与二抗室温孵育2 h。显色观察,进行灰度分析。
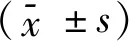
2 结果
2.1 大鼠BMSCs的分离、体外培养及鉴定原代BMSCs培养第1周内细胞体积较小,呈梭形或多角形贴壁生长,倒置显微镜下亦可见圆形,不贴壁的悬浮细胞(图1)。5~7 d内细胞达80%~90%融合,随着传代次数的增加细胞体积开始增大,梭形突起变长,排列有明显方向性,成漩涡状、鱼群样排列,不贴壁细胞开始减小(图2)。平均7 d可铺满培养瓶底达90%融合。流式细胞技术检测SD大鼠BMSCs表面标志物CD45低表达、CD106、CD90高表达、CD45低表达,符合BMSCs特征(图3)。

图1 原代BMSCs体外培养第3天(×100)

图2 体外培养的第3代BMSCs(×100)
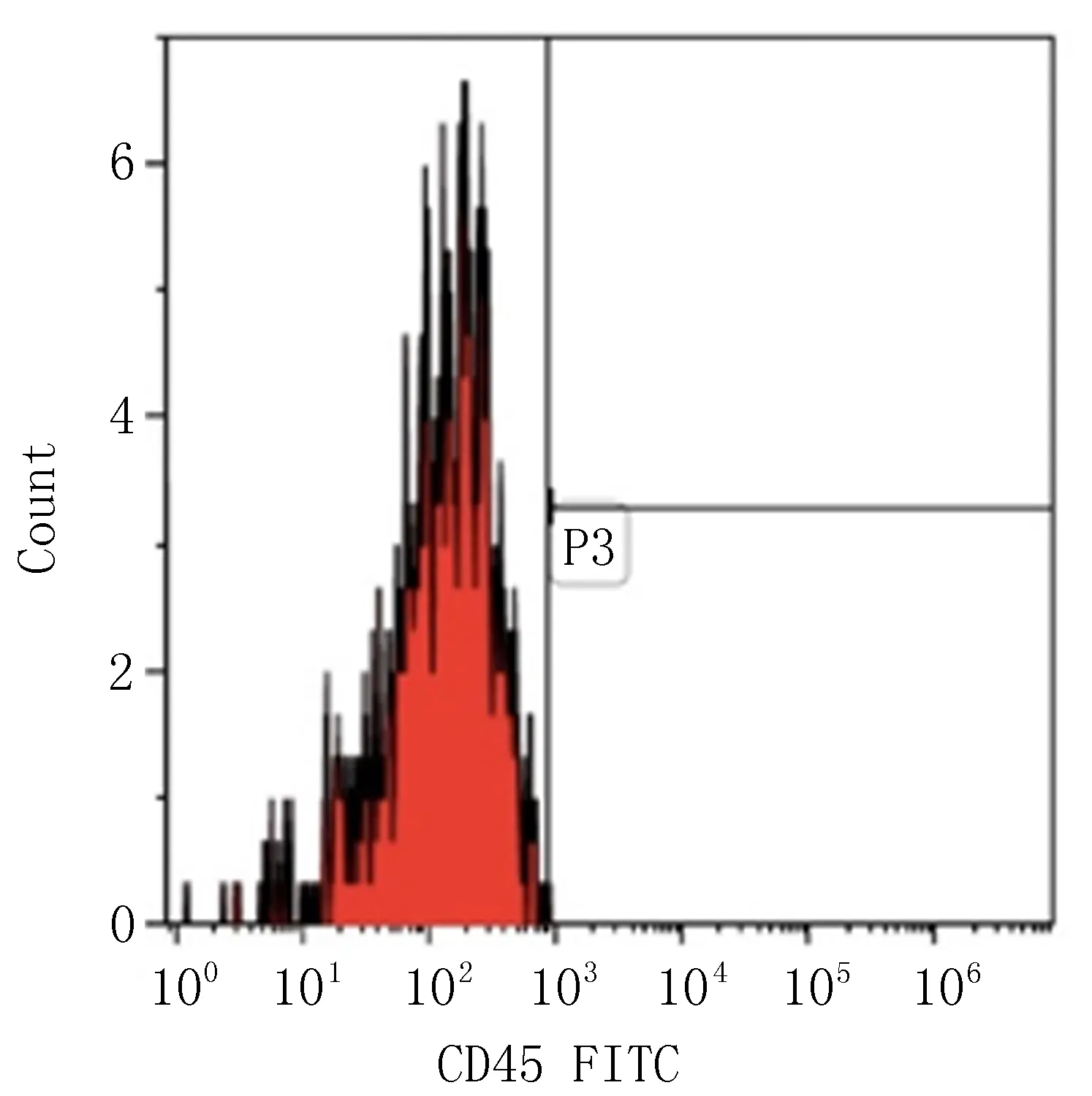


CD45 CD106 CD90
2.2 目的基因在小鼠骨髓间充质细胞中的表达
2.2.1 荧光倒置相差显微镜下观察BMSCs 用重组慢病毒mir-146a-EGFP,以MOI值为10、50、100 分别转染大鼠BMSCs 96 h后,荧光倒置相差显微镜下观察并比较被转染各组细胞,重组慢病毒miR-146a-EGFP转染BMSCs 24 h小时胞浆内均可见较弱的绿色荧光,48 h带绿色荧光蛋白EGFP的阳性细胞逐渐增多,胞浆内荧光强度增强,96 h后带绿色荧光蛋白的细胞增多,并趋于稳定(图4),在MOI=50时悬浮的细胞最小,不影响细胞活力,结果表明MOI=80时是最佳感染条件,感染率为80% (图5)。
2.2.2 实时荧光定量PCR检测目的基因miR-146a的表达 实时荧光定量PCR检测后3组细胞的miR-146a基因表达水平比较,A组miR-146a基因表达水平明显高于B、C组,差异有统计学意义(P<0.05)。B、C 2组miR-146a表达水平无统计学意义(P>0.05)(表1)。提示用重组慢病毒miR-146a-EGFP转染BMSCs成功并能持续较长时间稳定表达miR-146a基因。



24 h(×100) 48 h(×100) 96 h(×100)
图4 MOI=50时重组慢病毒转染BMSCs后


荧光显微镜下观察 普通显微镜下观察
表1 miR-146a的相对表达量
2.2.3 Western blot法检测慢病毒转染后大鼠BMSCs中TRAF6和IRAK-1蛋白的表达Western blot结果显示B组蛋白TRAF6和IRAK-1表达水平与C组相比较,差异无统计学意义(P>0.05)。A组TRAF6和IRAK-1蛋白水平表达低于B组、C组(图6)。3组细胞中内参表达水平无显著差异。提示BMSCs中高表达的miR-146a参与炎症反应相关蛋白TRAF6和IRAK-1的调控。

图6 转染2周后miR-146靶蛋白的表达
3 讨论
椎间盘突出症是指椎间盘局限性突出,刺激、压迫神经组织并导致相应症状的一种脊柱退变性疾病,是造成腰腿痛的重要原因之一。人一生中有60%~90%的人发作过腰腿痛,其中有5%的人每年都发作。腰痛的病因众多,包括腰椎退变性疾病和腰椎结构病变、炎症反应、感染、肿瘤等因素都可引起腰痛。研究结果发现神经受到刺激后发生的炎性反应是引起腰椎间盘突症疼痛的机制。当机械压迫后神经根血管血液回流受阻,改变血管的通透性和增加炎症介质的产生,神经根受激惹,致使相应的神经支配区疼痛[5]。目前炎性细胞因子对疼痛的影响研究中最受关注的有IL-1、IL-6、TNF-α。在临床LDH患者血清中的 IL-1含量明显高于正常人,经过治疗后该物质显著降低[6]。朴起范等[7]研究显示,LDH大鼠血清中IL-1、IL-6含量也増加。同时,显微镜下观察LDH大鼠背根神经节发现细胞出现鞘膜消失、空泡样变等炎症现象。临床及动物实验均证实了LDH的机体中出现了神经根的炎症反应。
miRNA是非编码RNA分子,长约22个核苷酸并参与转录和翻译调节。miRNA通过与信使RNA(mRNA)的3′端非翻译区结合导致mRNA降解或抑制[8]。因此,miRNA在细胞增殖、分化和凋亡中发挥着重要作用并成为先天性和获得性免疫应答免疫应答的关键调节因子。miR-146a位于人类5号染色体的LOC285628基因上。miR-146a主要在T细胞、B细胞、巨噬细胞和单核细胞等免疫细胞中表达并诱导免疫细胞成熟或激活[4]。有学者研究出在骨关节退行性变的鼠关节脊髓背角miR-146a 表达水平明显改变改变[9],而另一项神经病理性疼痛大鼠实验结果显示坐骨神经结扎大鼠第7、14天海马中 miRNA-146 表达下调[10]。本研究证实,miR-146a可通过抑制其主要的两个靶基因IRAK-1和TRAF6表达发挥作用。 IRAK-1和TRAF6在的TLR信号传导中起着至关重要的作用。细菌脂多糖(LPS)刺激TLR-4并通过IRAK1/TRAF6产生信号级联反应最终激活NFκB和AP-1转录因子和免疫应答基因的表达。虽然科学家们先前已经报道过几种TLR-4信号的负反馈机制,但Taganov等[11]首先提出了miR-146家族的作用。用LPS刺激Thp-1细胞后发现,miR-146a 是LPS反应基因,进一步研究发现,miR-146a上调与NF-κB信号通路有密切关系。在使用荧光素酶报告子结构验证IRAK1和TRAF是miR-146a,并提出miR-146a的上调是TLR-4信号的负反馈调节。Krishnan等[12]也报道了在体外用不同细胞因子处理人视网膜上皮细胞后发现IL-1β处理后miR-146a的上调最明显。这些数据表明miR-146a在调节免疫反应中的独特作用。本实验通过将miR-146a在BMSCs中过表达后观察到其抑制与免疫调节相关的TRAF6和IRAK-1,但是未进行体内实验,不能观察到机体内过表达的miR-146a能不能有效抑制炎症因子的产生从而达到治疗作用,因此在机体内的过表达miR-146a对炎症因子的作用需要进一步证实。
作为一种组织工程的新型技术,通过病毒载体的重组表达已用于多种体内体外实验[13-14]。通常用于重组表达的病毒载体有五种,即:腺病毒、重组腺相关病毒、单纯疱疹病毒、逆转录病毒和慢病毒。本实验所使用的慢病毒由于宿主细胞范围广,外源性基因在宿主细胞中容易整合,持久而稳定表达。此外慢病毒感染宿主细胞后不会再感染其他细胞,也不会利用宿主细胞复制新的病毒颗粒,因此该病毒具有极高的生物安全性[15]。本实验通过EGFP标记的重组慢病毒载体介导miR-146a在体外成功高效转染大鼠BMSCs细胞,转染后的BMSCs在荧光显微镜下细胞胞体增呈大多角形,胞质伸展相互交错,胞质内充满绿色荧光物质,确定了慢病毒的最佳感染复数MOI=50,转染效率约为(80.0±5.2)%。进一步采用MOI=50的慢病毒转染BMSCs,采用荧光倒置相差显微镜下观察,应用qRT-PCR与Western Blot技术检测,结果证明miR-146a-EGFP可成功高效转染目的细胞。A组在miRNA及蛋白水平表达上与B组、C组相比有明显的统计学差异。本部分研究结果证实miR-146a可在BMSCs持久稳定表达,这为基因治疗腰椎间盘突出引起的腰腿痛提供了长期稳定表达miR-146a的种子细胞,并下一步过表达的miR-146a治疗椎间盘突出症压迫神经根引起的疼痛的实验研究奠定基础,提供了一种新的定位、定量示踪转基因干细胞的方向。
