膳食营养素与炎症性肠病关系研究进展
2019-06-04杨小冰金明玉吴小禾吴小勇
杨小冰,金明玉,吴小禾,尹 辉,吴小勇*
(1.广东药科大学公共卫生学院,广东 广州 510310;2.中山火炬职业技术学院生物医药系,广东 中山 528436;3.广东药科大学生命科学与生物制药学院,广东 广州 510006;4.广东药科大学食品科学学院,广东 中山 528453)
蛋白质、脂类、碳水化合物是人体必需的三大宏量营养素,在机体的免疫和代谢调节中发挥着至关重要的作用,并日益成为疾病膳食营养干预治疗及保健食品研发的主要焦点[1-2]。炎症性肠病(inflammation bowel disease,IBD)是一组病因尚不明确的肠道慢性炎症病变,包括溃疡性结肠炎(ulcerative colitis,UC)和克罗恩氏病(Crohn’s disease,CD),近年来在我国的发病率大幅上升,且IBD的发病机制复杂,主要包括遗传因素和环境因素,其中饮食是重要的环境因素之一[3]。本文对近年来膳食脂肪、蛋白质、碳水化合物三大营养素对IBD发病机制影响及IBD的饮食干预治疗策略等方面的研究进行综述。
1 炎症性肠病
1.1 炎症性肠病的概述
IBD是一组以肠道炎症性细胞浸润、肠黏膜受损为主要表现的肠道慢性炎症病变,包括UC和CD[4]。在病理上UC以结肠黏膜的弥漫性炎症为特征[5],而CD主要表现为溃疡、慢性肠道贯壁性破坏及增殖性炎症改变[6]。这两种疾病均可见于儿童及成年人,20~40 岁患者较多。IBD的发病多数缓慢,隐匿病史常数月或数年,交替出现于活动期与缓解期,亦有持续活动而不缓解者,少数急性发病类似急性阑尾炎[7-8]。
在过去25 年里,高收入国家IBD的流行性已经增加了2~3 代[9]。在北美和欧洲,分别有超过150万、200万 人患有IBD[10]。最新的流行病学研究表明,南美洲、东欧、亚洲和非洲的发病率可能正迅速上升;在发展中国家,IBD也已成为主要的健康问题之一[10]。例如,在中国,IBD已从罕见变为常见,且已占用胃肠和结直肠手术病床的1/4[9]。IBD严重危害患者的健康,且发生恶变的概率明显高于正常人,因此,寻求其科学有效的诊断、预后以及治疗手段至关重要[11]。目前IBD的药物治疗以抗炎剂及免疫抑制剂为主,常见的研究如抗肿瘤坏死因子治疗、靶向淋巴细胞转运到胃肠道的抑制剂等,但以药物治疗为靶点的研究结果喜忧参半,且IBD的药物治疗未满足医疗需求的问题仍然存在[12]。此外,营养疗法也已用于IBD的治疗,但其作用机理尚不明[13]。进一步深入研究IBD的发病机制对日后探索更为有效科学的干预治疗策略有重大意义。
1.2 炎症性肠病的致病因素及发病机制
目前认为IBD是由遗传、免疫及环境等多个因素相互作用所致的[14]。由遗传、环境及肠道菌群的改变结合起来刺激引起的异常免疫反应,进而导致慢性肠道炎症,被认为是IBD的发病机制(图1)[15-16]。IBD的遗传分析已经确定了与UC或CD风险相关的200多个基因座[11]。肠道免疫系统对肠道病原菌的过激反应被认为是IBD发生的原因之一[4](表1)。此外,流行病学和临床证据表明,IBD与多种环境因素有关[15]。其中饮食在肠道功能和免疫活动中起着重要的作用,且食物成分在肠道内的微生物代谢可影响肠道上皮屏障及黏膜免疫系统(图2)。饮食在肠道菌群、肠道屏障功能、免疫系统及表观遗传方面起着重要的作用,并有望为日后探索IBD饮食干预措施提供理论依据。
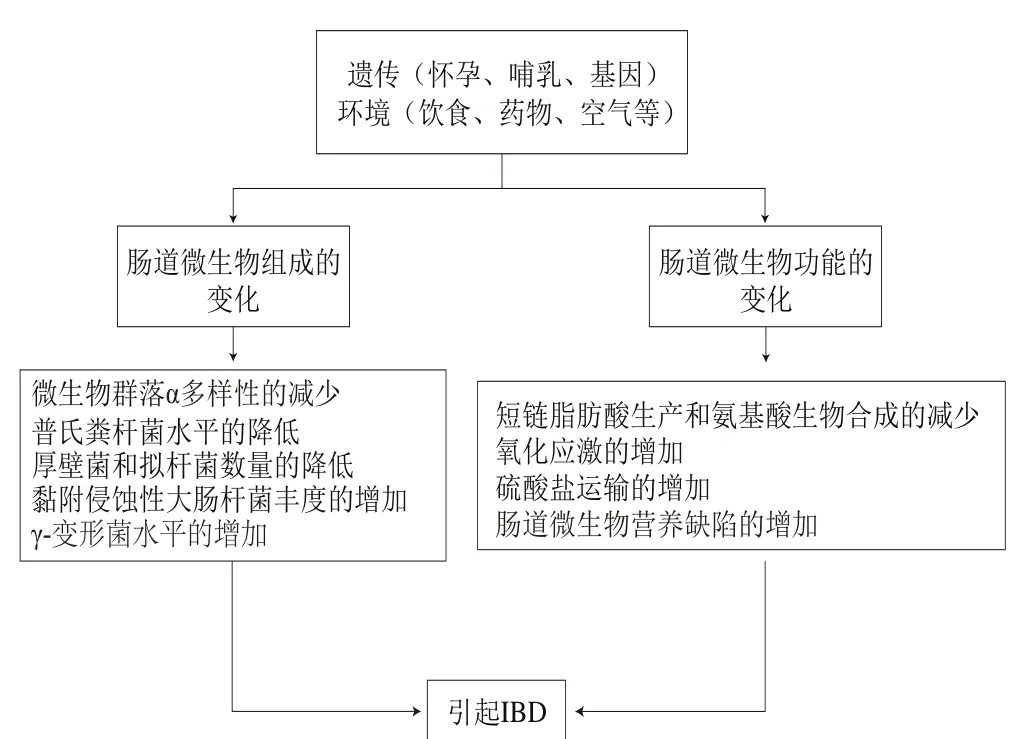
图1 遗传、微生物、饮食等联合作用于肠道内稳态[15-16]Fig.1 Combination of genetics, microbiology and diet plays a role in intestinal homeostasis[15-16]

表1 肠道微生物与炎症性肠病Table1 Intestinal microorganisms and inf l ammatory bowel disease

图2 食物成分与肠道微生物群落的关系[11,28-30]Fig.2 Relationship between food composition and intestinal microbial community[11,28-30]
2 膳食营养素对炎症性肠病影响的流行病学证据
IBD在北美和欧洲始终保持高发病率趋势[10]。近年来,随着人们饮食习惯逐渐西方化(即高脂、高糖、高蛋白低纤维饮食),IBD在亚洲多数发展中国家的发病率也在不断上升,与许多其他复杂的免疫疾病一样,IBD的发生与膳食营养、饮食习惯及生活方式关联密切[3]。流行病学调查结果显示:高脂摄入增加IBD的发病风险(表2),膳食动物蛋白摄入量的增加可能促进IBD的发生(表3),膳食纤维摄入量与IBD发病率呈负相关(表4)。

表2 膳食脂肪对炎症性肠病影响的流行病学证据Table2 Epidemiological evidence for the effect of dietary fat on inf l ammatory bowel disease

表3 膳食蛋白对炎症性肠病影响的流行病学证据Table3 Epidemiological evidence for the effect of dietary protein on inf l ammatory bowel disease

表4 膳食碳水化合物对炎症性肠病影响的流行病学证据Table4 Epidemiological evidence for the effect of dietary carbohydrate on inf l ammatory bowel disease
3 膳食营养素对炎症性肠病发病机制影响
3.1 膳食脂肪对炎症性肠病发病机制的影响
膳食脂肪的类型对IBD的发病机理可能有特定的影响(表5)。高脂饮食通过使肠道菌群失调、破坏肠道屏障、改变固有免疫及其与遗传风险的组合作用导致IBD的发生[3]。

表5 膳食脂肪对肠道内稳态的影响Table5 Effect of dietary fat on homeostasis in the intestine
不合理的饮食结构(尤其是饱和脂肪酸的摄入增加)与肠道菌群失调密切相关[11]。而肠道菌群紊乱可引发肠道炎症及激活肠道大麻素系统,进而增加肠道通透性,导致肠腔中脂多糖(lipopolysaccharide,LPS)大量入血,引发全身慢性低度炎症[39]。研究发现,摄入ω-3 PUFA有助于减轻高脂饮食对肠道屏障的损伤,进而减少LPS入血,有效改善全身慢性低度炎症状态[39]。
肠道屏障是半渗透性的,可通过管腔内负载的微生物保护机体。研究表明,长期高脂饮食可破坏小鼠肠道屏障的完整性,引起紧密连接蛋白(如闭锁小带蛋白1(zonula occuludens-1,ZO-1))表达下降,进而增加肠道通透性,最终导致LPS进入体循环引起低度炎性反应[3]。此外,乳化剂作为高脂食物中的主要添加剂,可促进肠道菌转运穿过肠道屏障,进而损害肠黏膜完整性,导致大量肠腔微生物转移至上皮层,最后引起肠道慢性低度炎性反应[3]。高脂饮食常见的后果就是肥胖,与IBD一样由炎症引起,其中IL-1β、IL-6和肿瘤坏死因子-α(tumour necrosis factor-α,TNF-α)等炎症因子水平在肥胖和IBD患者中均升高[4]。此外,在IBD患者的血清中发现脂肪组织分泌的炎症介质,如脂联素、抵抗素和瘦蛋白[4]。其中瘦蛋白通过产生IL-6、IL-1p以及趋化因子激活免疫反应,促进UC的发生[3]。
据小鼠模型的研究表明,仅高脂饮食不足以导致IBD,需要组合高脂饮食与遗传风险才会加剧对IBD的影响。研究表明,涉及PUFA代谢的基因与PUFA代谢物的内源性水平相关[40],且ω-3 PUFA与ω-6 PUFA的比例对IBD易感性的影响可能由脂肪酸代谢基因的遗传变异调节,如CYP4F3和FADS2[11]。这些发现均表明高脂饮食-基因的相互作用与IBD发病机制有一定的关联性,因此,进一步深入研究高脂饮食、基因及IBD三者间的关系网极其重要。
3.2 膳食蛋白对炎症性肠病发病机制的影响
食物中蛋白质的消化产物主要是氨基酸及一些小肽,约有95%经过胃和小肠被消化吸收,未吸收的氨基酸及未消化的蛋白质在大肠下部被大肠杆菌分解,进而导致IBD[41]。小鼠模型研究表明,UC与硫化物生产率相关。硫化物是含硫氨基酸到达结肠,然后通过硫酸细菌或硫酸盐还原细菌的作用转化生成的;含硫氨基酸的主要来源是高蛋白食物,如红肉、鱼、牛奶、鸡蛋等[15]。据以往研究,素食者的肠道菌群中拟杆菌属、双歧杆菌及大肠杆菌的数量较非素食者少,而摄食富含蛋白质食物者,肠道中以大肠杆菌为主的腐败菌数量明显增加,进而增加IBD的发病风险[41]。此外,蛋白质的代谢产物可能为肠道细菌提供可改变微生物组成(如导致病原体扩张)的发酵底物,进而影响肠上皮细胞功能[15]。
蛋白摄入量高,尤其是动物蛋白,与IBD的风险相关。其中动物蛋白衍生的生物活性肽可能是有益的,如蛋黄、牛奶衍生的活性肽可以减少肠道上的氧化应激,而这种抗氧化活性对IBD可能是有益的[42]。一项高蛋白膳食对限食大鼠肠道抗氧化功能影响的研究表明,高蛋白膳食通过增强机体及肠道组织局部的超氧化物歧化酶(superoxide dismutase,SOD)、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)的活性,进而减轻限食引起的氧化应激损伤达到保护肠道屏障功能的效果[43]。
膳食蛋白的消化产物氨基酸及一些肽可通过影响肠道黏膜免疫系统,进而影响IBD。研究表明,膳食丙氨酸-谷氨酸二肽通过减少炎症介质的表达,进而提高黏蛋白2和热休克蛋白72的表达,加快葡聚糖硫酸钠(dextran sulfate sodium,DSS)诱导的UC小鼠模型黏膜的恢复[42]。牛乳蛋白κ-酪蛋白衍生的糖巨肽在UC淋巴细胞转移小鼠模型中发挥抗炎作用[44]。此外,一些氨基酸在肠道系统中可能具有抗炎和抗凋亡作用,如色氨酸在DSS诱导的猪IBD模型中显示出有益的作用;以及变构调节剂作用,如谷氨酰胺二肽、芳香族氨基酸,可通过使TNF-α信号传导通路的衰减引起有效的抗炎作用,进而调节钙敏感受体(calcium sensing receptor,CaSR)的活性[44]。因此,胃肠道表达的CaSR有望成为可增强肠道健康的饮食肽或氨基酸的新型治疗靶标[44]。
3.3 碳水化合物对炎症性肠病影响的机制
碳水化合物可根据是否被小肠吸收利用分为:可消化碳水化合物(如葡萄糖、果糖、淀粉等)、不可消化碳水化合物(又称抗性淀粉,如膳食纤维、菊粉、低聚果糖及低聚半乳糖等)。与膳食脂肪观察到的结果相似,摄入碳水化合物的类型对于确定IBD发病机制的阳性或阴性作用是至关重要的[15]。
可消化碳水化合物促进IBD发生,可能是通过影响肠道的吸收机制,进而增加腔内糖浓度,促进细菌在肠道中的过度生长有关。IBD患者经常有果糖吸收不良或乳糖不耐受的现象证实了以上这一假设[11]。在小鼠研究中,高糖饮食被证明可以促进肠道发育不良、细菌病原体的膨胀、肠道通透性和炎症的增加[11]。适当调整可消化碳水化合物与不可消化碳水化合物的比例可影响肠道菌群,如降低可消化碳水化合物比例、增加不可消化碳水化合物比例能降低食物的消化吸收速率,增加到达结肠的碳水化合物数量,为结肠益生菌生长提供充足的碳源,诱导肠道菌群向有利于健康的方向转变[45]。
不可消化的碳水化合物被结肠中的微生物群发酵,以促进细菌多样性、保持黏膜屏障,并增强有利于维持肠内稳态的短链脂肪酸(short chain fatty acid,SCFA)的产生。有研究表明,广泛细胞类型表达的G蛋白偶联受体(G protein-coupled receptor,GPR)是SCFA的内源性受体,如GPR41、GPR43和GPR109a,对IBD的调节有着重要的作用(图3)[37,46-47]。膳食纤维是不可消化的碳水化合物,分为3 类:可溶性(如果胶)、不溶性(如纤维素)和混合(如麸皮)。来自水果的膳食纤维通常是可溶性或可发酵的纤维,且这种可发酵纤维被肠细菌代谢为SCFA,进而抑制NF-κB和促炎介质的转录[46]。研究发现,IBD与膳食纤维相关,特别是一些水果和十字花科蔬菜的膳食纤维,且这种关联是通过广泛分布在小肠上皮淋巴细胞内芳香烃受体(aryl hydrocarbon receptor,AhR)介导的,而被激活的AhR可保护肠上皮细胞免受抗原及异物的侵害[47-48]。

图3 短链脂肪酸对IBD的调节作用[37,46-47]Fig.3 Effects of short chain fatty acids on the regulation of IBD[37,46-47]
4 基于饮食干预的炎症性肠病防治策略
IBD患者普遍存在营养不良的症状,主要是蛋白质-能量、各种维生素、矿物质及微量元素的吸收不良导致的,且膳食成分可能通过影响氧化应激直接影响肠内平衡,影响参与调节肠道炎症的转录因子的表达[34,49-50]。因此,加强IBD的饮食干预对于预防或控制相关的营养不良,进而降低发病率和死亡率,提高生活质量至关重要[51]。
高纤维饮食可减少动物模型的结肠炎,并对IBD有积极的保护作用[52]。此外,高膳食纤维的摄入可能对结直肠癌具有保护作用。水果和蔬菜的摄入量与炎症标志物呈负相关,如C反应蛋白(C reactive protein,CRP)、IL-6、TNF-α等[52];而可发酵的膳食纤维经肠道菌群的作用生成的有益成分(如丁酸),可通过提高过氧化物酶体增殖物激活受体-γ(peroxisome proliferators-activated receptor-γ,PPAR-γ)的活性来降低结肠通透性,进而预防IBD的发生[3]。
研究表明,益生菌及益生元的治疗策略旨在恢复胃肠道微生物群落的平衡,以预防或减少IBD;益生菌含量丰富的食物对IBD有一定的缓解作用[53]。研究已证明,益生菌可操纵有益和有害细菌物种的平衡,进而调节体内平衡与炎症反应[53]。且益生菌可结合特定的肠细胞受体,定植于结肠,通过产生细菌素、乳酸、丁酸以及过氧化氢等物质抑制病原菌生长[3]。此外,益生菌在肠黏膜中与肠上皮细胞和免疫细胞相互作用,增加黏液的产生,通过紧密连接蛋白生成量的增加以及免疫反应的过表达,如免疫球蛋白A(immunoglobulin A,IgA)的生成量增加、自然杀伤细胞活性和吞噬能力的增强,进而增强肠黏膜屏障功能[3]。而益生元是一种难以消化的碳水化合物(如菊粉、低聚果糖等),能刺激宿主中特殊菌种的生长,具有改善肠道菌群的功能。这些难以消化的食物成分主要是通过增加肠道中某些细菌的数量,从而改变微生物群,当到达结肠时,它们被厌氧细菌发酵,产生有利于维持肠内稳态的SCFA[53]。综上所述,食用富含益生菌的食物及益生元类食物可改善肠道菌群,进而达到预防和治疗IBD的效果。
除宏量营养素外,微量营养素对IBD的预防及治疗也有积极的作用,可维持肠道上皮屏障、或直接影响肠免疫应答与肠微生物组成[16]。Scalabrino[54]回顾了目前关于维生素的文献发现,维生素可以对某些细胞因子和生长因子的合成具有一定的调节作用,因此,使用维生素来治疗疾病的方法可能是合理的,包括与细胞因子或生长因子合成的不平衡相关的疾病,如UC和CD[55]。且在IBD营养方案设置中所提及主要起作用的是脂溶性维生素,如VA、VD、VE和VK[56]。研究发现,VD缺乏可能促使IBD的发生,如相关研究所示,VD通过限制促炎细胞因子TNF-α和IL-12的过量产生来抑制炎症[57]。此外,VD可刺激抗微生物蛋白、导管素和一些防御素的合成来促进先天免疫,而这些抗菌肽是位于胃肠道上皮表面的先天免疫系统分子,具有抗细菌、抗病毒和抗真菌作用以及趋化细胞因子的功能[34]。以上研究均证实VD的一个关键功能是通过肠道生产抗菌因子来增强免疫力。同时,也有研究表明VA对免受肠道病原体的影响至关重要的,在VA代谢生成的维甲酸作用下,树突状细胞(dendritic cell,DC)诱导调节性T细胞,而在没有视黄酸的情况下,DC诱导辅助性T细胞17(T helper cell 17,Th17)分泌IL-17导致炎症反应。且在VA缺乏的大鼠中已经发现B细胞和T细胞向肠道的迁移受损[34]。此外,有研究者认为VK可能在IBD患者的疾病活动和骨骼健康维持中起重要作用[55]。脂溶性维生素对IBD的影响是好还是坏,仍需进行规模更大、更长期的研究[58]。
5 结 语
据流行病学及临床研究所述,饮食的单一作用不足以引起IBD的发展,而是与其他危险因素(如微生物群组、遗传学)联合作用,进而引起IBD[15]。最近研究表明,食物成分可以调节表观遗传机制,因此,深入理解不同食物成分在肠道内稳态和微生物群组中的作用可能对于揭示IBD发病机制表观遗传和环境相互作用的复杂分子基础相当重要[59]。IBD相关多态性与黏膜屏障功能、先天性细菌杀伤、免疫调节和微生物功能的改变有关[60]。饮食危险因素也对这些功能有一定的影响,并可能与遗传因素相结合,进而扩大原发性缺陷(剂量效应)或损害多种肠内稳态机制。例如,具有ECM1遗传多态性个体的上皮渗透性增加,且其可在高脂饮食的情况下进一步增加[61]。另外,饮食可以影响微生物的功能特性,导致上皮黏附和侵袭的增加,与先天细菌杀死(ATG16L1或NOD2多态性)的遗传缺陷结合时,会导致慢性炎症的持续感染[62]。且食物是影响肠道微生物群和微生物组基因相对丰度的主要因素,与此同时,微生物群组及其结构会影响食物的营养价值[63-64]。因此,研究饮食、微生物群组及遗传因素对IBD的影响时,进一步的动物模型研究不同遗传易感背景的个体饮食成分、肠道微生物群组与饮食的相互作用是必不可少的。此外,在IBD饮食干预研究中应纳入基因及微生物分析[15],为日后探索IBD个体化营养干预及治疗提供理论基础。
饮食不是影响IBD易感性及其进展唯一的环境因素,但它是最易确定和控制的因素之一;且饮食与基因组、肠道微生物组间的相互作用的研究将为探索IBD更有效的、个体化的治疗方法提供有力的依据。此外,在此基础上予以合理的饮食管理和饮食指导治疗IBD,有助于减轻与IBD相关的炎症症状和肠道损伤,对预防和控制IBD具有重要意义,并为日后研发可预防及缓解IBD的保健食品提供理论依据。
