RUNX3基因甲基化在结直肠癌发生中作用及与预后的关系研究
2019-06-04贾光辉
贾光辉 郭 民
内蒙古自治区乌兰察布市中心医院普外科,内蒙古乌兰察布 012000
结直肠癌(CRC)在全世界范围内均有较高的发病率,位居全省恶性肿瘤第3 位,近些年受多种因素影响我国疾病发病率呈上升趋势,早期有效筛查、诊断疾病对改善患者预后、提高患者生存率有重要意义[1]。RUNX3 基因是近年新发现的一种抑癌基因,其通过参与TGF-β 信号传导调控细胞分化、恶变、凋亡等过程[2]。有研究指出RUNX3 基因表达下调与基因启动子区域甲基化有关,而RUNX3基因表达下降,会导致TGF-β 信号传导抑制,造成细胞凋亡失控,从而促肿瘤生长、转移,其可能成为临床肿瘤预后评估重要指标[3]。本研究通过观察结直肠癌组织、正常黏膜组织RUNX3 甲基化状态,分析基因甲基化与疾病预后的关系,旨在为今后疾病早期诊断提供依据。
1 资料与方法
1.1 一般资料
选择2012年5月~2013年11月病理确诊为原发性CRC 患者59 例为研究对象,所有患者均行根治性切除治疗,医院伦理委员会审核通过,患者病历资料完整,未合并其他恶性肿瘤,未行放化疗,签署知情同意书。获取患者癌组织、正常黏膜组织(距肿瘤边缘10cm 以上),标本取出后即刻液氮冷却。患者年龄31~69 岁,平均(47.2±5.3)岁,肿瘤直径3.5~7.8cm,平均(5.0±1.3)cm,位置:直肠35 例、结肠24 例。

表1 不同组织RUNX3蛋白表达、甲基化状态[n(%)]
1.2 试剂、仪器
试剂、仪器:DAB 显色试剂盒、鼠抗人RUNX3单克隆抗体(美国Sigma 公司)、免疫组化SP 试剂盒(福州迈新生物技术有限公司)、DNA 提取试剂盒(中山大学达安基因有限公司)、甲基化酶(美国New England Biolabs 公司)、甲基化试剂盒(美国Zymo Research 公司)。
1.3 方法
1.3.1 免疫组化法 在获取观察标本组织后固定(10%甲醛溶液),石蜡包埋、切片(厚度5μm),烘片、脱蜡、脱水,加3%过氧化氢,行抗原高压热修复,加封闭液(山羊血清)室温封闭30min,后加一抗孵育1h(放于湿盒内,在37℃环境下),以PBS冲洗(3 次,5min/次),加二抗覆盖组织后室温孵育(30min),PBS 冲洗,加DAB 显色,苏木精复染、1%盐酸乙醇分化,脱水、透明、树胶封片。
1.3.2 MSP 检测 以DNA 提取试剂盒提取标本组织中DNA,后以甲基化试剂盒对DAN 进行修饰,后构建反应体系(0.5μL cDNA、2.5μL PCR Buffer、1μL 上 下 引 物、2μL dNTP、0.2TapE、16.3μL dd H2O)行定量PCR 扩增,条件:94℃ 5min(预变性)、94℃ 30s(变性)、65.6℃(M 甲基化反应)或61.2℃(U非甲基化反应)30s(退火)、72℃ 55s(延伸)共35个循环。后以2%琼脂糖凝胶电泳检测,自动成像仪照相分析。
引物M,上游:5’TTACGAGGGGCGGTGGTACGCGGG3’,下游:5’AAAACGACCGACGCGAACGCCTCC3’,扩增长度220。
引物U,上游:5’TTATGAGGGGTGGTTGTATGTGGG3’,下游:5’AAAACAACCAACACAAACACCTCC3’,扩增长度234。
1.4 观察指标
观察不同组织中RUNX3 蛋白表达及甲基化状态,所有患者随访5年,分析基因甲基化与疾病预后的关系。本次甲基化状态判断标准[4]:阳性,仅出现甲基化本条带或同时出现甲基化、非甲基化条带;阴性,仅出现非甲基化条带。RUNX3 蛋白表达以阳性细胞数与显色强度乘积评分进行评估[5]:阳性,乘积评分2 分以上,阴性,两者乘积1 分以下;显色强度:无色0 分,浅黄色1 分,棕黄色2 分,棕褐色3 分;阳性细胞数:0 分为阳性细胞率10%以下,11%~29% 计1 分,2 分 为30%~49%,50%以上为3 分。
1.5 统计学分析
本次数据统计学结果采用SPSS19.0 系统进行分析,计量资料以()表示,采用t检验,计数资料以[n(%)]表示,采用χ2检验,P<0.05 为差异有统计学意义。
2 结果
2.1 不同组织RUNX3蛋白表达、甲基化状态
癌组织中RUNX3 蛋白阳性表达为49.15%低于正常组织94.92%,同时RUNX3 甲基化阳性40.68%高于正常组织0,P<0.05。见表1、图1。
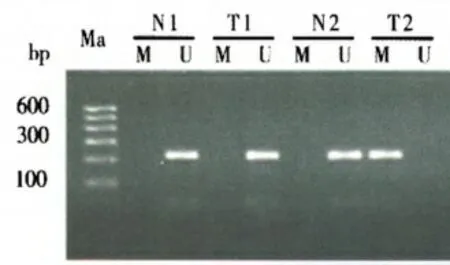
图1 RUNX3 蛋白甲基化状态(Ma 为标记,N 为正常组织,T 为肿瘤)
2.2 RUNX3甲基化状态与CRC预后关系
患者随访5年,其中24 例死亡、34 例存活、1例失访,中位生存时间51 个月,对影响患者存活的临床病理因素进行分析,淋巴结转移、RUNX3 甲基化状态与患者存活有关,P<0.05,与年龄、分期、分化程度无关,P>0.05。见表2、图2。
3 讨论
肿瘤形成是一个复杂过程,涉及基因异常表达、饮食等多方面,临床认为表观遗传学、基因序列改变是造成肿瘤发生、发展的重要原因,其中表观遗传学改变多依靠改变基因甲基化状态来实现。有研究表明人体中抑癌基因的异常甲基化会抑制癌细胞凋亡,起到促肿瘤发生,致恶性表型的作用,因此有学者提出通过检测肿瘤患者抑癌基因甲基化状态,从而来判断癌细胞侵润程度、患者预后情况[6-7]。
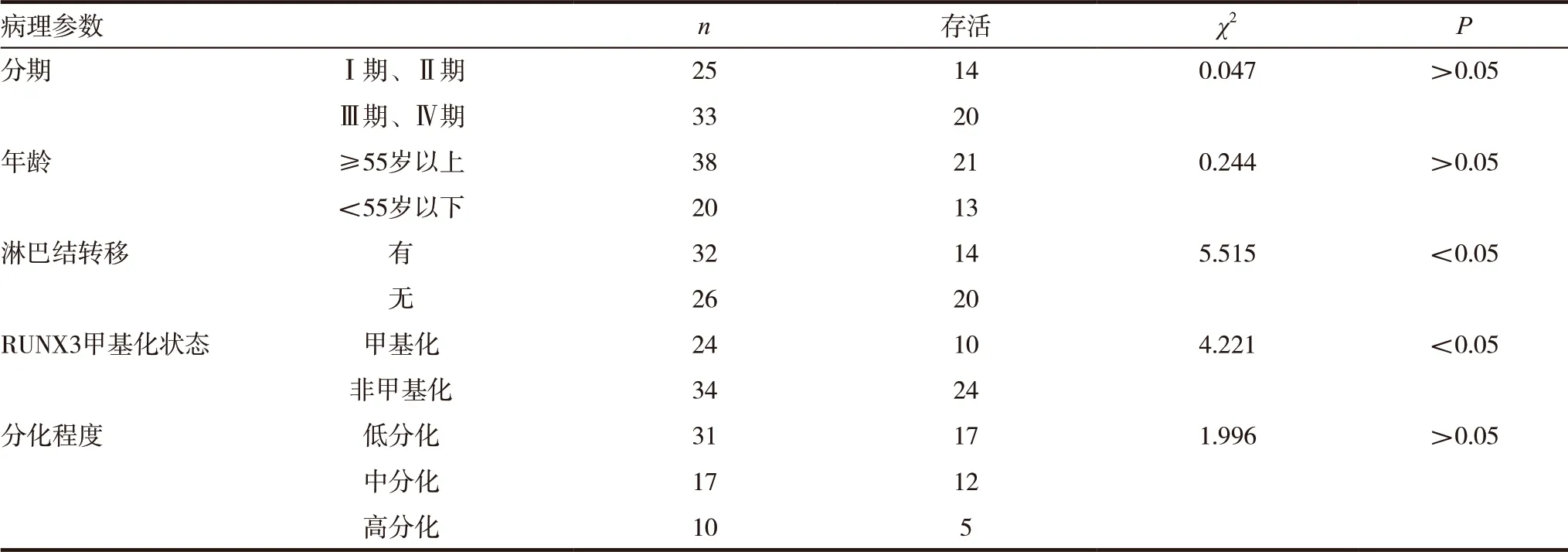
表2 患者存活的临床病理单因素分析
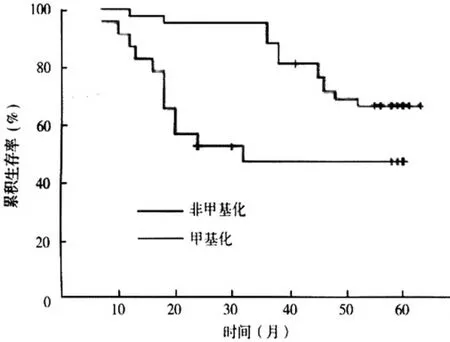
图2 CRC 者RUNX3 甲基化、非甲基化生存曲线
RUNX3 是近些年临床发现的新型基因,位于染色体lp36.1,全长67kb,其中启动子p2 可控制基因转录,有研究表明RUNX3 蛋白可通过指导TGF-β信号传导,激活Smad 蛋白复合物,使复合物转入特定核内靶点位,从而激活相关靶基因,参与细胞周期调控、恶性转变、分化等过程[8-9]。以往已有学者研究发现RUNX3 基因甲基化与胃癌发生、发展及患者预后相关,此基因甲基化除了在胃癌前病变、早期腺癌形成中发挥重要作用,同时在肺癌、膀胱癌发病中起重要作用[10-11]。但目前有关RUNX3 基因甲基与结直肠癌发生、预后关系的研究较少,故本文对此进行探究分析。本次对CRC 者癌组织、正常组织中RUNX3 蛋白表达及基因甲基化状态进行比较,发现癌组织中RUNX3 蛋白阳性表达为49.15%低于正常组织94.92%,同时RUNX3 基因甲基化阳性40.68%高于正常组织0,P<0.05,提示CRC 发生可能与RUNX3 异常表达有关,RUNX3 基因甲基化有肿瘤特异性,基因高甲基化可能与CRC发生、发展有关。本次研究中RUNX3 蛋白表达呈下降趋势,而基因甲基化状态表现为升高,提示基因甲基化可能通过阻碍转录因子、DNA 之间相互作用,抑制转录降低RUNX3 蛋白表达,致Smad蛋白功能受限,从而使细胞对正常分化过程的调节失控,癌细胞摆脱TGF-β 作用,进而促癌发生、发展[12-13]。
有学者发现术前血清CRC 甲基化者复发率高于CRC 非甲基化者,RUNX3 甲基化与CRC 肿瘤分期、淋巴结侵润有关,其认为血清RUNX3 基因甲基化可能成为疾病早期诊断、治疗预后判断的重要指标[14]。本研究观察RUNX3 甲基化状态与CRC预后关系,对患者随访5年,5年存活率为57.62%(34/59),绘制CRC 者RUNX3 甲基化、非甲基化生存曲线,发现非甲基化患者累积存活率高于甲基化患者。同时通过对影响患者存活的临床病理因素进行分析,发现淋巴结转移、RUNX3 甲基化状态与患者存活有关,P<0.05,与年龄、分期、分化程度无关,P>0.05。结果提示RUNX3 甲基化状态可作为临床判断CRC 患者预后的生物指标,但由于本次研究样本量较小,且正常黏膜组织取自CRC 患者,无法排出正常人的黏膜组织中RUNX3 表达情况,所得结论存在误差,仍有待进一步扩大样本量研究、证实结论[15]。
综上所述,RUNX3 蛋白表达、基因甲基化状态在CRC 癌组织、正常组织中存在差异,RUNX3 基因甲基化状态可能为疾病发生、预后判断提供依据。
